甲酸基肽受体2抑制滋养细胞增殖侵袭功能的机制
赵慎之,黄贤苹,项慧秋,廖婷婷,陈佳佳,许张晔
(1.温州医科大学 第二临床医学院,浙江 温州 325035;2.温州医科大学附属第二医院 妇产科,浙江温州 325027)
妊娠是一个炎症反应过程,适度的炎症反应是维持正常妊娠的重要条件之一,而过度激活的炎症反应与多种病理妊娠相关,如流产、早产、子痫前期等[1-2]。脂氧素A4(lipoxin A4,LXA4)已被证实为体内最重要的促炎症消退介质,对多种炎症细胞和炎症相关因子有着显著的负性调节效应[3]。本课题组前期发现LXA4能激活绒毛外滋养细胞(TEV-1细胞)核转录因子(nuclear factor-κB,NF-κB)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白介素-8(interleukin-8,IL-8)mRNA和蛋白的表达[4],抑制妊娠局部肥大细胞迁移而保持妊娠炎性微环境的动态平衡[5],说明LXA4在妊娠过程中起着重要作用。同时,我们发现LXA4的甲酸基肽受体2(formyl peptide receptor 2,FPR2)能在胎盘组织中表达[6]。干扰TEV-1细胞增殖、迁移和浸润的因素都可能导致妊娠相关疾病的发生,本研究探讨FPR2对人滋养层细胞迁移和侵袭过程的影响,以期找到FPR2参与病理妊娠的病因及发病机制。
1 材料和方法
1.1 材料 TEV-1细胞株由香港大学Tsao S.W教授惠赠。胎牛血清和DMEM/F-12培养基购自美国Gibco公司;总RNA提取试剂Trizol购自上海普飞公司;酶标仪购自瑞士Tecan公司;蛋白抽提、定量、凝胶配制试剂盒和ECL化学发光试剂盒购自上海鼎国生物技术有限公司;Transwell试剂盒购自美国Corning公司;MTS试剂盒购自美国Promega公司,GIEMSA染色液购自美国Sigma公司;FPR2、ILK和GAPDH抗体购自美国CST公司。PCR反应引物、FPR2的基因过表达序列均由上海吉凯有限公司设计合成。
1.2 方法
1.2.1 TEV-1细胞培养:用含10%热灭活的FBS、25 mmol/L 4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES)、100 U/mL青霉素G和100 U/mL链霉素的DMEM/F-12培养基,于37 ℃、含5% CO2的细胞培养箱中常规培养,每2 d更换培养液,待细胞汇聚率达到80%~90%时用胰酶消化传代。
1.2.2 FPR2质粒构建:获取人FPR2基因,PCR扩增FPR2基因,连接PCR产物至GV358载体中并送交基因测序。将FPR2片段亚克隆至真核表达载体上并进行鉴定。
1.2.3 质粒转染和分组:转染前24 h,细胞以(3~5)×105个/孔接种于24孔板,待细胞汇集度达约80%时转染。转染前将孔板中培养基更换为无血清培养基,转染4 h后换成含胎牛血清的正常培养基。FPR2过表达组(OE组)采用重组质粒转染,空白质粒转染组(NC组)采用空白质粒转染。
1.2.4 绿色荧光蛋白(green fluorescent protein,GFP)表达观察:于细胞转染后72 h,在荧光显微镜下观察各组GFP的表达。
1.2.5 RT-PCR:按照Trizol试剂说明书,提取总RNA后,依照Tiangen试剂盒说明进行反转录操作,制备相应cDNA。按照Takara说明书操作实时定量RT-PCR扩增引物序列为:GAPDH上游引物5’-TGACTTC AACAGCGACACCCA-3’,下游引物5’-CACCCTGTTGCTGTAG CCAAA-3’;FPR2上游引物5’-AGTCTGCTGGCTACACTGT TC-3’,下游引物5’-TGGTAATGTGGCCGTGAAAGA-3’;NF-κB上游引物5’-AGGATTTCGTTTCCGTTATGT-3’,下游引物5’-CCTGAGGGTAAGACTTCTTGTTC-3’;基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)上游引物5’-GCACCACCACAACATCAC-3’,下游引物5’-ACCACA ACTCGTCATCGTC-3’。反应条件为95 ℃、30 s预变性,95 ℃、5 s,60 ℃、34 s,40个循环,95 ℃、15 s,60 ℃、1 min,95 ℃、15 s。PCR产物在2%琼脂糖进行凝胶电泳,凝胶成像后进行定量分析。
1.2.6 Western blot:常规消化收集细胞,用细胞裂解液提取细胞总蛋白,50 mg总蛋白上样,浓缩胶80 mA、20 min,分离胶120 mA、1 h,电泳结束后,取出凝胶,300 mA恒流电转约150 min,将蛋白转移至PVDF上,转移膜用5%脱脂奶粉室温封闭l h后,分别加入一抗(抗FPR2 1:200,抗NF-κB 1:500,抗MMP9 1:1 000和抗GAPDH 1:1 000),4 ℃反应过夜,TBST漂洗4次,每次8 min,加入二抗,室温下孵育PVDF膜1.5 h,并用TBST洗膜4次,每次8 min,最后电化学发光显影。
1.2.7 Transwell法检测细胞侵袭能力:用30 μg Matrigel胶预处理Transwell小室,在上室加入100 μL细胞悬液,下室内加入600 μL 30% FBS培养基。37 ℃培养箱培养24 h后取出上室,Giemsa染色液到膜的下表面染色转移细胞3~5 min后,将小室浸泡冲洗数次,空气晾干,显微镜拍照计数穿过滤过膜的细胞数。
1.2.8 细胞划痕实验:单层TEV-1细胞培养过夜并用吸管尖端引入划痕。然后用光学显微镜拍摄0、24 h的图像。细胞迁移率用细胞迁移至初始无细胞区的百分比计算。
1.2.9 MTT法检测细胞活力:收集各组细胞,于96孔板接种,边缘孔用无菌PBS填充,每组设5个复孔,5% CO2、37 ℃细胞培养箱中孵育24、48、72、96、120 h后,每孔加20 μL 5 mg/mL MTT,继续孵育4 h,每孔沿孔壁加入100 μL DMSO,酶标仪测定490 nm处吸光度值。每个实验重复3次。
1.3 统计学处理方法 采用SPSS17.0统计学软件进行统计学分析。计量资料以±s表示,2组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 质粒的转染效率 转染72 h后,用荧光显微镜进行可视化分析,结果显示,质粒转染的细胞可见绿色荧光,超过80%的细胞表达GFP,表明感染成功(见图1)。

图1 荧光显微镜下观察TEV-1细胞(×100)
2.2 FPR2基因过表达后FPR2 mRNA和蛋白表达 FPR2基因过表达后,RT-PCR检测TEV-1的FPR2基因表达水平,结果显示OE组TEV-1细胞FPR2 mRNA水平显著升高,差异有统计学意义(P<0.01),见图2A;Western blot分析显示,FPR2基因过表达也显著增加FPR2蛋白的表达水平,差异有统计学意义(P<0.01),见图2B。

图2 FPR2基因过表达对TEV-1细胞中FPR2 mRNA和蛋白表达的影响
2.3 FPR2基因过表达抑制TEV-1细胞增殖 采用MTT比色法检测细胞增殖,结果显示在转染后72 h和96 h,OE组与NC组相比,TEV-1细胞的增殖能力下降(P<0.01),见图3。
2.4 FPR2基因过表达抑制TEV-1细胞侵袭和迁移Transwell侵袭实验结果显示OE组细胞的侵袭能力与NC组细胞相比显著下降,差异有统计学意义(P<0.05),见图4A-B。为了进一步确定FPR2对细胞迁移能力的影响,用划痕实验检测FPR2增强TEV-1细胞的迁移能力。NC组细胞自发迁移,在8 h占据划痕区域的32%,24 h占据100%划痕区域。与NC组相比,OE组在8 h内,FPR2细胞的迁移能力显著下降(P<0.01),占据划痕区域的18%,24 h后,划痕区域迁移入滋养细胞,见图4C-D。
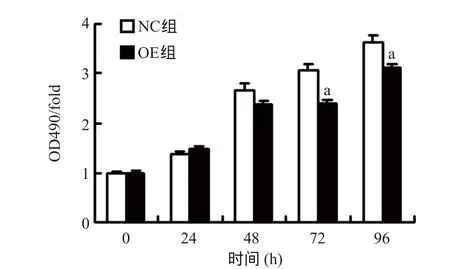
图3 MTT法检测各组细胞增殖能力
2.5 FPR2通过NF-κB/MMP9信号通路调控滋养细胞增殖侵袭功能 RT-PCR检测TEV-1细胞的NF-κB、MMP9的基因表达水平,结果显示OE组TEV-1细胞NF-κB和MMP9 mRNA水平显著下降(P<0.01),见图5A;Western blot检测TEV-1细胞的NF-κB和MMP9蛋白表达水平,结果显示OE组TEV-1细胞NF-κB和MMP9蛋白水平显著下降(P<0.01),见图5B。
3 讨论
人类胚胎着床类似于肿瘤的侵人过程,具有一定侵袭性的滋养层细胞不断侵袭母体子宫内膜,同时子宫内膜组织结构也不断发生降解和重建并伴随有大量血管发生。滋养细胞对子宫内膜的适度侵袭,在成功妊娠过程中起重要作用。滋养细胞侵袭不足以及过度凋亡是疾病的重要特征[7]。FPR2是G蛋白偶联受体,是甲酰肽受体家族的成员。LXA4以及阿司匹林诱导生成的脂氧素也是FPR2的配体,FPR2也称为FPR2/ALX[8]。FPR2在炎症过程中可被脂多糖、炎症因子、前列腺素E2等上调,发挥抗炎及促炎症消退作用[9]。目前认为,孕妇的病理生理改变可以用全身炎症反应来解释,如子痫前期就是严重的全身炎症反应[10],其发病的根源是胎盘的氧化应激反应[11]。妊娠早期妇女血清中LXA4及子宫蜕膜中FPR2 mRNA表达明显高于未孕妇女,说明妊娠早期存在母胎之间的炎症反应交联[12]。子痫前期患者胎盘中FPR2的表达明显高于血压正常者,并与血清中LXA4的水平呈正相关,推测子痫前期患者血清内LXA4的水平升高可能来源于胎盘中其受体的高表达[13]。FPR2与病理妊娠相关,任何干扰人类绒毛外滋养细胞增殖、迁移和浸润的因素都可能导致病理妊娠的发生。本研究以TEV-1细胞为研究对象,发现FPR2对TEV-1细胞的增殖能力有一定影响。过表达FPR2显著抑制TEV-1细胞的增殖能力,明显降低TEV-1细胞侵袭和迁移能力。这些结果表明,过表达FPR2可以干扰人绒毛外滋养细胞的增殖、迁移和侵袭,推测FPR2参与滋养细胞的生物学行为的调控,与流产、胎儿生长受限或子痫前期等病理妊娠的发生发展息息相关。

图4 FPR2基因过表达抑制TEV-1细胞侵袭和迁移

图5 FPR2通过NF-κB/MMP9信号通路调控滋养细胞增殖侵袭功能
NF-κB是存在于细胞的快反应转录因子,其作用为调控大量基因的转录,与其调控的细胞因子参与炎症反应、免疫反应、细胞凋亡等生物进程。MMP9降解W型胶原(子宫基底膜的主要成分)而在妊娠早期滋养细胞侵入子宫内膜过程中起到关键作用。滋养细胞的侵袭力主要依赖MMP9,只有通过蛋白水解酶降解细胞外基质的不同组分,滋养细胞才具有侵袭和迁移能力。MMP9对滋养细胞的侵袭和转移能力起着至关重要的作用。研究证实MMP9是NF-κB靶基之一,过度激活的NF-κB使得MMP9过度表达,降解细胞外基质。对NF-κB/MMP9信号通路的研究集中在肿瘤领域,激活的NF-κB信号通路及其下游靶基因基质金属蛋白酶(促进细胞转移)等参与子宫内膜癌恶性发生、发展、转移和血管生成[14]。有研究报道NF-κB在胚胎种植和胎盘发育过程中会激活[15-17]。本研究发现过表达FPR2基因之后,FPR2可以显著抑制NF-κB/MMP9信号通路的表达,NF-κB、MMP9的蛋白和mRNA水平都明显下降。过表达FPR2通过抑制NF-κB/MMP9信号通路的表达,最终抑制滋养细胞侵袭和迁移的能力。我们以往研究证实基因沉默整合素连接激酶通过下调MMP-9的表达抑制人滋养细胞的增殖、迁移和侵袭[18],FPR2与整合素连接激酶之间是否存在关联,值得进一步研究。
总之,我们的研究表明,过表达FPR2干扰人类绒毛外滋养细胞的增殖、迁移和侵袭能力;过表达FPR2通过抑制NF-κB/MMP9信号通路的表达,最终抑制滋养细胞侵袭和迁移的能力。这些发现可能为胎盘相关疾病的发病机制提供参考,为相关病理妊娠的预测及治疗提供新的依据。

