高、低侵袭性肝癌干细胞模型的建立及生物学特性鉴定
黎运呈,曾芳,丁贤君,李世波
(1.舟山医院 感染科,浙江 舟山 316000;2.舟山市妇幼保健院 产前诊断实验室,浙江 舟山316004)
肝癌是成人肝脏最常见的原发性恶性肿瘤,也是全世界最常见的恶性程度最高的实体瘤之一,其病死率位列第三[1-2]。在同一类型的肿瘤中,癌干细胞(cancer stem cells,CSCs)仍然具有异质性且可能存在不同侵袭转移能力的CSCs亚群。有学者推断肝癌是肝癌干细胞(liver cancer stem cells,LCSCs)增殖和分化形成的肿瘤器官,LCSCs的残存是肝癌复发的根源,且至少部分肝转移癌的形成应当由LCSCs来完成[3]。有研究者认为LCSCs是肝癌组织侵袭、转移的基础和源头[4]。本研究拟在前期研究[5]基础上,以高迁移肝癌细胞系(HCCLM3)为研究对象,建立高侵袭性肝癌干细胞(high-invasion liver cancer stem cells,H-ILCSCs)和低侵袭性肝癌干细胞(low-invasion liver cancer stem cells,L-ILCSCs)模型并进行生物学鉴定,为肝癌侵袭和转移的研究探索新的方向。
1 材料和方法
1.1 材料
1.1.1 主要试剂:NOD-SCID免疫缺陷鼠(6~8周龄)购自中国科学院上海实验动物中心(动物合格证号:20150005)。Mat-rigel胶和流式抗体购自美国BD公司。Transwell小室购自美国Corning公司。CCK-8试剂盒购自上海碧云天生物科技有限公司。CD133、CD44、CD90磁珠购自德国Miltenyi公司。B27购自美国Gibco公司,表皮生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)购自美国PeproTech公司。
1.1.2 细胞培养:人高迁移肝癌细胞系HCCLM3、正常肝细胞HL-7702购自上海中国科学院典型培养物保藏中心,其中HL-7702细胞是第6代。肝癌细胞HCCLM3培养:DMEM培养基加10%胎牛血清;HL-7702培养:RPMI-1640培养基加10%胎牛血清;H-ILCSCs和L-ILCSCs培养:DMEM培养基98%,B27生长因子2%,再加入EGF/bFGF,使其终浓度为20 ng/mL。所有细胞均在37 ℃,5% CO2培养箱条件下培养。
1.2 方法
1.2.1 Transwell侵袭实验分离高、低侵袭性HCCLM3细胞:参照TIE等[6]的操作方法,首先分离得到高(下室细胞)/低(上室细胞)迁移能力的HCCLM3细胞。将高迁移能力的HCCLM3细胞悬液加到Transwell小室(涂Matrigel胶)上室,24 h后,取出下室细胞,获得高侵袭能力的HCCLM3细胞;将低迁移能力的HCCLM3细胞悬液加到Transwell小室(涂Matrigel胶)上室,24 h后,取出上室细胞,获得低侵袭能力的HCCLM3细胞。
1.2.2 免疫磁珠法分选获得H/L-ILCSCs:采用免疫磁珠分选法以CD133+为分子标志分离上述高、低侵袭性HCCLM3细胞中的干细胞。参照Miltenyi公司试剂盒说明书,将高、低侵袭能力HCCLM3肝癌细胞分别悬于500 μL的分选Buffer,制备成1×108/mL的单细胞悬液,然后在细胞悬液中加入CD133磁珠微粒100 μL,4 ℃避光孵育30 min,缓冲液冲洗细胞并离心,弃上清,重悬细胞进行H/L-ILCSCs分选。1.2.3 流式细胞仪检测H/L-ILCSCs表面标志分子:参考试剂盒说明书,以CD133+、 CD90+、 CD44+为LCSCs表面标志,将分选后的H-ILCSCs、L-ILCSCs、HCCLM3和HL-7702细胞用PBS洗涤2次后重悬,调整细胞密度为1×107/mL。实验组细胞分别加入CD133-PE、CD90-PE、CD44-APC等抗体5 μL,对照组分别加入同型对照抗体5 μL,混匀后4 ℃避光孵育30 min。加入PBS清洗细胞3次,多聚甲醛固定混匀,上机检测CD133+、CD90+、CD44+的表达量,实验组重复检测3次。
1.2.4 H-ILCSCs和L-ILCSCs的鉴定及侵袭特性分析:①CCK-8法检测生长增殖能力:收集H-ILCSCs、L-ILCSCs、HCCLM3和HL-7702细胞单细胞悬液,分别调整浓度至5×104/mL。取5块96孔板接种细胞,每孔加细胞悬液100 μL,每组设平行复孔3个。分别在6、12、24、36、48 h随机选取96孔板,10 μL的CCK-8试剂加入各孔,继续孵育4 h,酶标仪于波长490 nm处测定各孔吸光度值,并取平均值。②Transwell肿瘤侵袭实验:取分离得到的对数生长期H-ILCSCs、L-ILCSCs、HCCLM3和HL-7702细胞,将细胞浓度调整至1×105/mL,吸取250 μL细胞悬液,加入Transwell小室(涂Matrigel胶),上室加入含0.5%胎牛血清的DMEM培养基,下室加入含20%胎牛血清的DMEM培养基。每组细胞重复5个样本。37 ℃孵育48 h后,用棉签去除上层小室中未侵袭迁移的细胞。然后将侵袭至下层的细胞,先用70%甲醇固定10 min,空气干燥后,用0.1%结晶紫染色,并于显微镜下计数,计算PET膜下表面的侵袭细胞数,取5个视野计数平均值(%)。③平板克隆形成实验:取对数生长期H-ILCSCs、L-ILCSCs、HCCLM3和HL-7702,梯度倍数稀释细胞悬液,取含2 mL培养基的六孔板,每孔接种100个细胞,细胞吹散均匀后继续培养,每周换液2次,10 d后终止培养。弃上清后PBS洗2次,加4%多聚甲醛固定15 min。然后去固定液,加适量GIMSA染液染色20 min,计数大于10个细胞的克隆数。④免疫缺陷裸鼠体内成瘤实验:取对数生长期的H-ILCSCs、L-ILCSCs、HCCLM3和HL-7702细胞,消化吹散制成单细胞悬液,用不含血清的PBS洗2次后,PBS重悬。体内实验分为4组,每组6~8周龄的NOD/SCID裸鼠共3只。按照1:1的比例与Matrigel混合,分别皮下接种1×107/mL上述细胞,2周后开始测量,隔天观察1次。记录皮下移植瘤形成时间及生长速度,并测量瘤体的长径和短径。
1.3 统计学处理方法 应用SPSS13.0软件进行数据统计。所得数据用±s表示,实验重复至少3次。2组均数比较采用t检验,多组均数比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞CDl33+、CD90+、CD44+表面分子标志的表达 由表1可知,与正常肝细胞HL-7702相比,H-ILCSCs、L-ILCSCs、HCCLM3细胞表面标志分子CDl33+、CD90+、CD44+的表达差异均有统计学意义(P<0.01)。H-ILCSCs和L-ILCSCs中CD133+细胞表达比例均在90%以上,说明免疫磁珠分选纯度很高。此外,CD133+细胞比例在H-ILCSCs和L-ILCSCs间差异无统计学意义(P>0.05),而H-ILCSCs和LILCSCs中CD133+细胞比例均高于HCCLM3细胞(P<0.01)。H-ILCSCs表面标志CD90+、CD44+的表达均高于L-ILCSCs和HCCLM3细胞,差异有统计学意义(P<0.01)。而L-ILCSCs和HCCLM3细胞CD90+、CD44+的比例差异无统计学意义(P>0.05)。
表1 各组细胞表面标志CDl33+、CD90+、CD44+的阳性表达率(n=3,±s,%)

表1 各组细胞表面标志CDl33+、CD90+、CD44+的阳性表达率(n=3,±s,%)
与HL-7702比:aP<0.01;与HCCLM3比:bP<0.01;与L-ILCSCs比:cP<0.01
组别 CD133+ CD90+ CD44+H-ILCSCs 94.57±1.96ab 92.16±1.55abc 91.69±0.70abc L-ILCSCs 93.39±0.99ab 12.25±1.10a 10.88±1.64a HCCLM3 16.78±3.06a 10.51±1.44a 9.52±1.65a HL-7702 1.49±0.46 1.51±0.80 1.43±0.52
2.2 各组细胞的生长增殖能力 CCK-8法检测连续培养6、12、24、36、48 h后的吸光度值,结果显示:随着时间的延长,H-ILCSCs、L-ILCSCs、HCCLM3和HL-7702细胞的生长增殖能力逐渐增高;在相同的时间点,H-ILCSCs的吸光度值明显高于LILCSCs、HCCLM3、HL-7702细胞,差异有统计学意义(P<0.05),HCCLM3的吸光度值明显高于L-ILCSCs和HL-7702细胞,差异有统计学意义(P<0.05),而L-ILCSCs和HL-7702细胞生长增殖能力差异无统计学意义(P>0.05)。因此,L-ILCSCs、HL-7702的增殖能力最弱,而H-ILCSCs的细胞增殖能力最强。见图1。

图1 H-ILCSCs、L-ILCSCs、HCCLM3和HL-7702细胞的生长增殖曲线图
2.3 各组细胞的侵袭能力 取相同细胞密度的H-ILCSCs、L-ILCSCs、HCCLM3和HL-7702细胞进行Transwell小室侵袭实验,结果发现,HCCLM3、HL-7702、H-ILCSCs和L-ILCSCs细胞平均穿膜数分别是209±36、44±12、488±6、45±8。H-ILCSCs的穿膜数是正常HCCLM3细胞的2倍多,是L-ILCSCs的近10倍,差异具有统计学意义(P<0.05)。HCCLM3的穿膜数是L-ILCSCs和正常HL-7702细胞的近5倍,差异有统计学意义(P<0.01)。而L-ILCSCs与HL-7702细胞的平均穿膜数差异无统计学意义(P>0.05)。因此,HILCSCs侵袭转移能力最强,L-ILCSCs和HL-7702细胞的侵袭能力最弱,见图2。
2.4 各组细胞的克隆形成能力 分选后的H-ILCSCs、L-ILCSCs、HCCLM3和HL-7702细胞置于相应的培养基中培养。H-ILCSCs细胞悬浮生长,5~7 d后,可见数十个细胞呈球形聚集生长;随着培养时间的延长,球体逐渐增大,形态大小各不相同;到第10天时形成典型的肿瘤球,且相对致密。HCCLM3可以形成肿瘤球,但球体明显较少,且球块不大。而LILCSCs和HL-7702细胞未见肿瘤球形成。因此,在相同细胞密度下,H-ILCSCs的克隆形成能力明显高于HCCLM3细胞,而L-ILCSCs和HL-7702细胞不能形成肿瘤球。见图3。
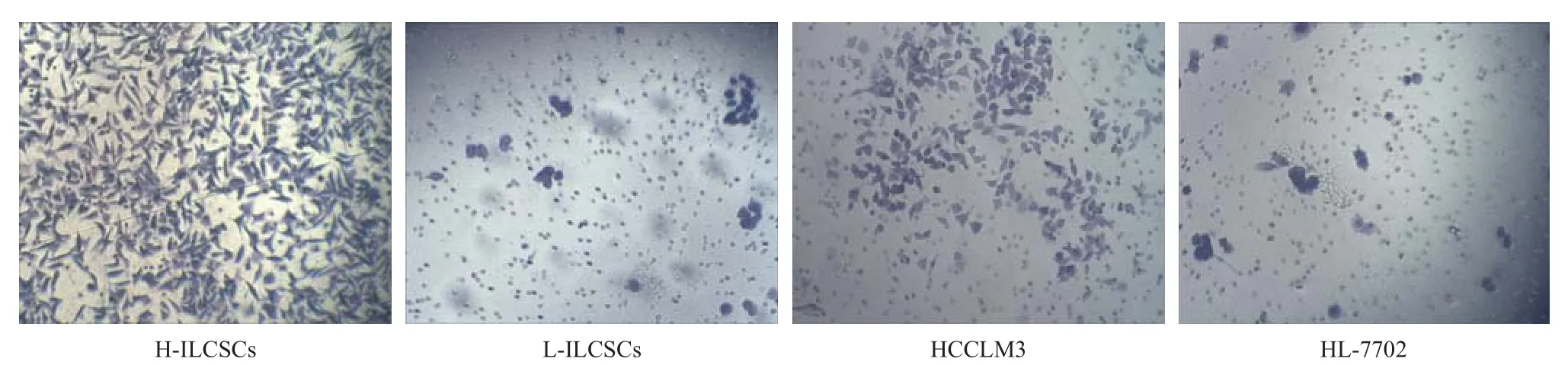
图2 Transwell侵袭实验比较H-ILCSCs、L-ILCSCs、HCCLM3和HL-7702的侵袭转移能力(结晶紫染色,×200)
2.5 接种各组细胞的免疫缺陷动物成瘤能力 接种相同H-ILCSCs和HCCLM3细胞数量的裸鼠,在2周后可观察到开始形成移植瘤,成瘤率为100%,而接种L-ILCSCs、HL-7702细胞的裸鼠未见明显的瘤体。以1×107/mL细胞密度接种,H-ILCSCs和HCCLM3形成的移植瘤体积均随着时间增加而逐渐增大,而HILCSCs成瘤潜伏期相对要短,且生长速度更快。第1、第3、第5、第7、第9天测量时,HCCLM3形成的移植瘤体积均大于HCCLM3细胞,差异有统计学意义(P<0.05)。说明H-ILCSCs相比HCCLM3、L-ILCSCs、HL-7702细胞具有更强的成瘤能力。见图4和表2。
3 讨论
上皮-间质转化(epithelial-mesenchymal transition,EMT)在肿瘤发生、侵袭、转移和复发中起着关键作用,是上皮来源癌细胞获得侵袭和转移特性的过程。有学者[7-8]认为EMT与CSCs关系密切,分化成熟的癌细胞能够通过EMT获得干细胞特性。近年研究也报道,EMT与CSCs样特性获得存在密切关联,二者通过TGF-β、Notch、Wnt/β-catenin、FGF、PI3k/Akt、Hedgehog等多种信号通路及信号串话调控网络,促进了肿瘤的侵袭、转移及复发[9]。因此,本课题组采用Transwell侵袭小室,人工模拟EMT过程,从肝癌细胞HCCLM3中分离出高、低侵袭性肝癌细胞,培养富集后,以CD133+为表面标志进行磁珠分选,分别获得H-ILCSCs和L-ILCSCs细胞,并检测了H/L-ILCSCs干细胞表面标志物CD133+、CD90+、CD44+的表达情况,最后进一步与高迁移性肝癌细胞HCCLM3和正常肝细胞HL-7702相比较,鉴定其生长增殖、体外侵袭、平板克隆形成和体内裸鼠成瘤能力等生物学特性。

图3 H-ILCSCs、L-ILCSCs、HCCLM3和HL-7702在无血清培养基中肿瘤球的形成情况(GIMSA染色,×200)

图4 接种H-ILCSCs、L-ILCSCs、HCCLM3和HL-7702细胞的免疫缺陷动物的成瘤能力(移植1×107/mL细胞,成瘤后第9天观察)
表2 接种H-ILCSCs和HCCLM3细胞的免疫缺陷动物移植瘤体积比较(n=3,±s,mm3)

表2 接种H-ILCSCs和HCCLM3细胞的免疫缺陷动物移植瘤体积比较(n=3,±s,mm3)
与HCCLM3比:aP<0.05,bP<0.01
组别 第1天 第3天 第5天 第7天 第9天HCCLM3 102.18±40.40 174.54±92.45 215.88±123.45 366.73±163.63 585.60±69.62 H-ILCSCs 316.43±28.91a 507.40±27.95a 785.37±107.86a 1 086.16±106.02a 1 445.69±39.99b
分选后H-ILCSCs和L-ILCSCs细胞表面分子标志CD133+细胞比例分别为94.57%±1.96%和93.39%±0.99%,说明磁珠分选纯度很高。H-ILCSCs细胞表面标志CD90+、CD44+细胞比例分别为92.16%±1.55%和91.69%±0.70%,与HCCLM3和HL-7702细胞比较差异有统计学意义(P<0.01),说明CD133+、CD90+、CD44+可以作为H-ILCSCs的分选标志物,这与BAHNASSY等[10]观点一致。此外,L-ILCSCs细胞CD133+细胞比例和H-ILCSCs组差异无统计学意义,而其CD90+、CD44+细胞的比例明显低于H-ILCSCs细胞,与HCCLM3细胞差异无统计学意义,说明L-ILCSCs表达低水平的干性相关分子CD90+和CD44+,LCSCs表面分子标志的表达可能具有异质性。这与WRIGHT等[11]的观点相同,他们在对Brcal基因缺陷乳腺癌小鼠的研究中发现,来源于该类乳腺癌的细胞中含有2种不同表型的CD44+/CD24-和CD133+亚群细胞,都具有CSCs样特征,且这2种表型的细胞没有重叠,推测CSCs具有异质性。
在增殖实验中,H-ILCSCs的吸光度值在作用相同时间时均较L-ILCSCs、HCCLM3、HL-7702细胞明显增高,体现了最强的体外增殖能力,而L-ILCSCs生长增殖能力明显低于HCCLM3细胞,与HL-7702细胞增殖能力无统计学差异,可见即使是同一种肿瘤内,CSCs可能存在不同增殖能力的亚群干细胞;在Transwell肿瘤侵袭实验中,H-ILCSCs侵袭转移能力最强,远高于L-ILCSCs、HCCLM3、HL-7702细胞,而L-ILCSCs侵袭能力明显低于HCCLM3细胞,与HL-7702细胞无统计学差异,可见,LCSCs中可能存在不同侵袭转移能力的CSCs亚群。这与BRABLETZ等[12]、HERMANN等[13]和VISVADER等[14]的观点类似,他们提出了静止性CSCs和转移性CSCs的概念,认为CSCs具有异质性,肿瘤发生和转移的主力“种子”是具有高侵袭和转移潜能的CSCs导致的,肿瘤转移是具有转移能力的CSCs内在特性的表现,它决定了恶性肿瘤的演进、复发和转移,而静止性CSCs负责维持原发瘤的生长,不具有迁移和侵袭能力。本研究平板克隆形成和免疫缺陷动物成瘤能力实验中,HILCSCs和HCCLM3细胞形成的移植瘤体积均随着时间的增加而逐渐增大,且H-ILCSCs裸鼠成瘤潜伏期相对较短,生长速度更快,形成的克隆球和移植瘤体积明显大于HCCLM3细胞,而L-ILCSCs未见体外克隆球和体内裸鼠成瘤形成,这进一步说明LCSCs具有异质性且可能存在不同侵袭转移能力的CSCs亚群,其中H-ILCSCs是专门负责肝癌细胞侵袭、转移的一部分CSCs,而L-ILCSCs成为非侵袭转移性CSCs。
综上所述,本研究发现HCCLM3细胞中可以分离和富集不同侵袭能力的CSCs亚群(H-ILCSCs和L-ILCSCs),且H-ILCSCs的干性特征高于L-ILCSCs,而L-ILCSCs干性特征低于HCCLM3细胞。因此,本研究认为LCSCs具有异质性,可建立更为可信的HILCSCs和L-ILCSCs模型,且二种LCSCs间存在着生物学特性的差异。在肝癌防治研究或药物筛选中,可通过靶向定位于H-ILCSCs,并力求将H-ILCSCs全部清除。

