HLA-G阳性的胎盘间充质干细胞对NK细胞杀伤功能的影响
崔桂玉 白剑 苗兰英 林大勇 刘鸿
1内蒙古民族大学医学院(内蒙古通辽028000);2辽宁中医药大学(沈阳 110847)
胎盘间充质干细胞是成体干细胞的一种,由于其具有低免疫原性、来源广泛和免疫抑制的特点,目前已经应用于临床治疗缺血性疾病和预防移植物抗宿主病等[1-2]。由于体内免疫系统存在使得外源性输入的胎盘间充质干细胞很快的被淋巴细胞识别、杀伤,这些因素直接导致胎盘间充质干细胞在体内存活的时间和数量减少[3]。人类白细胞抗原-G(human leucocyte antigen-G,HLA-G)属于非经典的HLAⅠ类分子,在孕妇体内表达较高,其主要功能是诱导母婴耐受,近年来的研究表明HLA-G对于自然杀伤淋巴细胞(natural killer lymphocyte,NK)、CD4+T淋巴细胞和B淋巴细胞具有抑制作用[4-5]。HLA-G可以直接与NK与KIR2DL4受体相互作用,阻断MAPK和DNA-PKcs信号通路,抑制NK杀伤活性[6]。胎盘间充质干细胞能够表达HLA-G,孕酮可以调节HLA-G表达强度,在一定程度上增强胎盘间充质干细胞的免疫抑制功能,但是HLA-G表达与孕酮的浓度呈现计量依赖性,当孕酮消失后HLA-G表也随之降低并逐步消失[4,7]。外源性的转染 HLA-G 基因可以持续的表达该蛋白,有效的增强胎盘间充质干细胞的免疫抑制功能,将HLA-G阳性的胎盘间充质干细胞与NK细胞混合培养,检测NK细胞对HLA-G阳性的胎盘间充质干细胞杀伤作用。
1 材料与方法
1.1 材料NK92mi细胞株和NK92mi培养基(北京鼎国昌盛生物科技有限公司);DMEM/DF12培养基和PBS(美国Gibco公司);胎牛血清(杭州四季青公司);CytoTox 96®Non-Radioactive Cytotoxicity Assay(普洛麦格北京生物技术有限公司);单克隆抗体CD45-Percp/CD34-PE/HLA-DR-FITC/CD29-PE/CD44-FITC/CD105-APC(美国BD公司);PEGFP-N1-HLA-G全基因合成质粒(北京奥科鼎盛生物科技有限公司);LipofectamineTM2000(Invitrogen公司);HLA-G特异性单抗4H84和α-Tublin(Santa Cruz公司);二氧化碳培养箱(美国Thermo Fisher公司);0.25%胰酶(美国Sigma公司);550酶标仪(美国Bio-Rad公司);蛋白电泳及电转移装置(美国Bio-Rad公司)。
足月新生儿胎盘取自于辽宁中医药大学附属医院,取得父母知情同意书后,经本院伦理委员会讨论通过用以制备胎盘间充质干细胞。
1.2 方法
1.2.1 胎盘间充质干细胞的分离培养及鉴定将胎盘表面用75%的酒精消毒后,并用生理盐水反复冲洗3次。将胎盘在超净工作台中用眼科剪刀将胎盘剪成大小约为1~2 mm2的碎块,放入50 mL的离心管中,用生理盐水冲洗后离心直至离心管中的生理盐水澄清为止。经过在1 500 r/min离心5 min后弃去上清液,加入含0.25%胰酶和0.1胶原酶Ⅳ的生理盐水30 mL并放置于培养箱中30 min,使得酶在37℃能够充分的发挥活性。用100目的滤网过滤胎盘碎块,将过滤液体放入15 mL离心管中收集,并在1 500 r/min离心5 min后弃去生理盐水,在离心后的细胞沉淀中加入10%胎牛血清的DMEM/DF12培养基充分混匀并转移至培养瓶中。待细胞贴壁后生长至融合度90%左右时用0.25%的胰酶将细胞消化按照1∶3接种于新的培养瓶中。当传代后的细胞进入指数生长期后,将细胞消化制备单细胞悬液并调整浓度至1×106个/mL,取200μL细胞悬液,分别加入CD45-Percp/CD34-PE/HLA-DR-FITC/CD29-PE/CD44-FITC/CD105-APC流式抗体各5μL,避光室温孵育20 min后流式细胞仪上检测。
1.2.2 胎盘间充质干细胞转染HLA-G基因及鉴定将指数生长期的胎盘间充质干细胞2×105个接种到6孔板内,加入10%胎牛血清的DMEM/DF12培养基3 mL,待细胞融合度达到80%左右进行转染。分别取LipofectamineTM2000试剂1.5μL与PEGFP-N1-HLA-G及空载体PEGFP-N1各0.5μg用DMEM/F12稀释到200μL,将混合后的LipofectamineTM2000室温放置30 min。弃去6孔板内含血清的DMEM/F12培养基并用PBS冲洗细胞2次,并在每一孔中加入1 000μL无血清DMEM/F12培养基,之后将200μL混有PEGFP-N1-HLA-G及空载体PEGFP-N1的LipofectamineTM2000的DMEM/F12分别滴入6孔板内,在二氧化碳培养箱内孵育4 h后弃去转染液,加入含有10%胎牛血清的DMEM/DF12培养基3 mL在培养箱内继续培养20 h。
收集6孔板中转染后的胎盘间充质干细胞,通过蛋白裂解液裂解后,收集到1.5 mL EP管中,煮沸5 min后12 000 r/min离心1 min,弃上清备用。BCA法进行蛋白定量,向SDS-PAGE凝胶中加入样本,电泳分离后电转移至PVDF膜。5%脱脂奶粉4℃封闭过夜。加入HLA-G(1∶1 000)和α-Tublin(1∶1 000)抗体4℃孵育过夜后,加入二抗37℃孵育30 min。采用凝胶成像分析系统检测各条带的吸光度值并计算蛋白的相对表达量。
1.2.3 NK细胞杀伤性实验将胎盘间充质干细胞、转染空载体PEGFP-N1的胎盘间充质干细胞及转染PEGFP-N1-HLA-G的胎盘间充质干细胞计数,按照每孔1 000个细胞接种于96孔板内,每组设置5个复孔,待细胞贴壁后吸取上清液,按照NK-92mi细胞与实验效应细胞10∶1的比例在96孔板内的每一个孔中加入10 000个NK-92mi,并混合培养4 h。同时设置一组无细胞的上清液组作为空白对照组,用于计算细胞的杀伤率。按照CytoTox 96®Non-Radioactive Cytotoxicity Assay试剂盒说明书进行,将培养基与细胞裂解液体积比10∶1加入上述96孔板中,在重力加速度为250×g情况下离心4 min,取出CytoTox 96的每一孔中加入50μL裂解后的上清液,室温下静置避光30 min,后加入终止液,用酶标仪在490 nm波段检测光密度值。细胞的溶解率计算公式为溶解率=(对照组光密度值-实验组光密度值-空白对照组光密度值)/(对照组光密度值-空白对照组光密度值)×100%。
1.3 统计学方法采用SPSS 16.5统计软件。符合正态分布的计量资料以x±s表示,采用单因素方差分析,组间的比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 胎盘间充质干细胞的表面分子的鉴定第二代胎盘间充质干细胞通过流式细胞检测干细胞标记物,其中CD45、CD34和HLA-DR呈阴性表达,CD29、CD44和CD105呈阳性表达。其中CD29阳性表达率为98.1%,CD44阳性表达率为99.3%,CD105阳性表达率为98.9%(图1)。

图1 胎盘间充质干细胞表面受体表达Fig.1 Receptor expression on placenta-derived mesenchymal stem cells
2.2 胎盘间充质干细胞转染HLA-G基因的鉴定空白对照组中HLA-G蛋白的相对表达量为PEGFP-N1-HLA-G转染组的(0.23±0.05)倍,空白对照组与PEGFP-N1-HLA-G组相比结果差异有统计学意义(P<0.01);PEGFP-N1转染组中HLA-G蛋白的相对表达量为PEGFP-N1-HLA-G转染组的(0.27± 0.03)倍,PEGFP-N1转染组与PEGFP-N1-HLA-G组相比差异有统计学意义(P<0.01)。见图2。
2.3 NK细胞杀伤性实验经过试剂盒检测后,胎盘间充质干细胞的细胞溶解率(67.53±3.57)%,转染空载体PEGFP-N1的胎盘间充质干细胞的细胞溶解率(69.13±4.11)%,转染PEGFP-N1-HLA-G的胎盘间充质干细胞的细胞溶解率(51.22±3.87)%,转染PEGFP-N1-HLA-G的胎盘间充质干细胞组与胎盘间充质干细胞组相比差异有显著性(P<0.05、图3)。
3 讨论
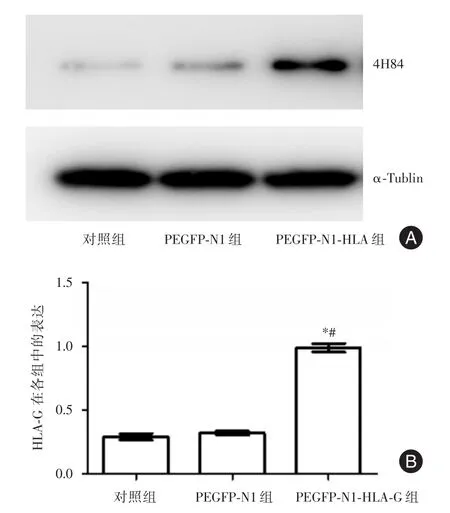
图2 对照组、PEGFP-N1组和PEGFP-N1-HLA-G组中HLAG表达Fig.2 HLA-Gexpression on placenta-derived mesenchymal stem cells in control group,PEGFP-N1group,PEGFP-N1-HLA-Ggroup

图3 对照组、PEGFP-N1组和PEGFP-N1-HLA-G组中细胞的溶解率Fig.3 Dissolution rate of cells in control group,PEGFP-N1 group,PEGFP-N1-HLA-Ggroup
胎盘间充质干细胞容易获得,且增殖速度快,免疫原性低,目前已经广泛应用于移植排斥和自身免疫性疾病,是目前最具前景的间充质干细胞之一。胎盘间充质干细胞存活率是影响其应用的重要因素之一,目前对胎盘间充质干细胞在体内的清除过程仍然不明,可能与宿主对外源性细胞的清楚和胎盘间充质干细胞代谢周期有关。HLA-G是具有免疫抑制功能的蛋白,在器官移植受者体内和孕妇体内均能检出,HLA-G的表达使得胎盘间充质干细胞增强免疫抑制功能,并通过抑制NK细胞表面受体KIR2DL4增加在在受者体内的存活时间和数量。有研究显示,HLA-G可以通过孕酮的调节增强胎盘间充质干细胞表面的表达,并且与孕酮的浓度呈现计量依赖性,当孕酮消失后HLA-G表也随之降低并逐步消失[8-10]。通过转染的方式可以使得胎盘间充质干细胞获得持续高表达的HLA-G,从而增强HLA-G阳性的胎盘间充质干细胞的免疫抑制功能[4]。
目前,胎盘间充质干细胞在临床的治疗以双向免疫调节为主,即存在免疫增强作用也存在着免疫抑制作用,因此在自身免疫病、缺血性疾病、器官移植等多个领域均有应用[11]。如果有效增强胎盘间充质干细胞在受者体内的存活数量和时间,就可以增强胎盘间充质干细胞在受者体的功能。因此本次实验在此基础上,通过外源性的对胎盘间充质干细胞修饰HLA-G蛋白,检测HLA-G阳性的胎盘间充质干细胞是否可以逃避NK细胞的杀伤。结果表明,胎盘间充质干细胞的细胞溶解率(67.53±3.57)%而转染PEGFP-N1-HLA-G的胎盘间充质干细胞的细胞溶解率(51.22±3.87)%,这提示HLA-G抗原可作为免疫耐受分子,直接参与抑制NK细胞的免疫功能,对于提高胎盘间充质干细胞存活率有明确作用。但本实验目前仅局限于体外实验,体内试验是否有类似的结果仍然待于进一步观察。

