miRNA-21、miRNA-34a在宫颈癌、CIN、正常组织中的差异性表达及对宫颈癌早期诊断价值
周玉飞 岳青芬
郑州大学附属洛阳中心医院妇科(河南洛阳 471000)
宫颈癌是女性生殖系统最常见的恶性肿瘤之一,随着我国社会经济的发展、人们性观念、生活习惯的改变,近年来发病年龄呈年轻化趋势[1-2]。组织活检、宫颈刮片细胞学检查是诊断宫颈癌较为准确的方法,但在实际中难以用于高危患者的大规模筛查。同时,部分患者在首次就诊时,因组织活检等检查的有创性,依从性较低,因此,寻找经济、快捷、简便的诊断及预后判断方法仍然是临床工作的难点[3]。miRNA是一类非编码单链RNA分子,广泛参与肿瘤细胞的增殖、浸润、迁移等过程,可发挥类癌基因或抑癌基因作用[4-5]。在胃癌[6]、结肠癌[7]、胰腺癌[8]等恶性肿瘤中均发现了多种差异性表达的miRNA。miRNA-21、miRNA-34a是较早发现的人类miRNAs[9],参与了多种肿瘤的发生发展,但在宫颈癌中的研究较少。因此,本研究检测了不同类型患者组织及血清中二者的表达差异,分析其临床意义。
1 对象与方法
1.1 研究对象选取2017年1-8月我院收治的宫颈癌、CIN、子宫肌瘤患者为研究对象,分为:(1)对照组:因子宫肌瘤行手术治疗的31例患者;(2)CIN L组:低级别上皮内瘤变Ⅰ级的31例患者;(3)CIN H组:高级别上皮内瘤变Ⅱ级、Ⅲ级的28例患者;(4)宫颈癌组:因宫颈癌行手术治疗,且无宫颈相关病变的42例患者。纳入标准:(1)诊断均经病理学或细胞学证据确认;(2)均行手术治疗;(3)术前未行放化疗;(4)临床资料完整;(5)知情同意。排除标准:(1)同时合并有其他系统的恶性肿瘤;(2)合并有其他重要系统的严重疾病或免疫性疾病。
1.2 标本与试剂规范化收集新鲜手术切除标本,切成大小适宜的组织块,在标本离体后30 min内置于冻存管,在-70℃条件下保存。在术前2 d抽取患者血液标本,离心后取血清,置于EP管内,加入裂解酶,充分震荡后冻存。miRNA逆转录试剂盒、PCR Master Mix、DNA Marker、Protein Marker均购于Takara公司(大连)。PCR引物、DEPC购于博士德生物工程有限公司(武汉)。
1.3 实验方法(1)组织中总RNA提取:标本装入EP管,滴加Trizol试剂,匀碎后静置5 min。加入氯仿0.2 mL后震荡,静置10 min。4℃,12 000 r/min,离心15 min后管内液体分为上中下三层,吸取上层水相至EP管,加入异丙醇,混匀后静置15 min。再次离心15 min,弃上清,取管底白色沉淀,加入冰乙醇1 mL,混匀后离心,弃上清,重复操作后,保留沉淀,静置30 min。加入DEPC水约20~30μL至完全溶解。采用分光光度计计算RNA纯度及浓度。取1μg总RNA,电压100 V,电泳30 min。提取的总RNA,-80℃条件下保存。(2)逆转录反应:参照miRNA反转录试剂盒说明书进行。将反应体系混匀后,瞬时离心,42 ℃ 60 min,70 ℃ 10 min,所得cDNA置于-80℃下保存。(3)RT-PCR检测:以cDNA为模板,严格按照荧光定量试剂盒说明书进行操作。反应体系包括:cDNA 1 μL、2×PCRMaster Mix 10μL、Forward primer 1μL、Reverse primer 1μL、10×SYBER Green 0.5 μL、ddH2O 6.5 μL。反应条件为,Stage1:95 ℃ 10 min;Stage2(40 cycle):95 ℃ 15 s、60 ℃ 30 s、72 ℃ 30 s。(4)PCR产物相对定量检测:以U6为内参对目标基因进行归一化处理,采用公式RQ=2-△△CT计算表达量倍数的变化(RQ:相对表达量,C:cycles,T:threshold)。
1.4 统计学方法所有数据均采用SPSS 20.0软件包进行。描述性分析采用频数、率±s,统计推断采用独立样本t检验、方差分析、卡方检验。采用受试工作者特征曲线(ROC)评价miRNA-21、miRNA-34a对宫颈癌的诊断效能。相关性分析采用Pearson分析。检验水准α=0.05。以P<0.05为差异具有统计学意义。
2 结果
2.1 RT-PCR检测组织表标本中miRNA-21、miRNA-34a结果miRNA-21、miRNA-34a的扩增曲线平滑,呈标准S型。溶解曲线表现为单峰,无其他杂峰信号。表明实验过程中未出现非特异性扩增、污染或引物二聚体,检测结果可靠。见图1。
图1 miRNA-21、miRNA-34a扩增曲线(a)、溶解曲线(b)Fig.1 miRNA-21、miRNA-34a amplification curve(a)and dissolution curve(b)
2.2 miRNA-21、miRNA-34a在组织中的表达水平对照组、CIN L组、CIN H组、宫颈癌组组织中miRNA-21表达水平的 2-△△CT值分别为(1.12 ±0.46)、(1.22 ± 0.52)、(1.44 ± 0.72)、(5.64 ± 1.57);miRNA-34表达水平的 2-△△CT值分别为(0.91 ±0.23)、(0.85 ± 0.28)、(0.53 ± 0.30)、(0.22 ± 0.21)。宫颈癌患者组织组中miRNA-21表达水平显著高于其他3组,miRNA-34a表达水平显著低于其他3组,差异均具有统计学意义(P<0.01)。见图2。

图2 miRNA-21(a)、miRNA-34a(b)在组织中的表达水平Fig.2 The expression level of miRNA-21(a)and miRNA-34a(b)in tissues
2.3 宫颈癌组织中miRNA-21、miRNA-34a表达水平与临床病理特征关系单因素分析结果显示,miRNA-21在宫颈癌组织中的表达水平与临床分期、是否存在淋巴结转移相关(P<0.05),进一步行多因素Logistic回归分析发现,临床分期、是否存在淋巴结转移均是影响miRNA-21表达水平的独立性危险因素。miRNA-34a在宫颈癌组织中的表达水平对各临床病理参数无明显影响。见表1、2。
2.4 miRNA-21、miRNA-34a在血清中的表达水平对照组、CIN L组、CIN H组、宫颈癌组患者血清miRNA-21表达水平的2-△△CT值分别为(0.95 ±0.36)、(0.93 ± 0.32)、(1.18 ± 0.67)、(3.06 ± 1.86);miRNA-34表达水平的2-△△CT值分别为(0.97 ± 0.22)、(0.91 ± 0.26)、(0.59 ± 0.29)、(0.35 ± 0.26)。宫颈癌组患者血清中miRNA-21表达水平显著高于其他3组,miRNA-34a表达水平显著低于其他3组,差异均具有统计学意义(P<0.01)。见图3。

表1 宫颈癌组织中miRNA-21、miRNA-34a表达水平与临床病理特征的单因素分析Tab.1 Univariate analysis of miRNA-21,miRNA-34a expression and clinicopathological features in cervical cancer tissues
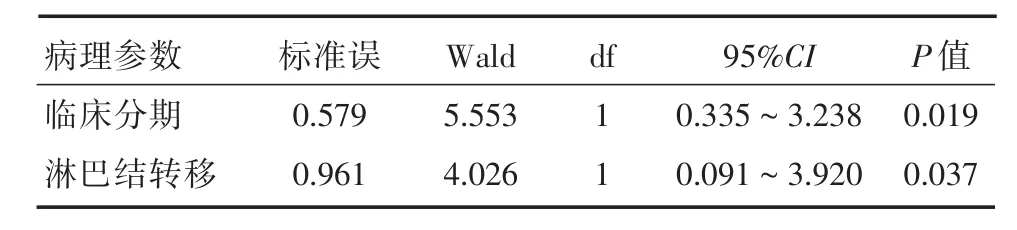
表2 宫颈癌组织中miRNA-21、miRNA-34a表达水平与临床病理特征的多因素分析Tab.2 Multivariate analysis of miRNA-21,miRNA-34a expression and clinicopathological features in cervical cancer tissues
2.5 miRNA-21、miRNA-34a在组织及血清中表达水平的相关性miRNA-21在组织及血清中的表达呈显著正相关关系(r=0.763,P<0.01);miRNA-34a在组织及血清中的表达也呈显著正相关关系(r=0.908,P<0.01)。见图4。
2.6 血清miRNA-21、miRNA-34a对宫颈癌的诊断效能达最佳临界点时,miRNA-21对宫颈癌诊断的敏感性为87.9%、特异性为78.8%,曲线下面积(AUC)为0.885;miRNA-34a对宫颈癌诊断的敏感性为92.8%、特异性为64.8%,曲线下面积(AUC)为0.870。见图5。

图3 miRNA-21(a)、miRNA-34a(b)在组织中的表达水平Fig.3 The expression level of miRNA-21(a)and miRNA-34a(b)in tissues

图4 miRNA-21(a)、miRNA-34a(b)在组织及血清中表达水平散点图Fig.4 Scatter plot of expression levels of miRNA-21 and miRNA-34a in tissues and serum
3 讨论

图5 miRNA-21(a)、miRNA-34a(b)对宫颈癌诊断效能的ROC曲线Fig.5 ROCcurve of miRNA-21(a)and miRNA-34a(b)for diagnosis of cervical cancer
目前,人类已知1 000多种miRNA,虽然仅占人类基因组的不到3%,但超过30%的人类基因可能被miRNA调节[10]。miRNA参与肿瘤进展的可能的机制包括[11]:(1)异常激活癌基因。(2)沉默抑癌基因。(3)诱导肿瘤血管生成。(4)增强肿瘤侵袭力。(5)调控凋亡基因。与其他选择性较强的miRNA相比,miRNA-21的最大特点在于表达部位广泛[12]。大多数研究均认为miRNA-21在恶性肿瘤中表达水平上调,但也有研究认为,miRNA-21可发挥抑癌基因作用[13]。在本研究中,宫颈癌患者组织及血清中miRNA-21表达水平显著高于其他组。这表明,miRNA-21在宫颈癌组织中呈显著升高趋势,且与临床分期、是否存在淋巴结转移密切相关。miRNA-21主要通过参与调控细胞周期及细胞凋亡作用参与肿瘤进展,在不同类型肿瘤细胞中,作用机制可能有所不同。但在宫颈癌中,miRNA-21表达水平升高可使肿瘤恶性特征更为显著,可作为判断患者预后的一个潜在因子。miR-34a是已发现的最具有肿瘤抑制性miRNA,在许多实体肿瘤,如非小细胞肺癌[14]、膀胱癌中[15]均表达下调,因此也被认为是最具潜力的调控宫颈癌细胞增殖、凋亡的新靶点。在本研究中,患者组织、血清中miR-34a表达水平均显著低于其他组,但患者临床病理参数无明显影响。这表明,随着正常宫颈上皮组织逐渐向上皮内瘤变、癌症方向转化,其表达水平逐渐下降,这提示miRNA-34a可能具有抑癌基因作用,但这种抑癌作用机制尚不明确。不同于miRNA-21的是,miRNA-34a对患者临床病理特征无明显影响,笔者推测可能的原因有:(1)miRNA-34a对宫颈癌进展的抑制作用弱于其他恶性因素的促进作用。因此,实际临床中难以体现miRNA-34a的保护作用;(2)miRNA-34a表达水平较低,数据不易显示出统计学意义。
miRNA-21、miRNA-34a在组织和血清中呈现相关性表达,这是将二者用于临床诊断的前提条件。在此基础上,笔者采用ROC曲线评价二者对宫颈癌的诊断效能。结果发现,miRNA-21、miRNA-34a对宫颈癌诊断的敏感性为87.9%、92.8%,特异性为78.8%、64.8%,这表明二者对宫颈癌均具有一定的诊断价值。定期妇科检查、血清肿瘤标志物检测、宫颈细胞学检测、阴道镜检查等是宫颈癌治疗后随访的主要措施。但实际操作中,存在耗时长、程序繁琐、费用高、患者依从性差等问题。随着血清miRNAs检测的逐渐兴起,采血后,根据血清miRNA水平随访评价患者体内肿瘤负荷,为患者的术后随访提供了新的途径。但在目前的研究阶段,笔者仅仅能肯定血清miRNA水平对判断患者预后有一定作用,但由于缺少对血清miRNA半衰期、水平变化规律及影响因素等诸多方面的系统性研究,真正将miRNA用于临床筛查、诊断及随访仍有许多问题需要解决。
综上所述,本研究发现,miRNA-21在宫颈癌组织中及血清中表达水平明显升高、miRNA-34a明显降低,在肿瘤组织及血清中的表达水平均呈正相关关系,提示miRNA-21、miRNA-34a参与了宫颈癌的发生发展过程,且二者对宫颈癌的诊断有一定的预测效能。但本研究样本量较小,随访时间较短,尚不能进一步说明miRNA-21、miRNA-34a表达水平与患者预后及复发的关系,未来在更大样本量,更长随访时间的基础上进行多中心研究,或能得到更有价值的临床结论。

