甲烷氧化偶联制乙烯机理和动力学研究进展
李 鹏,张明森,武洁花
(中国石化 北京化工研究院,北京 100013)
天然气作为现代工业三大能源(煤、石油、天然气)之一,具有优质、清洁、储量丰富的优点。甲烷是天然气中的主要成分,目前针对甲烷主要有两个利用途径[1]:一是甲烷的间接利用;二是甲烷的直接利用。甲烷的间接利用是甲烷通过水蒸气重整反应生成的合成气再进一步转化成甲醇、合成氨、二甲醚等,这是甲烷最主要的利用途径,但在甲烷间接转化的两个过程中都需要消耗大量的能量,因此甲烷的直接利用成为研究的重点。甲烷的直接转化有多种途径,可直接氧化偶联生成乙烯和乙烷,也可选择氧化生成甲醛和甲醇,还可直接部分氧化生成合成气,由于产物中乙烯是石油生产中重要的化工基础原料,甲烷的氧化偶联生成乙烯成为研究的焦点。
1982年Keller等[2]提出甲烷氧化偶联制乙烯的研究技术,并迅速引起了各国科学家的广泛关注,但由于反应过程难以控制,研究成果一直未达到工业期望的效果。2006年,该研究方向伴随纳米技术和反应器设计理念的发展,再度呈现光明的前景[3]。催化反应动力学是研究催化反应速率与过程变量之间的关系。通过研究甲烷氧化偶联反应机理和动力学,对反应催化剂的研发、反应器的研发和生产装置实现最优化操作,具有重要的指导意义。
本文综述了近年来甲烷氧化偶联催化反应的主要反应机理模型和动力学模型,为催化剂和催化反应器的研究与设计提供依据。
1 甲烷氧化偶联动力学反应机理
甲烷氧化偶联反应的动力学模型与甲烷和O2结合的机理密切相关,不同的催化剂对应了不同的反应机理。关于甲烷氧化偶联的反应机理,研究者们进行了大量的研究[4]。Morales等[5]通过 EPR 光谱发现了大量的甲基自由基和[LiO]+的存在,提出甲基自由基是该反应的中间产物。此后,研究者提出甲烷氧化偶联反应分两步走的反应机理:首先甲烷吸附在催化剂表面,脱去一个H原子生成甲基自由基,然后甲基自由基偶联生成乙烷分子,乙烷分子脱氢生成乙烯。有文献报道了甲烷氧化偶联反应中O2分子的非解离吸附机制[6-7],也有文献支持O2分子的解离吸附机制。Takanable等[8]进行了同位素干扰研究实验(使用CD4/CH4,D2O/H2O,18O2/16O2),评估了Mn/Na2WO4/SiO2的动力学同位素效应,发现C—H键的激活是动力学不可逆的,他们还表明O2的解离是平衡的,但随H2O/O2的质量比的增加,转化率和停留时间增加,O2的这种平衡就会被打破,这也在一方面对O2的解离吸附提供了强有力的支持[9]。许多研究者根据不同的催化剂研究了甲烷氧化偶联的反应机理[9-11]。Golpasha等[12]根据 Rideal-Redox 机理研究了 Na/Mg2O3的动力学,Iwamatsu等[13]研究了Rideal-Redox、Langmuir-Hinshelwood及Multiple-Redox机理,Miro等[14]分别根据 Rideal-Redox机理和Eley-Rideal机理研究了Li/NiTiO3和Na/NiTiO3的动力学模型。以下为几个比较典型的反应机理模型
1.1 Mars-Van Krevelen 机理模型
Sohrabi等[15]用 CaTiO3催化剂,分别在 760,770,780 ℃温度下进行实验,结果发现当进料O2分压较低时,实验结果符合Mars-Van Krevelen机理。Mars-Van Krevelen机理认为O2首先在催化剂表面发生解离吸附,然后甲烷分子与催化剂表面的吸附氧结合。O2的吸附速率和甲烷的反应速率分别见式(1)和(2):

稳定状态时,rO2= rCH4,则可得式(3):

1.2 Langmuir-Hinshelwood机理模型
Sohrabi等[15]在较高的 O2分压下以 CaTiO3为催化剂进行实验,发现实验结果符合Langmuir-Hinshelwood机理。该机理认为催化剂表面的O2和甲烷分子的吸附是双活性位点吸附,其中,O2属于非解离吸附,在催化剂表面吸附O2分子和甲烷分子发生反应。稳定的条件下,O2的吸附和甲烷的吸附分别达到平衡。即有式(4):

进一步可得式(5):
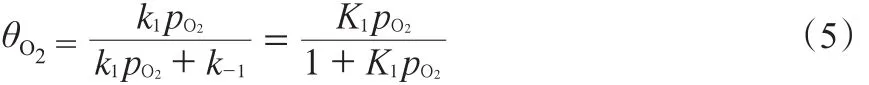
同理可求出被甲烷吸附的活性位点,见式(6):

甲烷的消耗速率见式(7):

由式(4)~(7)得式(8):
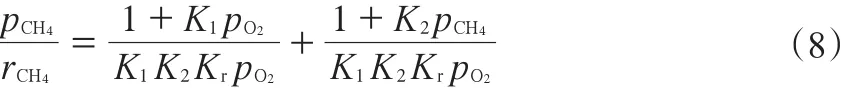
1.3 Eley-Rideal机理模型
Miro等[14]在一定条件下对加入1.6%(w)Na的钛酸镍催化剂进行研究,研究表明实验结果与Eley-Rideal机理较符合。该机理认为O2首先在催化剂表面发生非解离吸附,然后吸附的O2与甲烷分子发生反应。稳定状态下,O2的吸附和脱附达到平衡,甲烷的消耗速率见式(9):

根据式(5)进一步可得式(10):

1.4 Rideal-Redox机理模型
Seyed等[16]在不同的反应条件下,以Na/BaTiO3/MgO为催化剂进行实验,实验结果调查对比了Rideal-Redox的4个机理模型。
第一种模型是O2分子在催化剂表面进行可逆吸附,然后CH4气体分子与吸附的O2进行反应生成CH3·,CH3·与O2分子反应生成CH3O2·,然后由CH3O2·转化成COx,2个CH3·合成C2。在稳定的条件下,O2的吸附和脱附达到平衡,其中,O2脱附一部分参与甲烷的反应中。即有式(11):

进一步可得式(12):

甲烷的反应速率见式(13):

Seyed 等[16]还计算得出了 rC2H6,见式(14):

稳定条件下见式(15)和(16):
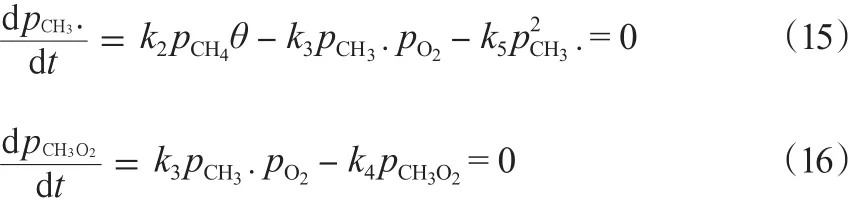
由见式(15)和(16)进一步可得rC2H6,见式(17):
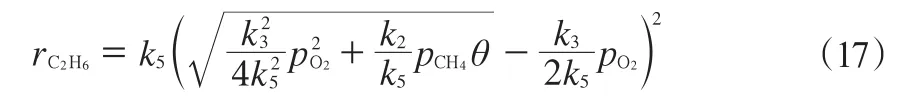
该机理的第二种模型的第三步基元反应是可逆反应,第一步基元反应属于非可逆反应。同第一种模型的计算方法,稳定条件下,O2的吸附与脱附达到平衡,O2的脱附全部参与甲烷的反应当中。可有式(18):

所以有式(19):

然后根据式(20)~(21)及式(14)可得到rC2H6。
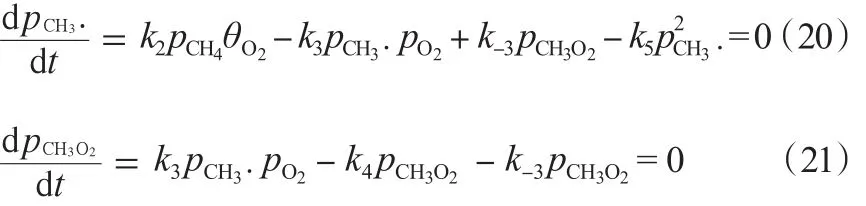
该机理的第三种模型主要考虑了O2的解离吸附。其中,,稳定条件下,O2的吸附与脱附达到平衡,O2的脱附全部参与甲烷的反应当中。由式(14)及式(22)~(25)可得rC2H6。
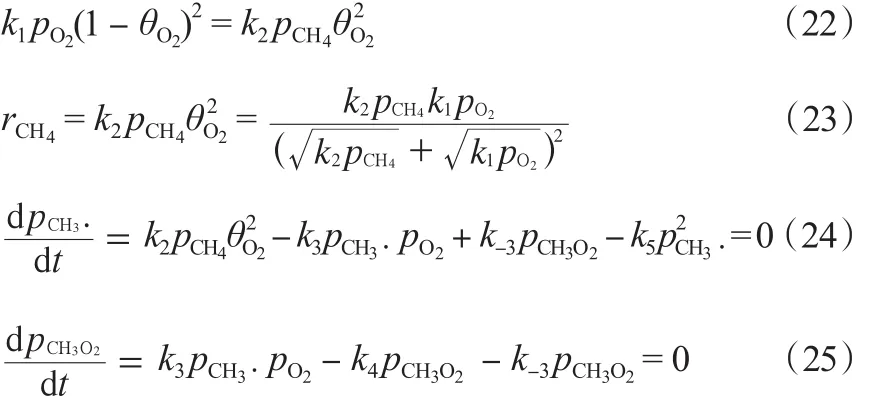
该机理的第四种模型指的是O2的解离吸附是一个可逆反应。稳定条件下,O2的吸附与脱附达到平衡,O2的脱附全部参与甲烷的反应当中。由式(14)及式(24)~(25)和式(26)~(27)可得 rC2H6:

2 甲烷氧化偶联反应动力学模型
研究反应动力学可以帮助人们了解催化剂的反应速率方程以及催化剂的详细反应机理,对观测到的反应数据进行解释和优化,预测不同操作变量的影响,进而减少所需的实验工作量,为催化反应器的设计提供依据和基础。
对于甲烷氧化偶联反应的动力学模型,研究者进行了大量的实验研究[17-19]。Stansch 等[20]以反应机理和经验相结合的方式总结了La2O3/CaO催化剂上的甲烷氧化偶联的反应网络和动力学模型,动力学方程中包括9个多相催化反应和1个均相催化反应;Vatania等[17]使用遗传算法模拟了Li/MgO催化剂的动力学,提出了一个包含16个反应步骤的反应动力学模型,其中,包含3个主反应步骤和13个二级反应步骤;Sun等[21]提出Li/MgO催化剂和Sn/Li/MgO催化剂的一个动力学模型,其中,包括39个气相基元步骤反应及14个催化反应,并比较了两种催化剂的选择性;Miro等[14]通过Na/NiTiO3催化剂和Li/NiTO3催化剂研究了甲烷氧化偶联反应动力学,分别通过Rideal-Redox机理和Ely-Rideal机理得到了动力学研究结果;Wolf等[22]研究了CaO/CeO2催化剂的甲烷氧化偶联反应动力学,通过动力学分析了催化剂和甲烷氧化偶联反应的固相特性之间的关系;Robert等[23]研究了 La0.9Ce0.1CoO3催化剂的甲烷氧化偶联动力学反应,其中,考虑了水和CO2对甲烷转化率的作用,实验结果表明,水对甲烷转化率的影响更大。另外不同的学者使用不同的催化剂进行了甲烷氧化偶联反应的反应器模拟。2001年,Tye等[24]为优化甲烷氧化偶联制乙烯动力学模型,在不同的条件下使用Math CAD8.0软件进行了反应器的一维模拟。2008年,Yaghobi等[25]使用代码编写了一个二维稳态反应器模型,通过三维数值模拟传热和非均匀动力学模型的流场耦合,研究了Sn/BaTiO3催化剂的甲烷氧化偶联动力学。
由于不同的机理对应不同的模型,且甲烷氧化偶联反应步骤较多,不同的学者针对不同的反应步骤也有不同的反应模型,研究学者根据不同的反应机理研究了甲烷氧化偶联反应的动力学模型,主要的动力学模型为以下5种。
2.1 Nastaran Razmi Farooji模型
Farooji等[26]以 SnBaTiO3为催化剂,分别在725,750,775 ℃、烷氧摩尔比2.0~4.5、重时空速100 min-1的条件下研究了Mars-Van Krevelen 机理、Eley-Rideal机理、4种Rideal-Redox机理以及Langmuir-Hinshelwood机理,研究发现实验结果和Langmuir-Hinshelwood机理比较符合,得出Nastaran Razmi Farooji动力学模型(见表1)。

表 1 Nastaran Razmi Farooji模型[26]Table 1 Nastaran Razmi Farooji model
2.2 Sylvie Lacombe模型
Lacombe等[27]以 La2O3为催化剂,在 750 ℃下,控制甲烷的进料分压为4.5~32 kPa、O2分压为0.12~3.5 kPa、气体进料的流动速率为0.33 cm3/s,测得出口各组分的分压,得到的实验数据与不同的动力学方程进行优化,实验数据与Sylvie Lacombe模型较符合(表2)。
2.3 Stansch模型
Stansch等[20]以La2O3/CaO 为催化剂,在 O2分压1~20 kPa,甲烷进料分压10~95 kPa,温度700~955 ℃的条件下进行实验,实验数据代入到Stansch模型的动力学方程中,实验误差均在20%以内。Stansch模型几乎包括了其他文献中用其他催化剂得出的所有反应步骤(表3),该模型也已经被不同的研究者使用[28-29]。Farsi等[30]对不同的动力学模型做了总结对比,指出Stansch机理模型相对其他模型,所得模拟结果与实验结果更接近。Ghiasi等[31]也成功地将该模型应用于Na/W/Mn/SiO2催化剂上。
2.4 Kamali Shahri模型
以浸渍法制备的2%Mn/5%Na2WO4/SiO2为催化剂,在O2分压4~20 kPa、甲烷进料分压20~80 kPa、温度800~900 ℃、O2没有完全转化的条件下进行实验。Kamali Shahri反应动力学模型包含3个初级反应步骤和4个连续次级反应步骤(见表4),动力学模型符合Langmuir-Hinshelwood机理,实验数据结果与动力学模型的模拟结果的误差在 20% 以内[32]。

表 2 Sylvie Lacombe模型[27]Table 2 Sylvie Lacombe model[27]

表 3 Stansch模型[20]Table 3 Stansch model[20]

表 4 Kamali Shahri模型[32]Table 4 Kamali Shahri model[32]
2.5 Power-law模型
Tiemersma 等[18]以 Mn/Na2WO4/SiO2为催化剂,在O2分压为0.7~28.2 kPa、甲烷进料分压为 9.7~89.6 kPa、温度800~900 ℃、进料流动速率在250 mL/min的条件下进行实验,Power-law速率模型很好地描述了各反应步骤的速率方程(见表5),并将实验结果与模拟结果进行对比。其他研究者也用Power-low速率模型很好地表示了各反应步骤,并对各步骤的参数进行了模拟[33]。
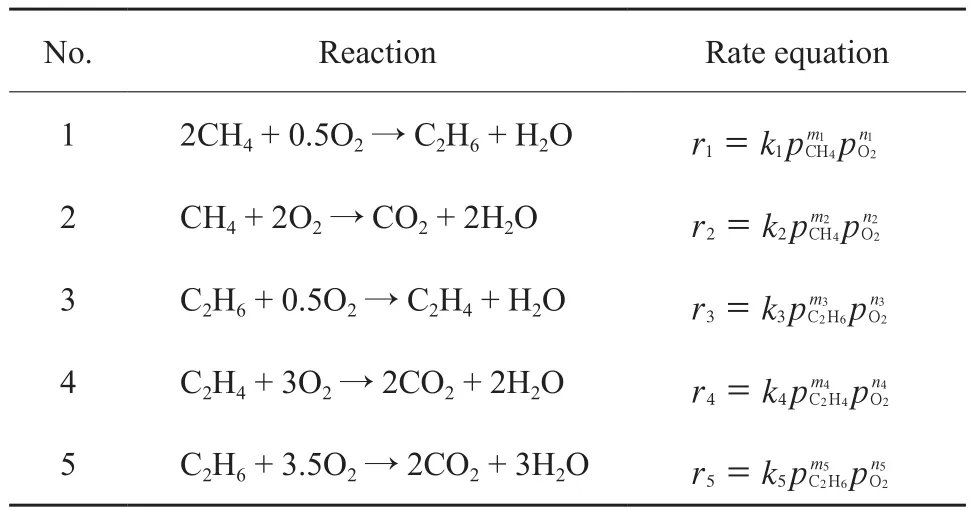
表 5 Power-law 模型[18]Table 5 Power-law model[18]
3 结语
甲烷氧化偶联反应的反应机理较为复杂,文中介绍的4种机理模型均得到广泛的应用,其中,Langmuir-Hinshelwood机理模型应用最为广泛,但由于甲烷氧化偶联反应的催化剂种类繁多,不同的催化剂在甲烷氧化偶联反应中有不同的机理,需要研究者根据具体的催化剂具体分析。Stansch模型的反应动力学方程包含9个多相催化反应步骤和1个均相催化反应步骤,包含了甲烷氧化偶联反应的大多数反应步骤,适用范围广。甲烷氧化偶联制乙烯在科学研究中具有一定的科学意义和学术价值,是一门重要的研究课题。在催化剂反应研究中,催化剂动力学的研究一方面可以帮助了解催化剂的反应机理;另一方面也可为催化剂反应器的设计提供依据。鉴于目前许多催化剂的催化效果仍未达到工业生产的要求,研究者将催化剂的研究与催化剂动力学和反应机理的研究相结合,可进一步指导催化剂的研究。
符 号 说 明
Eaj活化能,kJ/mol
ΔHj吸附热,kJ/mol
j -4,-3,-2,-1,0,1,2,3,4,5
K 吸附平衡常数,Pa-1
kj化学反应速率常数,mol/(g·s)
k0j指数前因子
mj反应级数
nj反应级数
p 压力,Pa
R 气体常数,J/(mol·K)
r 总包反应速率,mol/(g·s)
T 温度,K
t 时间,s
θ 被吸附的活性位点

