miR-598靶向MSI2对非小细胞肺癌细胞迁移及侵袭的抑制作用
赵静安,解立新
肺癌是一种常见的呼吸系统恶性肿瘤,在我国其发病率和病死率均居恶性肿瘤的第一位[1-2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是最常见的肺癌类型,占全部肺癌的80%~85%,患者5年生存率低于15%,早期侵袭和转移是导致NSCLC患者死亡的最主要原因[3]。miRNA是长度为18~22个核苷酸的内源性非编码小分子RNA,通过与靶基因mRNA分子3'-UTR端特异性结合,调控靶基因的表达,进而参与调控包括NSCLC在内的多种肿瘤细胞的增殖、迁移、侵袭、凋亡以及上皮间质转化,深入研究其相关分子机制对NSCLC的诊断和治疗有重要意义[4-5]。miR-598作为一个重要的抑癌miRNA分子,可通过调控JAG1、IGF-1R、DERL1等基因表达,参与肿瘤细胞的周期调控、迁移,侵袭及上皮间质转化等过程[6-9]。不仅如此,miR-598的低表达还与多种肿瘤的不良预后密切相关,因此miR-598可作为预测肿瘤进展和预后的标志物[10]。RNA结合蛋白Musashi2(MSI2)是NSCLC发生和转移的一个重要调控因子,这可能与MSI2激活TGF-β信号通路有着密切关系。本研究探讨了miR-598在非小细胞肺癌组织中的表达,以及miRNA-598靶定MSI2 NSCLC细胞迁移和侵袭的影响,以期为NSCLC的诊断及治疗提供新的理论依据。
1 材料与方法
1.1 材料获取 收集2015年8月-2017年3月在解放军总医院胸外科行原发性NSCLC切除术的患者37例,入组患者术前均未接受放疗或者化疗。其中男18例,女19例,年龄(56.7±8.9)岁;鳞癌23例,腺癌14例。组织标本包括患者原发性NSCLC组织和癌旁组织(距离病灶>5cm,并有病理证实无肿瘤细胞浸润),切取后迅速冻于液氮中,随后转移至-80℃冰箱保存。本研究经医院医学伦理委员会批准,所有患者均签署知情同意书。
1.2 实验方法
1.2.1 细胞培养 人肺癌细胞株A549、H1650、H1299及人正常肺上皮细胞BEAS-2B均购自中国科学院上海生命科学研究院细胞资源中心。所有细胞常规培养于含10%胎牛血清、100U/ml青霉素、100μg/ml链霉素的RPMI 1640培养基(Invitrogen公司,美国),置于37℃、5%CO2饱和湿度培养箱中,取对数生长期的细胞进行实验。
1.2.2 qRT-PCR实验 应用Trizol法提取组织和细胞的总RNA。采用TapMan MicroRNA Reverse Transcription kit(Applied Biosystems公司,美国)进行反转录,反应条件为:16℃ 30min;42℃ 30min;85℃ 5min。采用TapMan MicroRNA Assays Real-time PCR kit(Applied Biosystems公司,美国)进行定量扩增,反应条件为:95℃ 5min,95℃ 15s、62℃30s,共40个循环。以U6为内参照。miR-598引物序列:正向5'-AGCTACGTCATCGTTGTCATC-3',反向5'-GTGTCGTCGAGTCGGCAATTC-3';MSI2引物序列:正向5'-TTCGCAGACCCAGCAAGTG-3',反向5'-TCGCAGATAACCCGCCTAC-3';U6引物序列:正向5'-CTCGCTTCGGCAGCACA-3',反向5'-AACGCTTCACGAATTTGCGT-3'(华大基因公司,中国)。每个检验指标设3个复孔,用2-ΔΔCt法定量miR-598的相对表达水平。
1.2.3 细胞转染实验 待A549细胞生长到80%左右时,采用LipofectamineTM2000(Invitrogen公司,美国)转染试剂将miRNA对照(miR-NC)、miR-598mimics及miR-598 inhibitors转染至A549细胞,8h后更换新鲜培养基,48h后收集细胞用于后续实验。
1.2.4 划痕愈合实验 将转染miR-NC、miR-598 mimics以及miR-598 inhibitors的A549细胞接种至6孔板,待细胞铺满孔底,用10μl无菌移液器枪头在培养板底部进行“一”字形划痕,PBS洗3次后加入低血清新鲜培养基,在倒置显微镜下观察0、12、24、36h后划痕中细胞的迁移情况并拍照。沿划痕边缘等间距取3处测量划痕宽度,取平均值。划痕愈合率(%)=(0h划痕宽度-观察时间划痕宽度)/0h划痕宽度×100%。
1.2.5 Transwell侵袭实验 采用预铺Matrigel基质胶的8μm规格的聚碳酸酯滤膜培养小室(Corning公司,美国)进行Transwell实验。将转染miR-598 mimics、miR-598 inhibitors以及miR-NC的A549细胞制成1×105/ml密度的细胞悬液,并接种200μl细胞悬液到Transwell小室的上室,下室加入500μl含10%胎牛血清的RPMI 1640培养液,每组设3个复孔。在37℃、5%CO2条件下培养36h后,用棉签轻轻擦掉基质胶和上层未穿膜的细胞,4%多聚甲醛固定细胞10min,0.1%结晶紫染色10min,100倍显微镜下随机计数5个视野的细胞数,取平均数为每组穿过小室的细胞数。
1.2.6 靶基因预测 通过miRWalk(http://zmf.umm.uni-heidelberg.de/apps/zmf/mirwalk2/)、TargetScan(http://www.targetscan.org/)、miRBase(http://www.mirbase.org/)3种在线软件进行靶基因预测,选择至少在2个软件中出现并且与肿瘤迁移、侵袭功能密切相关的基因进一步分析。
1.2.7 MSI2基因3'-UTR及突变载体构建 根据生物信息学预测的miR-598与MSI2 3'-UTR区靶位点结合情况合成MSI2目的基因序列和突变序列,以pGL3为载体,XhoⅠ和KpnⅠ为插入位点,采用XhoⅠ/KpnⅠ双酶切系统(20μl体系)(TaKaRa公司,日本)于37℃下酶切1h,对载体酶切产物进行琼脂糖凝胶电泳,回收目的基因和载体片段。连接目的基因与载体,并将连接产物转入感受态细胞验证后完成质粒抽提。最终获得MSI2基因野生型质粒miR-NC+pGL3-MSI2-wt和miR-598mimics+pGL3-MSI2-wt,MSI2基因突变型质粒miR-NC+pGL3-MSI2-mut和miR-598mimics+pGL3-MSI2-mut。
1.2.8 双荧光素酶报告基因检测 293FT细胞接种24孔板(1.5×105/孔),待细胞生长至80%左右,按照脂质体LipofectamineTM2000试剂盒(Invitrogen公司,中国)说明书将质粒miR-NC+pGL3-MSI2-wt、miR-598mimics+pGL3-MSI2-wt、miR-NC+pGL3-MSI2-mut、miR-598mimics+pGL3-MSI2-mut分别共转染293FT细胞,6h后更换新鲜的DMEM培养基。转染48h后,裂解各组细胞,按Dual-Luciferase Reporter Assay System(Promega公司,美国)说明书操作,以萤火虫荧光素酶活性与海肾荧光素酶活性比值表示各组细胞荧光强度。
1.2.9 Western blotting检测蛋白表达水平 将转染miR-NC+pcDNA、miR-NC+MSI2、miR-598 mimics+MSI2后的A549细胞采用RIPA于冰上裂解30min,采用BCA蛋白定量试剂盒(上海碧云天生物技术公司,中国)定量。采用12%SDS-PAGE胶进行凝胶电泳分离,每个泳道蛋白上样量为20μg。浓缩胶60V电泳1h,分离胶100V电泳2h,常规湿转法转膜90min,用含5%牛血清白蛋白的TBST缓冲液封闭1h,分别加入对应一抗4℃孵育过夜,TBST缓冲液洗膜3次后,加入对应二抗室温摇床孵育2h,TBST缓冲液洗膜3次,ECL发光试剂盒(Thermo公司,美国)发光显影,定影后进行分析。
2 结 果
2.1 miR-598在NSCLC组织及细胞系中的表达 通过qRT-PCR检测37例NSCLC组织及癌旁组织中miR-598的表达水平,结果显示,与癌旁组织相比,NSCLC组织中miR-598的表达明显下调(P<0.001,图1A)。与人正常肺上皮细胞BEAS-2B相比,肺癌细胞系A549、H1650及H1299中miR-598的表达也明显下调(P<0.001,图1B)。
2.2 miR-598对NSCLC细胞迁移能力的影响 划痕实验结果显示,与阴性对照组(转染miR-NC)相比,转染miR-598 mimics的A549细胞迁移能力受到明显抑制(P<0.01),而转染miR-598 inhibitors的细胞迁移能力明显增强(P<0.01,图2A、B)。
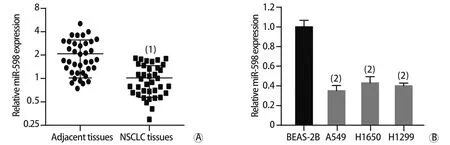
图1 miR-598在NSCLC组织及细胞系中的相对表达水平Fig.1 Relative expressions of miR-598 in NSCLC tissues and cell lines

图2 miR-598对A549细胞迁移能力的影响Fig.2 Inhibition effect of miR-598 on migration of A549 cells
2.3 miR-598对肺癌细胞侵袭能力的影响Transwell侵袭实验结果显示,与转染miR-NC的阴性对照组比较,转染miR-598 mimics的A549细胞侵袭能力明显减弱(P<0.01),而转染miR-598 inhibitors的A549细胞侵袭能力明显增强(P<0.05,图3A、B)。
2.4 miR-598与MSI2的相互作用 生物信息学软件分析显示,miR-598与致癌基因MSI2的3'-UTR存在多个碱基结合位点,MSI2可能是miR-598的靶基因(图4A)。随后采用双荧光素酶报告基因体系分别构建了MSI2野生型(MSI2-wt)及MSI2突变型(MSI2-mut)荧光素酶报告载体质粒,并通过与miR-598 mimics共同转染293FT细胞来检测荧光素酶活性,结果显示,miR-598 mimics可显著抑制MSI2野生型荧光素酶活性(P<0.01),而不影响MSI2突变型荧光素酶活性(图4B)。随后检测过表达miR-598 mimics的A549细胞中MSI2 mRNA的表达水平,结果显示其表达水平明显降低(P<0.01,图4C)。
2.5 miR-598调控MSI2对NSCLC细胞迁移和侵袭的影响 通过在A549细胞中单独或与miR-598 mimics共转染MSI2基因,发现单独转染后MSI2蛋白表达水平升高,而与miR-598 mimics共转染后MSI2蛋白表达水平恢复正常,表明miR-598抑制NSCLC细胞的迁移和侵袭是通过调控MSI2实现的(图5A)。划痕实验显示,MSI2可明显增强A549细胞的迁移能力,但当引入miR-598 mimics后A549细胞的迁移能力明显被逆转(图5B)。Transwell侵袭实验结果显示,MSI2可以明显强A549细胞的侵袭能力,但引入miR-598后,A549细胞的侵袭能力明显被逆转(图5C)。检测NSCLC组织中miR-598和MSI2 mRNA的表达,发现二者呈明显负相关(图5D)。

图3 miR-598对A549细胞侵袭能力的影响Fig.3 Inhibition effect of miR-598 on invasion of A549 cells

图4 miR-598与MSI2基因3'-UTR区的相互作用(双荧光素酶报告基因实验)Fig.4 Interaction between miR-598 and MSI2 detected by dual-luciferase test

图5 miR-598通过调控MSI2抑制肺癌细胞的迁移和侵袭Fig.5 Inhibition effect of miR-598 on migration and invasion of NSCLC by regulating MSI2
3 讨 论
目前研究认为,miRNA与肺癌细胞的分化、增殖、侵袭、凋亡等密切相关[11]。miRNA既可以下调癌基因活性,抑制肿瘤的发生发展,也可以下调抑癌基因活性,促进肿瘤的发生发展[12]。因此,寻找和研究与肺癌发生发展密切相关的miRNA分子,对于探讨肺癌的启动机制、预防肺癌的转移以及选择合适的靶点进行干预均具有重要意义。
miR-598作为一个与肿瘤发展密切相关的miRNA分子,在结肠癌、文氏肉瘤、前列腺癌、食管癌等多种类型的肿瘤中呈低表达[6,8],且其表达水平的高低与患者的预后呈正相关。不仅如此,miR-598还可以通过靶向调控JAG1基因抑制结肠癌的上皮-间质转化,从而抑制结肠癌细胞的迁移和侵袭[6]。虽然miR-598在多种肿瘤中的抑癌功能已有阐述,但其介导肺癌细胞迁移侵袭的机制尚不明确。
本研究对37例NSCLC标本的miR-598表达情况进行分析,发现其在NSCLC组织中表达明显降低,推测miR-598在NSCLC中可能发挥抑癌基因的作用。为验证此推断,本研究通过miR-598 mimics及miR-598 inhibitors上调或抑制A549细胞中miR-598的表达,并通过划痕实验和Transwell实验初步验证了miR-598在NSCLC细胞中发挥着抑制肿瘤细胞迁移和侵袭的作用,同时运用生物信息学技术和双荧光素酶实验验证了MSI2是其下游靶基因,进一步阐明了miR-598抑制NSCLC细胞迁移转移是通过下调MSI2实现的。
MSI2蛋白属于Musashi蛋白家族成员,不仅是干细胞和早期祖细胞的重要分子标志物,且与多种肿瘤的预后和转移密切相关[13-14]。在胰腺癌、肝癌、胶质瘤组织中MSI2高表达,并且其表达水平与肿瘤细胞的浸润转移关系密切[15-17]。在急性淋巴细胞性白血病中,MSI2表达水平与患者总体生存率呈负相关[18]。此外,MSI2是NSCLC发生和转移的一个重要调控因子,这可能与MSI2激活TGF-β信号通路、调控ERBB1/CLDN7/SMAD3等癌基因密切相关[19-20]。本研究中,上调MSI2表达水平后,NSCLC细胞迁移和侵袭能力显著增强。
综上所述,本研究从一个全新的方向阐述了NSCLC迁移和侵袭的机制,并为NSCLC的治疗提供一个新的靶点。但MSI2调控NSCLC细胞迁移和侵袭是否与上述信号通路相关尚无法证实,需进一步研究验证。

