转化生长因子-β1 siRNA神经干细胞后期移植对大鼠脊髓损伤修复的影响
杨利丽,李秋菊,徐长妍,王春玲,张 妍
脊髓受到直接或间接暴力伤害后,内部出现出血及水肿现象,部分神经元发生凋亡,进而导致神经传导中断,急性脊髓损造模后早期微循环障碍导致局部缺血缺氧并发生免疫炎症反应,小胶质细胞及星形胶质细胞的活化、增殖、迁徙,造成了继发细胞毒性并导致瘢痕形成,持续的脊髓缺血缺氧及代谢紊乱,不利于神经元及轴突的再生,最终导致继发性脊髓损伤[1-2]。故脊髓损伤后, 提高神经元的存活质量、促进神经元轴突的生长及定向分化是恢复脊髓功能的关键, 而受损神经元的存活及轴突的再生受内、外环境多种因素的影响。尽量减少神经元凋亡的数量,无疑可保留脊髓损伤后的神经功能[3-4]。研究发现,在脊髓损伤区植入的神经干细胞(neural stem cells,NSCs)能够诱导损伤区的微血管再生,使细胞定向分化为神经前体细胞,释放生长因子,促进轴突的再形成,使神经细胞得到再生和重建,从而使脊髓损伤得到修复[5]。故有学者提议一致的理想供体可由NSCs来充当[6]。
转化生长因子-β(transforming growth factorβ,TGF-β)是集多种生物功能于一体的蛋白多肽,能够诱导细胞表型发生改变,亦可影响正常以及瘤细胞的分化。NSCs是指具有分化为神经元、少突胶质细胞和星型胶质细胞能力,且能够自我更新并形成神经组织的细胞[7]。NSCs的定向迁移能力对于脊髓损伤这种存在着广泛病变而没有明确定位的疾病,具有重大意义[8]。NSCs具有的定向迁移、组织融合及免疫豁免性,使其在损伤移植后可以很好的存活[9]。且研究已证实NSCs移植安全有效,对大鼠的正常生长发育无明显影响[10]。因此,本实验拟探讨TGF-β基因沉默NSCs后期移植对大鼠脊髓损伤修复的影响。
1 材料与方法
1.1 动物 SD大鼠78只,体质量为(250±20)g(动物质量合格证号:SCXK(津)20050001),购自中国医学科学院动物实验室。
1.2 试剂与仪器 胰蛋白酶(美国Santa Cruz 公司);CM-Dil(美国 Invitrogen公司);慢病毒包装试剂盒(美国GeneCopoeia);嘌呤霉素(上海宇玫博生物科技有限公司);兔抗鼠T GF - β1多克隆抗体、兔抗鼠Syn多克隆抗体(美国sigma);Western blot蛋白检测试剂盒(美国 Santa Cruz 公司);BCA 蛋白浓度测定试剂盒 (Beyotime 公司);化学发光检测试剂盒(美国Pierce);Trizol试剂(美国Invitrogen公司);QuantiTect逆转录试剂盒(德国QIAGEN公司);扫描分析软件系统(Labworks Analysis Software, 美 国 );JEM-1200EX 系 统(JOEL,日本东京)。
1.3 培养和标记NSCs 将SD大鼠中乳鼠消毒30 s,打开大脑皮层,暴露两侧的海马组织,将其取出并放在已准备好的冷的培养基中,将组织剪碎,并用吹打法对其进行吹打,直到无明显的块状组织。用滤网进行过滤。 设 置 离 心 机 参 数 为1000 r/min、5 min,随后将滤液移至离心管中,并放入4 ℃预冷的离心机中进行离心,毕后再次对其进行重悬。将重悬液移至25 cm2的培养瓶中,并调整细胞密度为1×105~5×105个/mL,于培养箱中进行培养,每2~3 d将原有培养基丢弃,并添加新培养基,5 d后进行传代。对收集的细胞进行消化、离心,弃去上清液,向其中添加200 μL新培养液,用枪头对其进行吹打至单细胞悬液,计数,随后将其接种到培养瓶,再次进行上述密度调整。每2~3 d更换1次培养液, 5 d进行1次传代。自第2代NSCs开始对其实施干预处理。 将1 mL完全培养基和5μL的CM-Dil添加到1.5 mL的EP管中,反复进行吹打直至混匀,得到CM-Dil标记液。对细胞进行观察,当贴壁数达90%时,将其中的培养液丢弃,用PBS反复进行冲洗3次,将表面液体去除,向其中添加上述已配置液体,继续培养20 min,毕后将其中的液体丢弃,并添加5 mL的完全培养基,并进行温育,10 min后将其丢弃,再次向其中添加培养基,反复冲洗2次。连续进行培养,用于后续实验。
1.4 基因转染与实验分组 取生长状态良好的P3代NSCs,更换新的培养基。TGF-β1小干扰RNA(siRNA)最佳序列见参考文献[11],将含有TGF-β1基因的慢病毒添加到培养基中。将其放在恒温培养箱中,8 h后将含有病毒的培养基弃去,并用PBS液洗涤2次。毕后添加完全培养基,培养72 h。随后将其替换成含1 μg/mL嘌呤霉素的完全培养基。每天于固定时间观察细胞,将未转染成功的细胞去除,更换培养基,在显微镜下观察直至死亡细胞不再增加。向其中添加完全培养基继续培养,直至实验所需时间为止,并进行后续相关指标的测定。
依据干预方式的不同分为3组:对照组——NSCs未经任何特殊处理,单转染慢病毒组——NSCs转染对照慢病毒,TGF-β1-siRNA组——NSCs转染TGF-β1-siRNA慢病毒。
1.5 测定指标及方法
1.5.1 Western blot检测转染后第3 d和第14 d的TGF-β1蛋白的表达 分别于转染后的第3 d和14 d,对细胞浓度进行调整,使其满足5×105/mL,随后进行接种, 1 mL/孔,培养24 h,随后饥饿12 h。参照说明书收集蛋白。对蛋白样品依据BCA 蛋白浓度检测试剂盒进行定量。TGF-β1蛋白表达采用Western blot蛋白检测试剂盒测定,简述之,取收集的蛋白50μg,经10% 聚丙烯酰胺凝胶电泳跑分离。取纤维膜用半干式电印迹将蛋白进行转膜,室温封闭1 h,向其中添加TGF-β1、GAPDH一抗4 ℃过夜,次日洗膜,后添加二抗,1h后再次进行上述温育及洗膜处理。ECL化学发光法暗室曝光。重复以上操作步骤3次。用Quantity one处理系统进行结果的处理。
1.5.2 模型建立及实验分组 对大鼠进行适应性喂养3 d后进行实验,麻醉、固定、剃毛,背部正中区域皮肤消毒并切口,暴露棘突和椎板,切除T8-T9棘突及部分椎板,并切除黄韧带,显露出硬脑膜。按照改良Allen法设计打击锤重量为10 g、打击高度为2.5 cm进行脊髓打击,当观察到鼠尾及双后肢可见痉挛性伸直片刻后又松弛则表示造模成功。随后注射青霉素20万U/d,接连3 d,以防发生感染。于脊髓损伤模型建立后至排尿反射恢复前,人工挤尿3次/ d。
成年雌性SD大鼠78只,体质量(250±20)g,造模成功72只,随机分为3组,每组24只,单独放于3个笼子里。进一步将各组随机分为脊髓损伤后1 d、3 d、7 d、14 d、21 d、28 d共6个时间点,各时间点4只。保持动物良好的卫生条件,允许其自由进食水。脊髓损伤6h后,对照组0.9%氯化钠注射液20 μL注入;NSCs移植组予以等量CM-Dil标记的NSC悬液(3×106/L)注入;TGF-β1-siRNA组予以等量CM-Dil标记的TGF-β1-siRNANSC悬液(3×106/L)注入。
1.5.3 检测各组大鼠脊髓损伤后运动功能的恢复情况 3组大鼠均于脊髓损伤前及后不同时期应用BBB评分、斜板试验、改良Tarlov评分对后肢运动功能做出评判。
BBB评分方法:将待检大鼠置于室温、光线适宜、安静环境中,于上午9点前将其膀胱尿量排空,随后对其进行观察,共持续5 min。由两人独立对其表现进行评分,将两人所得分数的均值作为终值来评定损伤后运动功能的恢复情况。评分细则[11]:共22级,0级:后肢完全瘫痪,21级:功能正常。观察关节活动次数,运动负荷、范围,前肢、后肢及前爪、后爪、尾巴的协调程度。
斜板试验:将大鼠置于光滑的木板上,头部面向木板的高侧端,体轴垂直于板的垂直轴,每个试验斜板的角度增加5°,当最大角度时大鼠可停留5 s,则认为有功能价值[12]。每个角度均进行3次测量,将得到的平均数作为最终结果。
改良Tarlov评分:0分:完全瘫痪,刺激下肢没有反应;1分:完全瘫痪,刺激有反应,但无法活动;2分:能够活动,但站立不稳或不能站立;3分:能站立,却不能走动;4分:能走动几步,但步态不稳;5分:能慢慢走动,但不灵活;6分:正常。
1.5.4 RT-PCR、Western blot检测突触素(Syn)及TGF-β1基因和蛋白的表达 脊髓损伤后1周将大鼠麻醉,迅速取出包含损伤区域在内的脊髓组织约10mm,按照Trizol试剂说明书中的具体步骤提取组织样品的总RNA,空白对照采用三蒸水。随后进行反转录及测定。引物设计及合成按照已报道的序列设计并合成Syn、TGF-β1及内参照GAPDH的特异性引物。各引物的序列为:Syn上游引物5’-CCAGAGACCTCTAA CCACCCGACAC-3’,下 游 引 物 5’-TAAACAACCTTGGGGAGGTG GGCG-3’, 扩 增 长 度 为 240bp;TGF-β1上 游引 物 5’-CTGTAATTCTGCTGTAATA-3’, 下游 引 物 5’-GGCT TAGT ATTCTGGGAAA-3’,扩 增 长 度296bp;GAPDH上 游 引 物5’-GTCAACGG ATTTGGTGGTATT-3’,下游引物 5’-AGTCTTCTGGGTGGCAGTCAT-3’,扩增长度为499bp。根据标准曲线将各样品测得的Ct值换算成拷贝数,分析各检测样本中目的基因拷贝数相对于阳性定量参考样品的基因拷贝数,分析方法采用2-△△Ct方法。对损伤区取得的脊髓组织的总蛋白进行提取,随后应用二辛可宁酸法定量试剂盒进行测定。Western blot具体操作方法如前所述,其中抗Syn 1按1000稀释,抗TGF-β1按1:50稀释,二抗按1:5000稀释,DAB显色15 min,用扫描分析软件系统测定各条带的积分灰度值。
1.5.5 HE染色及CM-Dil荧光显微镜 3组各随机选4只大鼠,在脊髓损伤后的第4周,行麻醉后迅速从病变部位取长约1 cm的完整脊髓,经分级系列酒精脱水,纵向切片,厚约20 μm。行HE染色,并观察。随机取10个视野,用高倍荧光显微镜(200×)观察,计数每个视野内CM-Dil的>阳性细胞数,并取其平均值作为CM-Dil的细胞数。以了解CM-Dil标记的NSCs的分布及存活情况。
1.5.6 辣根过氧化物酶(HRP)逆行示踪评估神经纤维再生情况 每组随机取4只大鼠,于造模成功后第4周用10%水合氯醛麻醉,在T12脊髓背侧正中神经两侧1 mm处进针1.5 mm,10 min内注射50% HRP 0. 1μL,留针15 min。饲养3 d后,腹腔注射10%水合氯醛麻醉,将脊髓T3~T11段浸泡在4 ℃、30%的蔗糖溶液中20 h。切片用DAB处理。取脊髓横断面,用光学显微镜观察并记录HRP阳性的纤维个数。
1.5.7 透射电镜观察各组脊髓损伤区超微结构以损伤区为中心截取长约1 cm的脊髓组织,将其放在2%的戊二醛中进行固定过夜,行超薄切片后透射电镜观察,采用JEM-1200EX系统进行拍照,观察脊髓的超微结构,并采用Image J软件进行分析。
2 结果
2.1 NSCs体外培养、鉴定及标记 培养1 d后NSCs增多、较小、形状不规则,小部分细胞团贴壁;培养5 d后NSCs增多,为较大、形状规则的球形,见图1A。免疫荧光染色显示,NSCs球呈Nestin强阳性表达,Nestin免疫荧光化学染色阳性,见图1B。CM-Dil标记的NSCs在荧光显微镜下呈红色荧光,见图1C。研究证实,CM-DiI标记荧光在胞内表达稳定,标记的阳性率达97%以上,标记细胞形态良好,能有效地观察细胞在体外的诱导分化情况。
2.2 TGF-β1蛋白的表达 于TGF-β沉默NSCs转染3 d后检测各组TGF-β1蛋白表达,发现TGF-β1 呈低表达,第14 d再次对各组TGF-β1表达量进行比较,蛋白仍呈现低表达水平(图2)。
2.3 检测各组大鼠脊髓损伤后运动功能的恢复情 况 对脊髓损伤前后运动功能进行评估。损伤前各组BBB、改良Tarlov评分及斜板试验结果近似。于脊髓损伤后的1d、3d、7d、14d、21d、28d再次进行判读,结果显示,与对照组相比,NSCs移植组以及TGF-β1-siRNA组均较高,且TGF-β1-siRNA组较NSCs移植组高,差异均有统计学意义(P<0.05)。表1、表2、表3。

图1 NSCs的培养、鉴定和标记
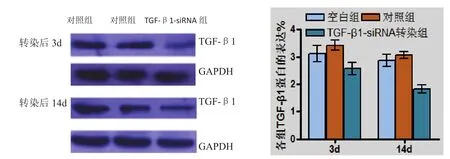
图2 转染后3 d、14 d各组TGF-β1蛋白的表达情况()
表1 三组大鼠各时相点BBB评分比较(± s,n=5)

表1 三组大鼠各时相点BBB评分比较(± s,n=5)
注:与对照组相比,aP<0.05;与NSCs移植组相比,bP<0.05
组别 脊髓损伤前脊髓损伤后1 d 3 d 7 d 14 d 21 d 28 d对照组 21.00±0.34 0.20±0.06 0.21±0.04 3.20±0.23 6.20±0.34 9.34±0.34 10.23±0.23 NSCs移植组 21.00±0.37 0.45±0.09a 0.60±0.13a 5.37±0.34a 8.95±0.34a 10.10±0.24a 15.30±0.31a TGF-β1-siRNA 组 21.00±0.42 0.62±0.13a、b 1.30±0.32a、b 1267±0.42a、b 17.52±0.36a、b 19.00±0.34a、b 20.00±0.45a、b
表2 三组大鼠各时相点改良Tarlov评分比较(± s,n=5)
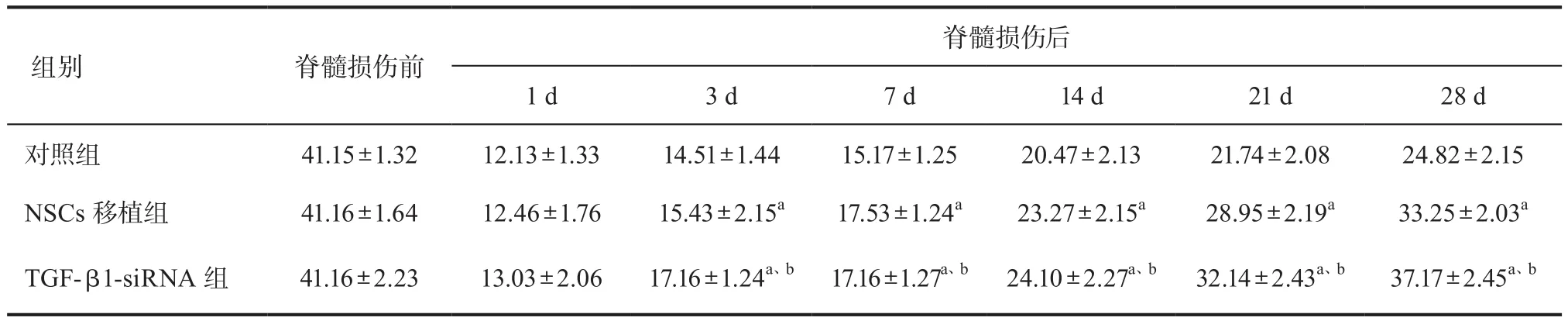
表2 三组大鼠各时相点改良Tarlov评分比较(± s,n=5)
注:与对照组相比,aP<0.05;与NSCs移植组相比,bP<0.05
脊髓损伤后1 d 3 d 7 d 14 d 21 d 28 d对照组 41.15±1.32 12.13±1.33 14.51±1.44 15.17±1.25 20.47±2.13 21.74±2.08 24.82±2.15 NSCs移植组 41.16±1.64 12.46±1.76 15.43±2.15a 17.53±1.24a 23.27±2.15a 28.95±2.19a 33.25±2.03a TGF-β1-siRNA 组 41.16±2.23 13.03±2.06 17.16±1.24a、b 17.16±1.27a、b 24.10±2.27a、b 32.14±2.43a、b 37.17±2.45a、b组别 脊髓损伤前
表3 三组大鼠各时相点斜板试验角度比较(± s,n=5)
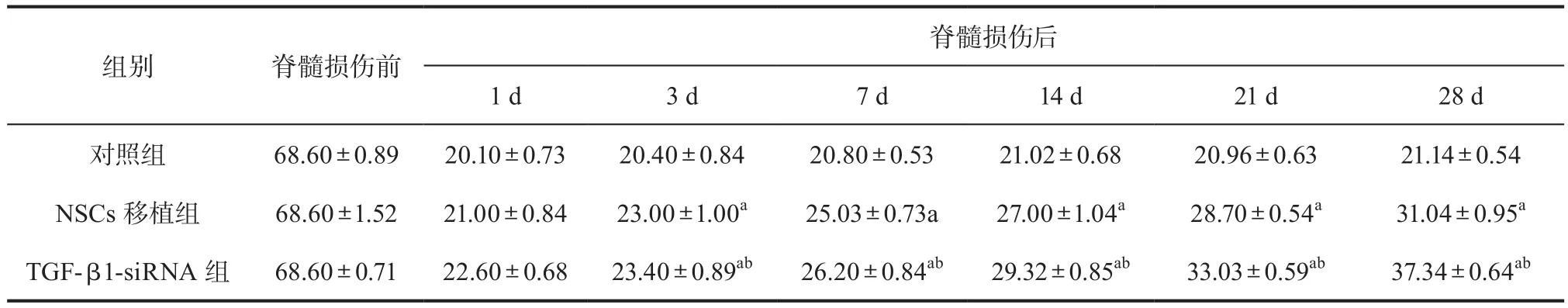
表3 三组大鼠各时相点斜板试验角度比较(± s,n=5)
注:与对照组相比,aP<0.05;与NSCs移植组相比,bP<0.05
脊髓损伤后1 d 3 d 7 d 14 d 21 d 28 d对照组 68.60±0.89 20.10±0.73 20.40±0.84 20.80±0.53 21.02±0.68 20.96±0.63 21.14±0.54 NSCs 移植组 68.60±1.52 21.00±0.84 23.00±1.00a 25.03±0.73a 27.00±1.04a 28.70±0.54a 31.04±0.95a TGF-β1-siRNA 组 68.60±0.71 22.60±0.68 23.40±0.89ab 26.20±0.84ab 29.32±0.85ab 33.03±0.59ab 37.34±0.64ab组别 脊髓损伤前
2.4 Syn及TGF-β1基因转录表达 如表4、图3所示,TGF-β1-siRNA组大鼠脊髓组织中Syn基因表达显著高于对照组、NSCs移植组(P<0.05);而与对照组相比,NSCs移植组大鼠脊髓组织中Syn mRNA相对表达水平亦显著提高(P<0.05)。在TGF-β1基因表达水平方面,TGF-β1-siRNA组显著低于其他各组(P<0.05)。
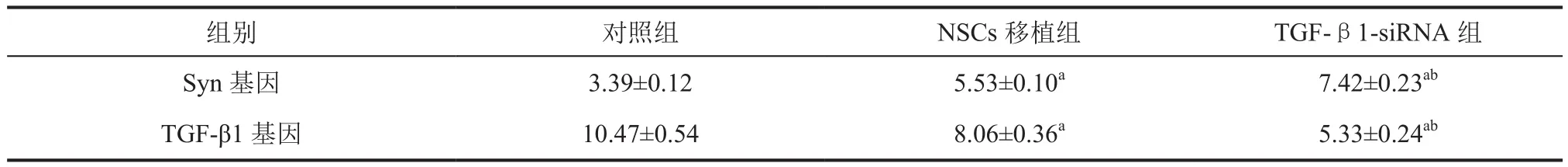
表4 大鼠脊髓组织Syn和TGF-β1mRNA表达()

图3 大鼠脊髓组织Syn和TGF-β1基因表达
2.5 Syn及 TGF-β1蛋白 表5、图 4所示为TGF-β1基因沉默神经干细胞移植对脊髓损伤模型大鼠脊髓组织中Syn和TGF-β1两个蛋白分子相对蛋白表达水平的影响。如表中所示在Syn蛋白表达方面,TGF-β1-siRNA组与其他二组相比显著较高(P<0.05);与脊髓损伤模型组相比,NSCs移植组显著提高了大鼠脊髓组织中Syn蛋白相对表达水平(P<0.05)。而TGF-β1蛋白表达在TGF-β1-siRNA组则显著低于对照组和NSCs移植组 (P<0.05)。

表5 大鼠脊髓组织Syn和TGF-β1蛋白表达()

图4 大鼠脊髓组织Syn和TGF-β1蛋白表达
2.6 HE染色观察 损伤后4周,取大鼠脊髓组织切片行HE染色观察,发现对照组可观察到脊髓组织的缺失以及脊髓空洞的形成,并且无神经轴索通过。而NSCs移植组能看到脊髓损伤区有少量的神经轴索样结构通过,并且脊髓空洞明显减小。TGF-β1-siRNA组神经轴索样结构明显增多,脊髓空洞几乎消失。见图5。

图5 各组脊髓组织HE染色结果(×40)
2.7 荧光显微镜观察CM-Dil标记的NSCs CMDil标记后在荧光显微镜观察可见NSCs呈现红色荧光。对照组看不到红色荧光,NSCs移植组脊髓损伤区可见CM-Dil阳性细胞,(22.38±3.45)个/高倍视野,TGF-β1-siRNA组可见较多CM-Dil阳性细胞,(38.68±4.89)个/高倍视野,差异有统计学意义。见图6。

图6 各组脊髓组织CM-Dil荧光显微镜观察结果(×200)
2.8 HRP逆行示踪评估神经纤维再生情况 移植后28d,TGF-β1-siRNA组阳性神经纤维数明显多于对照组和NSCs移植组(P<0.05)。见表6 、图7。

表6 各组HRP逆行示踪标记神经纤维数(个/高倍视野)

图7 各组HRP逆行示踪标记的神经纤维数(×200)
2.9 透射电镜观察各组脊髓损伤区超微结构 在透射电镜下对各组脊髓损伤处进行观察,对照组仅见少量的有髓神经纤维,并可见胶质瘢痕;NSCs移植组有髓神经纤维增多,且可见无髓神经纤维;相对于前两组而言,TGF-β1-siRNA组可见大量有髓及无髓神经纤维,且周图数量较多,再生的轴突髓鞘完整。见图8。
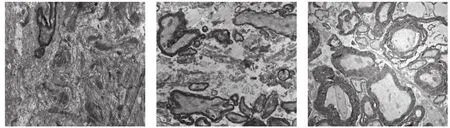
图8 透射电镜下HRP逆行示踪各组神经纤维超微结构(×10 000)
3 讨论
NSCs是一种较易获得、培养、增殖,临床应用前景又广泛的干细胞。其具有定向分化为神经细胞或胶质细胞、移植免疫排斥小及不受伦理学问题困扰的优势,且经多次传代后仍能保持干细胞的特性,并能在移植入体内后保持长期存活[12]。有研究表明NSCs在移植部位能够分裂增殖,并在局部微环境作用下分化为相应的细胞作为受损细胞的替代[12]。另有研究认为在脊髓损伤的相关区域,如果移植的NSCs是体外培养成的神经前体细胞,将有利于干细胞的存活及相应功能的形成[13]。但多项研究表明,单纯的移植NSCs对损伤的脊髓组织功能修复作用并非很理想,如能结合基因生物工程材料及药物等其他手段将会更好的进行综合治疗。TGF-β在调节细胞生长方面有突出作用[14]。目前NSCs移植被视为神经系统治疗的重要手段[15]。脊髓损伤区行NSCs移植能够形成突触连接。大量实验[16]说明细胞移植是修复脊髓损伤的有效方法之一。于局部微环境的作用下,移植区的NSCs会增生、分化,进而取代受损的组织。许多学者认为,该细胞要想在移植区发挥作用,需要先在体外条件下培养,当分化为神经前体细胞后再移植到受损部位,才会发挥相应的作用[17]。
本研究将TGF-β1-siRNA转染NSCs后移植入脊髓损伤大鼠体内,经荧光显微镜观察可见CM-Dil标记的NSCs,证明移植成功。随后对脊髓损伤后的运动功能进行观察,结果显示转染TGF-β1-siRNA的NSCs较单纯NSCs及对照组对大鼠运动功能改善更明显。说明TGF-β1沉默联合NSCs移植效果优于单纯NSCs移植的作用。1周后对脊髓损伤区Syn及TGF-β1的mRNA及蛋白表达情况进行比较,TGF-β1-siRNA组Syn表达明显高于其他两组,而TGF-β1显著降低。这提示TGF-β1表达下降有助于脊髓损伤后的修复。NSCs具多向分化潜能。进一步对各组神经纤维的再生情况进行观察发现,TGF-β1-siRNA组阳性神经纤维数最多。而应用透射电镜对脊髓损伤区的超微结构进行观察发现,TGF-β1-siRNA组的神经纤维明显增多,轴突数目增加,且再生轴突的髓鞘完整。
综上,转染TGF-β1-siRNA 的NSCs移植相对于单纯NSCs移植而言,对脊髓损伤后功能的修复作用更显著,前者能够有效的降低脊髓损伤区TGF-β1的表达,同时促进Syn表达,并对神经突触的再生有积极作用,使大鼠的运动功能得以改善。

