抑制LSD1对hiPSCs向定型内胚层分化的调控作用*
周淑艳, 李富荣, 闫红杰, 李 阳, 杨晓菲, 张根葆
(1皖南医学院病理生理学教研室, 安徽 芜湖 241002; 2暨南大学第二临床医学院, 深圳市人民医院, 干细胞与细胞治疗重点实验室,广东 深圳 518020)
组蛋白赖氨酸特异性去甲基化酶1(lysine specific demethylase 1, LSD1)在胚胎干细胞(embryonic stem cells, ESCs)、人诱导性多能干细胞(human induced pluripotent stem cells, hiPSCs)和神经干细胞等多种干细胞中表达[1-4]。LSD1主要锚定在包含二价染色体结构的靶基因转录调控区,通过特异性去除该区域组蛋白H3第4位赖氨酸的一甲基化、 二甲基化基团(H3K4me1/me2)而实现对靶基因的转录抑制作用[5]。文献报道,利用shRNA 敲低ESCs中的LSD1基因可上调间充质基因,如脱中胚蛋白(eomesodermin)、Y染色体性别决定区域盒17(sex determining region Y-box 17,SOX17)及叉头盒A2(forkhead box A2,FOXA2)等的表达,促进ESCs向定型内胚层(definitive endoderm,DE)分化[6]。DE是胚胎发育过程中形成消化道相关脏器组织(如肝脏和胰腺)必经的一个环节[7]。hiPSCs具有类似ESCs的全能性且无伦理学争议,深入研究iPSCs向DE分化的相关机制能够为hiPSCs向肝脏和胰腺等器官组织高效分化提供理论依据。然而,hiPSCs全基因组表达谱和蛋白组学修饰方面与ESCs具有不同的特质[8],抑制LSD1是否也能调控hiPSCs向DE分化尚不明确。基于此,本研究利用2种LSD1抑制剂反苯环丙胺(tranylcypromine, TCP)和硫酸苯乙肼(phenelzine sulfate,PHZ)抑制LSD1或用shRNA敲低LSD1的表达,观察LSD1在hiPSCs向DE分化过程中的作用,并对相关机制进行初步探讨。
材 料 和 方 法
1 细胞和shRNA构建
hiPSCs(来源于人皮肤成纤维细胞,国际通用代码:hNF1④C11)由深圳市人民医院干细胞与细胞治疗重点实验室的李富荣课题组惠赠。携带shRNA-LSD1的慢病毒载体pGLV2-U6-Puro及用于感染细胞的病毒原液由上海吉玛生物制药有限公司制备。
2 主要试剂和仪器
hiPSCs培养液mTeSRTM1和消化酶AccutaseTM购自Stem Cell Technologies;Matrigel、6 孔培养板、T25 培养瓶和离心管等培养耗材均购自BD;嘌呤霉素(puromycin,Puro)、胰酶、DMEM/F12和兔血清购自Gibco;LSD1抑制剂(TCP和PHZ)购自Sigma;CCK-8试剂盒购自苏州碧云天公司;总RNA提取试剂TRIzol Plus和qPCR试剂盒购自TaKaRa。核蛋白抽提试剂盒、LSD1活性检测试剂盒和ChIP试剂盒均购自EpiGentek;蛋白质共沉淀试剂盒Co-IP kit 购自Pierce;小鼠抗人LSD1、 H3K4me1/2/3、组蛋白去乙酰化酶1(histone deacetylase 1, HDAC1)、阻遏物元件1沉默转录因子辅阻遏物(co-repressor for repressor element-1-silencing transcription factor, CoREST)和H3K9ac抗体以及小鼠IgG购自Millipore;小鼠抗人 SOX17、FOXA2和lamin B抗体以及HRP标记的兔抗小鼠IgG购自CST;兔抗人LSD1、 HDAC1和CoREST抗体购自Active Motif。倒置显微镜购自Nikon;荧光定量PCR仪购自Roche;多头PCR仪、多功能酶标仪、SDS-PAGE 垂直电泳仪及成像分析仪购自Bio-Rad。
3 主要方法
3.1hiPSCs的培养 hiPSCs采用无饲养层细胞培养法,接种前需用 Matrigel包被培养瓶和培养皿,采用mTeSRTM1培养基进行常规培养,每天需更换新鲜培养液,细胞铺板率达到80%~90%可进行传代。
3.2沉默或抑制LSD1的表达 接种hiPSCs,铺板率达30%~50%时进行病毒转染或添加抑制剂。用包装有4条不同shRNA-LSD1序列(LSD1-863:5’-GCAGTTGTGGTTGGATAATCC-3’;LSD1-1086:5’-GCAGCTCGACAGTTACAAAGT-3’;LSD1-927:5’-GCACCTTATAACAGTGATACT-3’;LSD1-2495:5’-GGGCTCTTATTCCTATGTTGC-3’;错义链scrambled sequence:5’-GTCAAGTCTCACTTGCGTCAC-3’作为对照)的慢病毒液分别进行转染,24 h后更换含有1 mg/L Puro的新鲜mTeSRTM1进行筛选。每天更换培养液,连续筛选72 h。
抑制剂1反苯环丙胺的浓度梯度为0、0.5、1.5、2.5、5、7.5、10、20、30、40、60、80、120、160、200和300 μmol/L;抑制剂2硫酸苯乙肼的浓度梯度为0、0.5、1.5、2.5、5、7.5、10、15、20、30、40、80、120、160和200 μmol/L。每天更换含抑制剂的mTeSRTM1,连续培养72 h。
3.3hiPSCs多能及分化相关基因的检测 取经shRNA和抑制剂处理的hiPSCs,TRIzol试剂处理后抽提总RNA,并用PrimeScriptTMRT Reagent 试剂盒反转录为 cDNA,随后用SYBR Green Premix Ex TaqTM试剂盒进行qPCR,检测沉默或抑制LSD1后hiPCS的多能性基因OCT4、SOX2和NANOG及各胚层标志性基因SOX17、FOXA2、BMP2和TUBB3的 mRNA表达水平,所用引物序列见表1。

表1 qPCR引物序列
3.4hiPSCs增殖活性检测 用Accutase将hiPSCs消化成单细胞悬液并接种至96孔板,抑制剂组每孔1.5×104细胞,每一浓度设置3孔,48 h后加药,连续培养72 h;shRNA组每孔3×104个细胞/孔,每一序列设置3孔,24 h后进行病毒转染(转染24 h),随后更换含1 mg/L Puro的新鲜mTeSRTM1连续培养72 h。随后使用CCK-8法进行细胞活性检测。
3.5LSD1酶活性检测 取shRNA及LSD1抑制剂处理的hiPSCs(以常规培养的细胞为对照),使用EpiQuikTMNuclear Extraction Kit II (EpiGentek)抽提核蛋白,再依据EpiQuikTMHistone Demethylase LSD1 Activity/Inhibition Assay Kit (EpiGentek)测定并计算LSD1酶活性。
3.6Western blot实验 抽提shRNA(shRNA-LSD1-927)及LSD1抑制剂(20 μmol/L PHZ和40 μmol/L TCP)处理的hiPSCs核蛋白(以常规培养的细胞为对照),定量后进行SDS-PAGE,考马斯亮蓝染色后转移至PVDF膜上,用小鼠抗人LSD1、H3K4me1/2、 SOX17、 FOXA2和lamin B 抗体(1∶1 000)4 ℃孵育过夜,再用HRP标记的兔抗小鼠IgG(1∶3 000)室温孵育1 h,利用ECL发光试剂盒显影。
3.7LSD1复合体模式检测 取shRNA-LSD1-927处理及常规培养(作对照)的hiPSCs,参照蛋白质免疫共沉淀Co-IP试剂盒要求,加入细胞裂解液及蛋白酶抑制剂,离心取上清加入抗LSD1、 CoREST和HDAC1抗体(0.5~1 μg 单克隆抗体),对照组加入等量的正常兔血清,4 ℃孵育过夜,加入Protein A beads适度孵育后离心收集beads,处理后进行Western blot实验(具体操作参照3.6,Ⅰ抗浓度比列为1∶1 000,HRP标记的兔抗小鼠Ⅱ抗浓度比为1∶3 000)。
3.8ChIP-qPCR 取shRNA-LSD1-927处理及常规培养(作对照)的hiPSCs,参照染色质免疫共沉淀试剂盒EZ-ChIPTMChromatin Immunoprecipitation Kit(Millipore)要求,用1%甲醛进行交联,裂解液裂解后超声破碎DNA至200~1 000 bp,加入小鼠抗人LSD1、 H3K4me2/3、 HDAC1、 CoREST和H3K9ac抗体(1~10 μg)进行孵育,加入鲑鱼精/蛋白A琼脂糖处理,洗脱后解交联,并用纯化柱收集DNA片段。qPCR分析以上目的蛋白在定型内胚层基因SOX17和FOXA2启动子区域(-4 000 bp、 -2 000 bp、 -100 bp、+1 500 bp、 +2 000 bp和+4 000 bp)的结合情况,方法参见3.3,引物序列见表2。

表2 ChIP-qPCR引物序列
4 统计学处理
利用SPSS 16.0统计软件完成统计学分析,两组间比较用t检验,多组间比较采用单因素方差分析(one-way ANOVA),数据用均数±标准差(mean±SD)表示,以P<0.05表示差异有统计学意义。
结 果
1 抑制LSD1后hiPSCs的形态变化
正常hiPSCs克隆边界整齐,结构致密,核质比较高;利用抑制剂或shRNA抑制LSD1的表达后, hiPSCs克隆逐渐松散,细胞体积变大,核质比降低,呈现分化状态;将shRNA-LSD1-927组细胞传至第3代,分化状态更为明显,见图1A。
2 抑制LSD1对hiPSCs多能性和三胚层标志基因表达的影响
qPCR结果表明,添加PHZ或TCP后,LSD1及多能性基因OCT4和NANOG表达呈剂量依赖性下调,SOX2基因总体呈下调表达趋势,但其在TCP 80~160 μmol/L和PHZ 40~80 μmol/L区间出现反弹性上调表达;TCP 2.5~40 μmol/L区间是内、中胚层分化基因SOX17、FOXA2和BMP2的上调表达区间,其中定型内胚层标志基因SOX17基因在TCP 40 μmol/L时上调了近10倍(P<0.01);TCP 80~160 μmol/L区间是外胚层分化基因TUBB3上调表达区域;而PHZ 5~80 μmol/L区间是以上三胚层分化基因的共同上调表达区间,但主要上调内、中胚层基因FOXA2和BMP2的表达,且在20 μmol/L时对FOXA2上调幅度最大(P<0.01),见图1B、C。
另外,4条shRNA也不同程度地抑制LSD1和多能性基因OCT4、NANOG和SOX2的表达, shRNA-LSD1-1086对OCT4的抑制作用最为强烈;shRNA-LSD1-863和-927处理后的hiPSCs主要上调内、中胚层基因SOX17、FOXA2和BMP2的表达水平,其中shRNA-LSD1-927可上调SOX17基因12.7倍(P<0.01),见图1D。
3 抑制LSD1对hiPSCs活性的影响
CCK-8法分析,与对照组相比,TCP和PHZ分别在5 μmol/L和2.5 μmol/L时对hiPSCs活性的抑制作用开始有统计学差异(P<0.05),两者均在80 μmol/L时有显著的抑制作用(P<0.01),见图2A、B。4条不同序列shRNA分别处理后的 hiPSCs活性均下降, 其中shRNA-LSD1-863与shRNA-LSD1-927对hiPSCs活性的抑制能力相近, shRNA-LSD1-1086组的细胞活力最低,与对照组比较有显著差异(P<0.01),见图2C。细胞生长曲线分析可见,PHZ(20 μmol/L)、TCP(40 μmol/L)及shRNA-LSD1-927 3组细胞的活性较对照组均下降,其中shRNA-LSD1-927 组活性最弱,见图2D。
4 抑制LSD1后其酶活性水平的变化
LSD1酶活性试剂盒检测到在2种抑制剂(4个药物浓度)作用下LSD1酶活性均下降,与对照组相比较均有统计学差异;与对照组相比,scrambled shRNA组的LSD1酶活性变化无统计学差异, shRNA-LSD1-2495/-927/-863组下调且有统计学差异(P<0.05),见图2E。
5 抑制LSD1对定型内胚层相关蛋白表达的影响
Western blot实验结果表明, 抑制或沉默LSD1(20 μmol/L PHZ组、40 μmol/L TCP组和shRNA-LSD1-927组)可上调hiPSCs核内H3K4me1/me2蛋白表达水平(P<0.05或P<0.01);同时,定型内胚层标志蛋白SOX17和FOXA2的表达在各组中均有上调, shRNA-LSD1-927组的这2种蛋白上调幅度最大,见图2F、G。
6 LSD1与HDAC1共同存在于CoREST复合体中
IP-WB实验证实, LSD1、HDAC1和CoREST三者均存在于彼此的蛋白复合物中,见图3A。
7 抑制LSD1对SOX17和FOXA2转录活化的调控作用
ChIP-qPCR结果表明, LSD1、CoREST和HDAC1 3种蛋白主要结合在SOX17和FOXA2启动子区域上游2 000~100 bp区域,shRNA-LSD1-927干预后导致LSD1和HDAC1在该区域的结合水平显著下降(分别P<0.01和P<0.05),但CoREST结合水平与对照组相比没有统计学差异,见图3B。同时,当LSD1和HDAC1在该区域结合水平下降时,SOX17和FOXA2这一区域的H3K4me2/me3和H3K9ac富集水平显著上升(P<0.01),见图3C、D。
讨 论
LSD1在未分化的ESCs中表达水平较高,主要参与维持细胞的自我更新,伴随ESCs自主分化,其表达水平逐渐下降[5]。完全敲除果蝇胚胎中的LSD1会使其组蛋白H3K4 高度甲基化且基因表达异常,最终导致发育终止甚至胚胎死亡[9]。RNAi抑制人ESCs的LSD1基因后,多能性基因如OCT4和SOX2下降水平不会超过50%,ESCs开启分化状态但仍维持着较强的增殖能力[5],可见LSD1在维持ESCs增殖与分化平衡过程中至关重要。
本研究证实人皮肤成纤维细胞来源的iPSCs也高表达LSD1,利用shRNA或LSD抑制剂处理细胞后,多能性基因OCT4、SOX2和NANOG表达下降,当OCT4基因下调超过50%时hiPSCs的活性明显受限,且抑制LSD1能够上调hiPSCs 3个胚层特化的标志基因表达。Zhang等[6]利用shRNA沉默ESCs中的LSD1基因可促进ESCs向DE分化。Whythe等[10]使用LSD1抑制剂TCP抑制ESCs后外胚层基因TUBB3提前表达。本研究证实,LSD1受抑程度不同或酶活性水平不同时,各胚层分化发育标志性基因的上调水平也不尽相同,如在TCP 2.5~40 μmol/L时,hiPSCs内、中胚层分化占优势;而在TCP 40~160 μmol/L时, TUBB3的上调表达提示hiPSCs开启外、中胚层分化。值得注意的是,抑制LSD1后,当OCT4表达高于SOX2时,hiPSCs倾向于内、中胚层的分化(如TCP 2.5~40 μmol/L时和PHZ 5~20 μmol/L时);当SOX2表达高于OCT4时利于外中或外内胚层分化(如TCP 80~160 μmol/L时和PHZ 40~80 μmol/L)。文献证实,OCT4能抑制ESCs向神经外胚层分化,促进中胚层和内胚层分化,而SOX2能抑制向中胚层和内胚层分化,促进神经外胚层分化,分化信号连续不均匀地调节着OCT4和SOX2蛋白水平,最终导致细胞命运的选择和分化[11-12]。我们推测,hiPSCs的LSD1酶活性程度(或受抑制程度)也可能通过影响OCT4-SOX2基因表达平衡,继而影响其向三胚层分化的倾向。

Figure 1.Morphological changes of hiPSCs (A; scale bar=100 μm) and the mRNA expression of marker genes related to pluripotency and germ layer specification in the hiPSCs treated with TCP (B), PHZ (C) or shRNA-LSD1 (D). Mean±SD.n=3.*P<0.05,**P<0.01.
图1LSD1抑制剂或shRNA处理后hiPSCs的形态及多能性和三胚层标志基因的mRNA表达变化

Figure 2.Effect of LSD1 inhibitors or RNAi on viability, LSD1 activity and protein levels in hiPSCs. A, B and C: the viability of hiPSCs in PHZ groups, TCP groups and shRNA-LSD1 groups tested by CCK-8 assay; D: the growth curves of hiPSCs in different experimental groups; E: LSD1 activity in the experimental groups determined by LSD1 activity assay kit; F and G: Western blot for detecting the protein levels of LSD1, H3K4me1/me2, SOX17 and FOXA2 in hiPSCs after treatment with LSD1 inhibitors and shRNA-LSD1-927. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L group;#P<0.05,##P<0.01vscontrol group.
图2LSD1抑制剂或shRNA对hiPSCs活性、LSD1酶活性及蛋白水平的影响
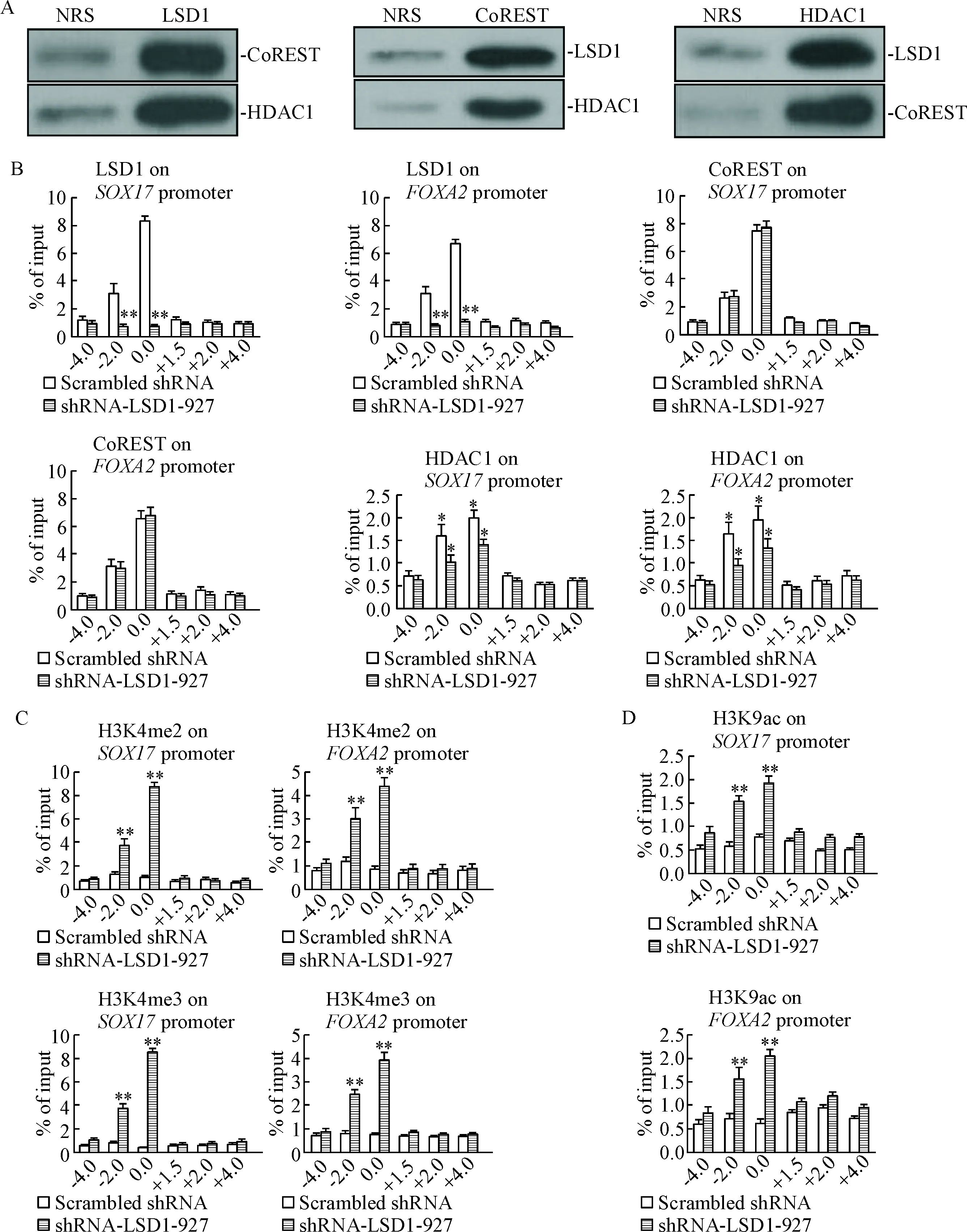
Figure 3.LSD1 knockdown with shRNA-LSD1-927 enhanced transcriptional activation of definitive endoderm marker genes. A: IP-WB assay showed that LSD1 and HDAC1 co-existed with the CoREST complexes (NRS is the abbreviation of normal rabbit serum, as control); B: ChIP-qPCR assay for examining the abundance of LSD1, CoREST and HDAC1 binding to the promoters ofSOX17 andFOXA2 after shRNA-LSD1-927 treatment in hiPSCs; C and D: ChIP-qPCR assay showed the accumulation of H3K4me2, H3K4me3 and H3K9ac at the promoters ofSOX17 andFOXA2 induced byLSD1 knockdown with shRNA-LSD1-927. Mean±SD.n=3.*P<0.05,**P<0.01vsscrambled shRNA group.
图3shRNA-LSD1-927沉默LSD1促进定型内胚层标志基因的转录活化
LSD1 在基因表达调控中的作用取决于特异性底物,不同的复合体模式(或分子伴侣模式)介导其作用于不同的底物,最终产生的生物学效应也不同[13-17]。在ESCs中,LSD1 通常与CoREST及HDACs等蛋白形成复合物[13],从而调控胚胎分化发育相关基因。CoREST 与染色质结合后招募LSD1并使其稳定,LSD1 作为转录复合抑制因子,能特异性地去除组蛋白H3K4的甲基基团,抑制靶基因的转录活化[14]。本研究通过IP-WB方法证实hiPSCs核内LSD1与HDAC1及 CoREST以复合物形式存在。ChIP-qPCR 实验观察到LSD1 、CoREST及HDAC1在DE标志基因SOX17和FOXA2启动子区域(上游2 000~100 bp)发生富集且三者富集位点基本一致,这也从侧面证明了在hiPSCs中LSD1-HDAC1-CoREST蛋白复合体的存在;同时这表明LSD1复合体可直接与SOX17和FOXA2的启动子相结合以调控该基因的表达。当shRNA-LSD1-927抑制LSD1后,SOX17和FOXA2启动子区域HDAC1结合水平显著下降但CoREST的结合水平并未受到影响,提示尽管三者以复合体形式存在,但LSD1的表达水平或酶活性水平只会影响HDAC1与靶基因的结合,CoREST的结合能力不具有LSD1依赖性,具体机制尚不清楚。
组蛋白H3K4的甲基化修饰与基因的转录活化密切相关[18]。基因启动子区域H3K4me2的富集标志着该基因会发生转录活化,而H3K4me3的富集则表示该基因已成功进行转录活化[19]。LSD1在体外能够去除H3K4的me1/me2但不能去除me3,但H3K4me2水平的不断上调会促进H3K4me3的富集[20]。本研究检测到沉默LSD1后SOX17和FOXA2的启动子区域(上游100~2 000 bp)的H3K4me2富集水平显著上调,促进这2个基因的转录活化,同时该区域H3K4me3的大量富集为这2个基因表达水平显著提高的可靠性提供了佐证。Western blot结果表明两者的蛋白表达水平确实有明显提高。ESCs中的LSD1-CoREST共抑制物对靶基因启动子区域H3K4进行去甲基化作用时,会抑制该基因启动子区域H3K9ac的发生,使得靶基因持续性地转录失活,而H3K9ac修饰可调控靶基因转录活化[5]。本研究证实,当LSD1和HDAC1在SOX17和FOXA2启动子区域结合水平下降时,H3K9ac在相同位点显著富集,进一步促进这2个基因的转录活化。
综上所述,适度抑制LSD1使其酶活性为正常水平的53.4%时利于hiPSCs向DE分化,其机制与DE分化关键基因SOX17和FOXA2启动子区域H3K4me2/me3和H3K9ac修饰水平的上调密切相关。

