MTMR14稳定敲减细胞株的建立及表型分析
沈金花,周 婉
(中南民族大学 生命科学学院,医学生物研究所&武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
MTMR14是近年来发现的一种磷酸肌醇磷酸酶,其特异性底物不是蛋白质而是磷酸肌醇. MTMR14在中央核肌病(CNM)、钙离子调节、自噬调节中具有重要作用[7],本文拟通过CRISPR/Cas9技术构建基因敲除细胞系,研究MTMR14基因对肺癌细胞增殖的影响.
1 材料与方法
1.1 材料和仪器
人胚肾细胞株(293T)购自武汉大学细胞库;肺癌细胞(A549)购自Procell 公司;PX458质粒、Stbl3感受态、10X T4 Ligation Buffer、T4连接酶(武汉淼灵生物);Fast AP、Fast Digest BpiI、10X Fast Digest Buffer、逆转录试剂盒(Thermo Scientific);T4 PNK、dNTP、rTaq、10X PCR Buffer(TaKaRa);DTT(Biosharp);去内毒素小提试剂盒(Omega Bio-Tek);胶回收试剂盒AxyPrep DNA Gel Extraction Kit(AxyGen);RPMI-1640培养基(HyClone);胰酶、双抗、Lipo-2000(Invitrogen);血清(ScienceII)BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶快速配制试剂盒(碧云天);anti-MTMR14(Abcam);HRP-goat anti mouse IgG、HRP-goat anti rabbit IgG(EarthOx); 引物合成和测序由武汉擎科生物有限公司完成.
超微量分光光度计(Nanodrop 2000,Thermo Fisher Scientific);酶标仪(Infinite200型,TECAN);Real-Time PCR System(7500fast型,Applied Biosystems).
1.2 构建基因敲减的293T细胞
1.2.1 sgRNA序列的设计和载体的选择
利用CRISPR在线设计工具网站http:∥crispr.mit.edu/,在MTMR14的外显子设计sgRNA,根据评分从高到低选择4对sgRNA序列(见表1).实验使用PX458载体,其序列分析见图1.
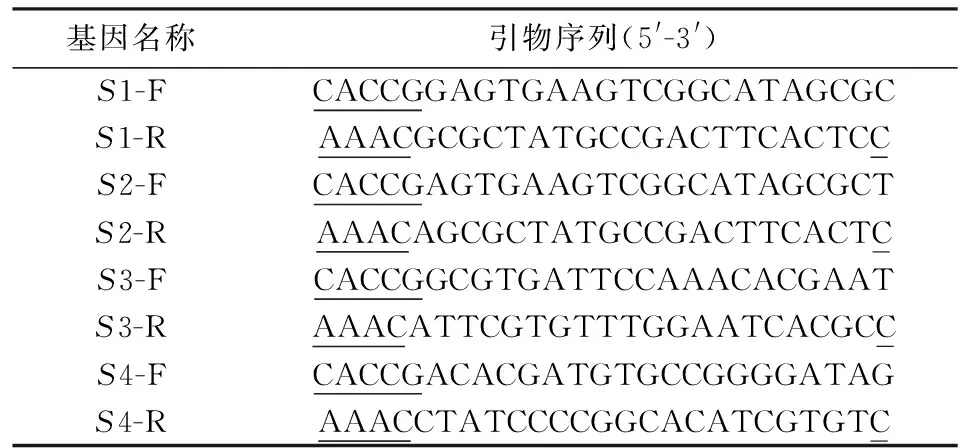
表1 MTMR14 sg-RNA引物序列Tab.1 Primer sequences of MTMR14 sg-RNA
注:标有下划线的部分代表加入的酶切位点序列
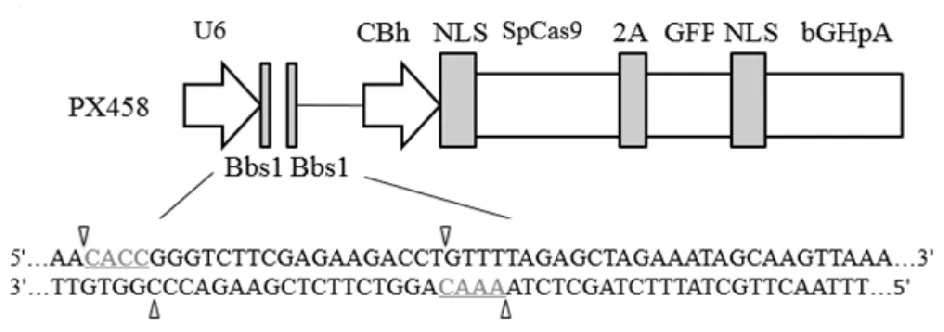
图1 PX458质粒结构分析Fig.1 Structure analysis of PX458 plasmid
1.2.2 PX458-sgRNA表达载体的构建和鉴定
用Fast Digest BpiI酶切质粒PX458,将sgRNA寡核苷酸链退火为双链,与切开的PX458连接,转化至stbl3感受态中,30 ℃过夜培养,挑取菌落做菌落PCR[8],送测序验证载体是否构建成功.
1.2.3 细胞转染及流式细胞仪分选
给定一个正确率矩阵A=(aij)N×l,aij为第j列分类器对验证集中第i类样本的分类正确率.如果mij=1,aij=0,意味着分类器hj对Ci类样本的分类正确率为0,即分类完全错误。此时,应将码字mij变为-1,其余码字维持不变.算法1给出了基于正确率变异的具体步骤.
取出前1 d已铺好的6孔板于显微镜下观察细胞密度,达到70%~80%的汇合度时,按照Lipo-2000的说明书将PX458-sgRNA表达载体转染至293T细胞中.继续培养48 h,用流式细胞仪分选,将成功转入载体的细胞单个分选到96孔板中,待细胞密度长到70%~80%后扩大规模培养.
1.2.4 基因敲除细胞系的鉴定
对每一株细胞进行测序鉴定,看基因是否被编辑.将基因组被编辑的细胞系提蛋白,用Western Blotting检测MTMR4蛋白的表达.
1.3 构建基因敲减的A549细胞
选取A549细胞作为研究的肺癌细胞株.将293T细胞中有作用的PX458-sgRNA表达载体转染至A549细胞中,用流式细胞仪进行分选,并对每一株细胞进行测序鉴定及Western Blotting检测MTMR4蛋白的表达.
1.4 MTT分析
分别接种1000个生长状态较好的A549细胞于96孔板中,每组重复6个,连续检测5 d.培养终止前4 h加入20 μL 5 mg/mL的MTT于孔中,无需换液.4 h后完全吸去培养基,加入150 μL DMSO,酶标仪振荡10 min,490 nm检测其OD值.
1.5 流式细胞仪分析
用15 mL离心管收集一个中皿的细胞,先用预冷的PBS洗1次,再用冷的PBS重悬细胞,加入3 mL冷的无水乙醇后将细胞吹成单细胞,4 ℃过夜固定细胞.染色前补加5 mL预冷的PBS至固定的细胞中,1500 r/min离心5 min,弃上清,加入新鲜配制的PI染色液,37 ℃避光反应30 min后用流式细胞仪检测其细胞周期.
1.6 RT-PCR
分别提取野生型细胞和MTMR14基因敲减的A549细胞的RNA,按照说明上的步骤逆转录成cDNA,在 Real-Time PCR仪上进行RT-PCR反应[9].
1.7 Western Blotting
分别提取野生型细胞和MTMR14基因敲减的A549细胞的蛋白,准备好SDS-PAGE胶后,80 V 40 min,分离胶100 V 1.5 h,然后转膜,100 V转1.5 h,TBST洗3次,每次10 min,5%的脱脂奶粉封闭1 h,孵一抗,4 ℃过夜.第2 d用TBST洗3次,每次10 min,室温孵二抗1 h,TBST洗3次,每次10 min,TBS洗2次,每次10 min,最后ECL显影.
1.8 统计分析
采用Microsoft office和CorelDRAW X4 SP2绘图,采用t-test统计数据.
2 结果
2.1 PX458-sgRNA表达载体的构建和鉴定
将sgRNA退火后形成的双链与酶切后的PX458连接得到的产物,转化到感受态stbl3中,挑取单克隆菌落,进行菌落PCR鉴定,然后送测序.测序结果显示,4对sg-RNA都与PX458载体正确连接.
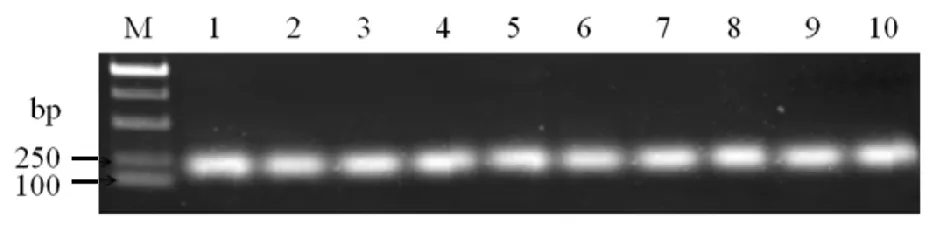
M) 15 Kb DNA marker; 1~3) PX458-sgRNA-1; 4~6) PX458-sgRNA-2;7,8) PX458-sgRNA-3; 9,10) PX458-sgRNA-4图2 构建敲除表达载体的菌落PCR和测序结果Fig.2 Colony PCR and sequencing results of constructed expression vectors
2.2 构建MTMR14基因敲除的293T细胞系
将测序正确的PX458-sgRNA表达载体转染至293T细胞中,分选单细胞到96孔板,待其扩大培养后,用测序和错配酶酶切的方法对细胞的基因组序列进行分析鉴定,用Western Blotting检测MTMR14蛋白的表达,结果见图3.由图3可见:sgRNA-H1-2, sgRNA-H8-1, sgRNA-H11-1这3株细胞的基因均被编辑了,且均能被错配酶切开,但仅sgRNA-H1-2的MTMR14的表达明显减少了,sgRNA-H8-1, sgRNA-H11-1均无明显变化.
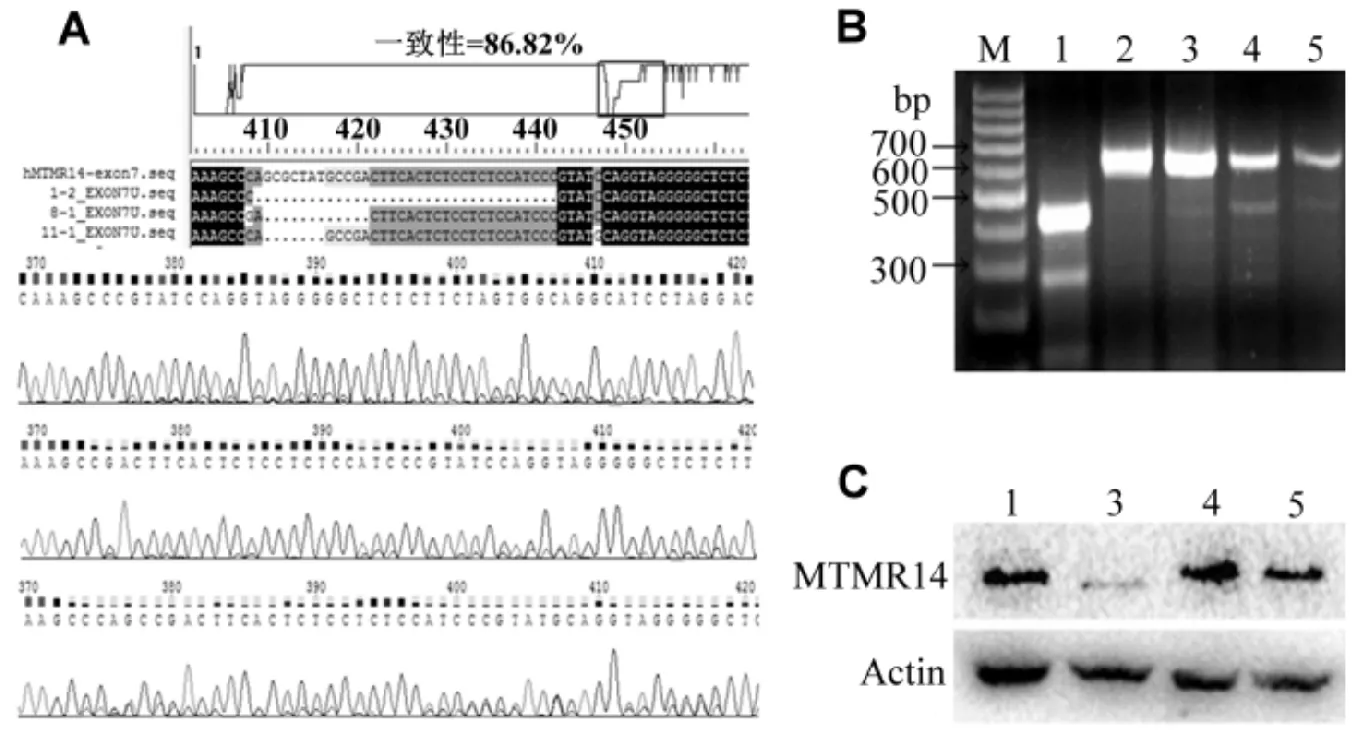
A)分选细胞的测序比对;B)分选细胞的错配酶鉴定:M) 100 bp DNA marker,1)阳性对照,2)阴性对照,3~5)分别为sgRNA-H1-2, sgRNA-H8-1, sgRNA-H11-1;C)分选细胞Western Blotting检测MTMR14的表达图3 分选的293T细胞的基因序列和蛋白表达分析鉴定Fig.3 Gene sequencing and protein expression analysis of sorted 293T cells
2.3 构建敲除MTMR14基因的A549细胞株
用工具细胞293T构建基因敲除细胞,建立基因敲除细胞系的平台并筛选有效的sgRNA,为研究MTMR14基因在肺癌细胞中的作用,以A549肺癌细胞为研究对象,分选A549细胞的基因序列和蛋白表达分析鉴定结果见图4.由图4可知: PX458-sgRNA-2能使MTMR14蛋白的表达量减少,故用PX458-sgRNA-2表达载体转染至A549细胞中,通过流式细胞仪将单个带绿色荧光的细胞筛选至96孔板中,通过测序及Western Blotting检测获得了一株基因敲减的A549细胞.
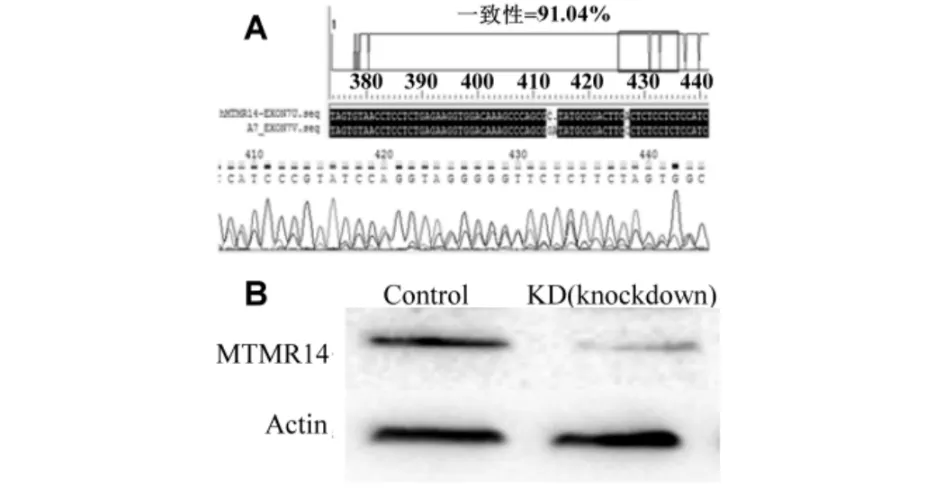
A)分选A549细胞的测序比对; B)分选细胞Western Botting检测MTMR14的表达图4 分选的A549细胞的基因序列和蛋白表达分析鉴定Fig.4 Gene sequencing and protein expression analysis of sorted A549 cells
2.4 MTMR14表达量的减少促进A549 的增殖
研究表明:在MEFs(小鼠胚胎成纤维细胞)[10]和小鼠成肌细胞[11]中,MTMR14的缺失会促进细胞的增殖,推测在A549细胞中,MTMR14表达量的减少影响细胞增殖,故设计了MTT实验进行验证,.结果见图5.由图5可知:MTMR14表达量的减少促进了A549 细胞的增殖.
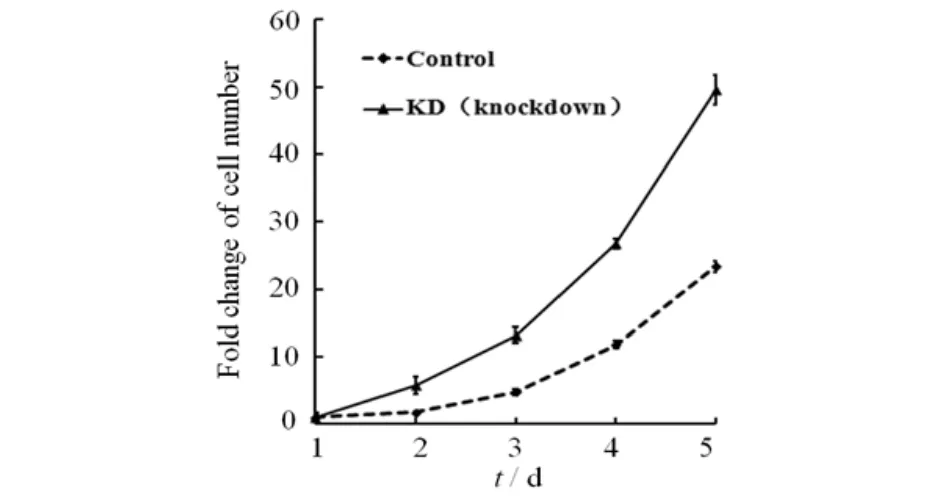
图5 MTMR14表达量的减少促进A549细胞的增殖Fig.5 Reduction of MTMR14 expression promotes the proliferation of A549 cells
2.5 流式细胞术检测非同步化 A549 细胞周期
细胞增殖的快慢与细胞周期的进程密切相关[12],采用流式细胞仪进一步检测MTMR14表达的减少对A549细胞周期进程的影响,结果见图6和表2.由图表可知:在非同步情况下,两组处于各时期细胞的比例基本相当,细胞周期无明显变化.
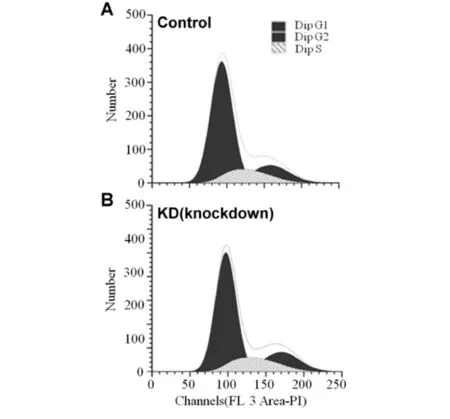
A)对照组; B)敲减组图6 流式细胞仪检测非同步化的A549 细胞的细胞周期Fig.6 Flow cytometry analysis to detect the cell cycle of asynchronous A549 cells
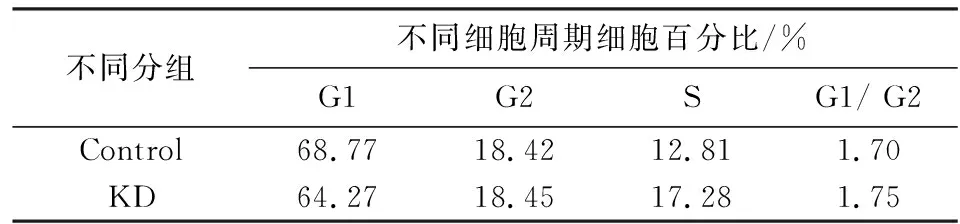
不同分组不同细胞周期细胞百分比/%G1G2SG1/ G2Control68.7718.4212.811.70KD64.2718.4517.281.75
2.6 Real-time PCR 检测细胞周期关键性调控因子转录水平
细胞周期的进程受到细胞周期调控因子的严密调控,分别选择CyclinD1和CyclinE这2个正调控因子,P21和P27这2个负调控因子,Real-time PCR检测其mRNA表达水平.结果见图7.如图7所示:细胞周期正调控因子CyclinD1,CyclinEmRNA表达水平显著增加,细胞周期负调控因子P21,P27 mRNA表达水平显著降低.
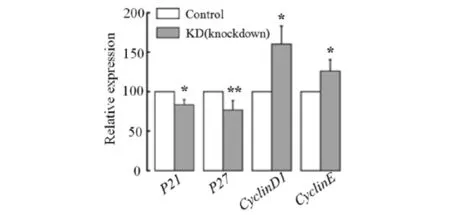
*P<0.05, **P<0.01,vs Control图7 两组细胞中细胞周期调控因子的mRNA表达Fig.7 mRNA expression of cell cycle regulatory factors in two groups of cells
3 讨论
CRISPR/Cas9技术是近年来备受关注的一项基因编辑技术,相对于之前的锌指核酸内切酶(ZFN)及类转录激活因子效应物核酸酶(TALEN),CRISPR/Cas9技术编辑效率更高效,操作更简单,成本更低.它只需针对目的基因设计对应的sgRNA,将其连接到一个载体上,转入研究对象中,再对其进行PCR和Western Blotting检测.以上这些优点使得CRISPR/Cas9技术得到广泛的应用.本文采用CRISPR/Cas9技术和流式细胞分选结合的方法,避开了病毒感染和有限稀释,确保了实验安全,能够更快速、轻松、高效地获得基因敲除细胞.
MTMR14是一种新型的磷酸肌醇磷酸酶,研究表明:MTMR14缺失会导致小鼠骨骼肌细胞肌质网Ryanodine通道开放,促进内钙释放,引起许多肌肉疾病,如中央核肌病、肌无力、肌肉疲劳和骨骼肌细胞衰老等[13, 14].MTMR14对细胞自噬和调节衰老有一定作用[10,15,16],MTMR14缺失会促进MEFs细胞增殖[10].基于以上研究,本文先利用CRISPR/Cas9技术构建了基因敲除的293T细胞,293T是一个工具细胞,易于转染和操作;再以肺癌细胞A549为研究对象,构建了MTMR14基因敲减的A549细胞系,并对野生型和MTMR14敲减的A549细胞进行一系列表型分析.结果表明:MTMR14表达减少明显地促进A549细胞增殖,野生型和敲减型细胞在各时期所占的细胞比无差异,说明在非同步化的情况下,MTMR14的减少对细胞周期无明显影响.通过Real-time PCR 检测发现细胞周期正调控因子CyclinD1,CyclinEmRNA表达水平显著增加,细胞周期负调控因子P21,P27 mRNA表达水平显著降低.
综上所述,本文构建了MTMR14基因敲减的细胞系,为基因功能研究提供了工具和方法;初步发现在肺癌细胞中MTMR14的减少促进了细胞增殖,为后续深入研究其功能奠定了基础.

