盐肤木根的化学成分及抗氧化活性研究
吴献,徐章文,谢丽欢,叶淼,3*,徐伟,3*
(1.福建中医药大学药学院,福建 福州 350122;2.福州海王金象中药制药有限公司,福建 福州 350014;3.福建省中药资源研究与开发利用重点实验室,福建 福州 350122)
近15年来,冠心病(coronary heart disease,CHD)一直都是全球威胁人类健康的头号杀手。据世界卫生组织(WHO)最新报告,至2015年,冠心病和中风导致了全球范围内1 500万例死亡,占总死亡人数的26.6%[1]。在我国,心脑血管疾病(cardiovascular disease,CVD)的患病率和死亡率均居首位。其中,冠心病患者人数1 100万,死亡率约为110/10万[2]。盐肤木(RhuschinensisMill.)系漆树科(Anacardiaceae)盐肤木属(Rhus)落叶小乔木。在我国,除东北、内蒙古和新疆外,其余地区均有分布[3]。据《开宝本草》记载,盐肤木树白皮主破血止血,其根茎能活血化瘀。福建省人民医院制药厂研制了以盐肤木为原料的单味制剂——舒冠通糖浆(国药准字Z35020635),经全国十多个单位交叉验证,共治疗冠心病346例,治疗冠心病疗效确凿[4],然其药效物质基础尚不明确。迄今为止,盐肤木根的化学成分研究鲜有报道,仅发现黄酮类化合物[5],而盐肤木其他部位(茎、叶、果实、五倍子)的化学成分研究表明,该植物主要含有黄酮[5-7]、酚酸[6-10]、鞣质[7]、脂肪酸[8]、三萜[6-7,9]这5种类型化合物。其中黄酮、酚酸及鞣质显示了一定的抗氧化、抑制胰脂肪酶[7,10]及抗炎活性[7,11]。本试验为了进一步研究盐肤木抗冠心病的有效成分,探讨其抗冠心病药效物质基础,对其进行了化学成分研究。按照生产工艺,对盐肤木根进行水提醇沉,得到盐肤木浸膏,采用色谱技术对其进行分离纯化,从中分离鉴定了20个化合物,分别鉴定为1,2,3,4,6-五-O-没食子酰基-β-D-葡萄糖(pentagalloylglucose,1)、1,2,3,6-四-O-没食子酰基-β-D-葡萄糖(teragalloylglucose,2)、没食子酸(gallic acid,3)、没食子酸甲酯(methyl gallate,4)、没食子酸乙酯(ethyl gallate,5)、鞣花酸(ellagic acid,6)、原儿茶醛(protocatechuic aldehyde,7)、原儿茶酸(protocatechuic acid,8)、苔黑酚葡萄糖苷(orcinol glucoside,9)、对羟基苯甲酸(p-hydroxybenzoic acid,10)、盐肤木内酯A(rhuscholide A,11)、芦丁(rutin,12)、漆黄素(fisetin,13)、山柰酚(kaempferol,14)、山柰酚-3-O-芸香糖苷(kaemferol-3-O-β-D-rutinoside,15)、紫铆亭(butin,16)、二氢漆黄素(fustin,17)、(+)-儿茶素[(+)-catechin,18]、根皮素(phloretin,19)、根皮苷(phloridzin,20)。其中有6个化合物(2、7、10、15、16、18)系首次从盐肤木中分离。另外,采用改进的1,1-二苯基-2-三硝基苯肼(DPPH)法对盐肤木中分离所得单体进行抗氧化活性测试,研究表明除苔黑酚葡萄糖苷(9)、对羟基苯甲酸(10)、盐肤木内酯A(11)、山柰酚-3-O-芸香糖苷(15)以及根皮苷(20)以外,其他化合物与DPPH反应均具有良好的的线性关系,并且呈现出较好的抗氧化活性,尤其是化合物1~7、12~14的抗氧化活性优于阳性对照维生素C,提示抗氧化损伤可能是舒冠通糖浆抗冠心病的机理之一。
1 仪器与试药
柱色谱硅胶(100~200、200~300目,青岛海洋化工厂);SP825L大孔树脂(日本三菱公司);ODS(50 μm,美国Welch公司);Waters AutoPurification自动纯化系统;XBridge Prep C18色谱柱(19 mm×150 mm,5 μm);Bruker Avance 400/500/600型超导核磁共振波谱仪(德国Bruker公司);micrOTOF高分辨率飞行时间质谱仪(德国Bruker公司);DPPH(美国Sigma公司);维生素C对照品(中国食品药品检定研究院);乙腈、甲醇为色谱纯(德国Merck公司);Milli-Q超纯水仪(美国Millipore公司),其余试剂均为分析纯。
盐肤木采自福建福州,经福建中医药大学药用植物实验室范世明高级实验师鉴定为漆树科盐肤木(R.chinensisMill.)的干燥根,其标本(编号:YFM20151003)存放于福建中医药大学生物医药研发中心标本室。
2 提取与分离
取盐肤木粗粉10.05 kg,加入10倍量水,回流提取两次,每次1.5 h,合并两次滤液,浓缩至2.02 g生药/mL,加入3倍量乙醇醇沉,放入4 ℃冰箱冷藏24 h后取出抽滤,得上清液,浓缩得浸膏438.51 g。取浸膏100.08 g,用500 mL热水分散,采用石油醚萃取,得到石油醚层浸膏9.84 g,剩余水层采用SP825L大孔树脂(60 cm×5.5 cm)粗分,上样后,分别用水(含1%甲酸)和95%乙醇梯度洗脱,各洗脱5 L,收集95%乙醇洗脱部位浓缩得浸膏65.21 g。石油醚部位(9.84 g)经硅胶柱色谱,石油醚-丙酮(20∶1→1∶1)梯度洗脱,每500 mL收集1份。其中第9~13号收集液合并,经过ODS柱(甲醇/水,9∶1)分离得到化合物11(35.05 mg);95%乙醇洗脱部位(65.21 g)经硅胶柱色谱,二氯甲烷-甲醇梯度(40∶1→1∶1)洗脱,薄层色谱(TLC)检识,合并得到5个馏分(Fr.1~5)。Fr.1经硅胶柱色谱,二氯甲烷-甲醇梯度洗脱(40∶1→20∶1),再经ODS柱(甲醇/水梯度洗脱)得化合物14(9.08 mg)和13(18.07 mg)。Fr.2经反复ODS色谱和纯化系统制备(乙腈-0.1%甲酸梯度洗脱)得化合物19(29.09 mg)、16(18.11 mg)、17(17.03 mg)、1(124.04 mg)和6(48.06 mg)。Fr.3经硅胶柱色谱,以二氯甲烷-甲醇(25∶1→1∶1)梯度洗脱,再经反复ODS柱色谱(甲醇/水梯度洗脱)得到化合物2(16.06 mg)、20(88.11 mg)、15(11.01 mg)、12(14.03 mg)、5(46.08 mg)和4(252.14 mg);Fr.4经硅胶柱色谱,以二氯甲烷-甲醇(20∶1→1∶2)梯度洗脱,再经反复ODS柱色谱(甲醇-水梯度洗脱)得化合物18(28.07 mg)、7(16.02 mg)和9(95.07 mg);Fr.5经反复ODS柱色谱得化合物10(13.01 mg)、8(17.04 mg)和3(185.13 mg)。
3 结构鉴定
3.1 化合物1 白色粉末,HR-ESI-MSm/z:939.109 4[M-H]-,(calcd.for C41H32O26940.118 2)。1H-NMR(CD3OD,400 MHz)δ:7.12,7.06,6.99,6.96,6.91 (each 2H,s,galloyl H-2,6);glc:6.24 (1H,d,J=8.32 Hz,H-1),5.90 (1H,dd,J=9.60,9.52 Hz,H-3),5.62 (1H,t,J=9.72 Hz,H-4),5.59 (1H,dd,J=9.80,8.35 Hz,H-2),4.52-4.40 (2H,m,H-6),3.78 (1H,m,H-5);13C-NMR (CD3OD,100 MHz)δ:galloyl:167.69,167.46,167.12,166.93,166.42 (C-7),146.75,146.64,146.51,146.42 (C-3,5),121.19,120.51,120.42,120.10 (C-1),110.79,110.69,110.43,110.07 (C-2,6);glc:93.81 (C-1′),72.24 (C-2′),73.90 (C-3′),69.23 (C-4′),74.12 (C-5′),63.41 (C-6′)。以上数据与文献[12]报道的1,2,3,4,6-五-O-没食子酰基-β-D-葡萄糖基本一致,故化合物1鉴定为1,2,3,4,6-五-O-没食子酰基-β-D-葡萄糖(pentagalloylglucose)。
3.2 化合物2 白色粉末,HR-ESI-MSm/z:789.115 0[M+H]+,(calcd.for C34H28O22788.107 2)。1H-NMR(CD3OD,400 MHz)δ:7.10,6.99,6.97,6.92 (each 2H,s,galloyl H-2,6),glc:6.22 (1H,d,J=8.32 Hz,H-1),5.69 (1H,J=9.65 Hz,H-3),5.37 (1H,dd,J=9.80,8.35 Hz,H-2),4.41 (2H,dd,J=12.32,4.20 Hz,H-6),4.22 (1H,m,H-5),4.02 (1H,s,H-4);13C-NMR (CD3OD,100 MHz)δ:galloyl:169.22,168.01,167.35,166.99 (C-7),147.05,146.55,146.04,145.89 (C-3,5),141.31,140.27,140.00,139.57 (C-4),121.26,120.89,120.28,120.02 (C-1),111.13,110.03,109.34,109.29 (C-2,6);glc:93.38 (C-1′),71.66 (C-2′),74.12 (C-3′),69.34 (C-4′),75.92 (C-5′),63.57 (C-6′)。以上数据与文献[13]报道的1,2,3,6-四-O-没食子酰基-β-D-葡萄糖基本一致,故化合物2鉴定为1,2,3,6-四-O-没食子酰基-β-D-葡萄糖(teragalloylglucose)。
3.3 化合物3 白色针状结晶(甲醇),HR-ESI-MSm/z:169.014 4[M-H]-,(calcd.for C7H6O5170.021 5)。1H-NMR (CD3OD,400 MHz)δ:7.08 (2H,s,H-2,6);13C-NMR (CD3OD,100 MHz)δ:120.55 (C-1),108.93 (C-2,6),144.99 (C-3,5),138.21 (C-4),169.03 (-COOH)。以上数据与文献[14]报道的没食子酸基本一致,故化合物3鉴定为没食子酸(gallic acid)。
3.4 化合物4 白色针状结晶(甲醇),HR-ESI-MSm/z:183.029 9[M-H]-,(calcd.for C8H8O5184.037 2)。1H-NMR (CD3OD,500 MHz)δ:7.03 (2H,s,H-2,6),3.80 (3H,s,-OCH3);13C-NMR (CD3OD,125 MHz)δ:121.38 (C-1),109.98 (C-2,6),146.48 (C-3,5),139.74 (C-4),169.01 (C-7),52.28 (-OCH3)。以上数据与文献[15]报道的没食子酸甲酯基本一致,故化合物4鉴定为没食子酸甲酯(methyl gallate)。
3.5 化合物5 白色针状结晶(甲醇),HR-ESI-MSm/z:197.045 5[M-H]-,(calcd.for C9H10O5198.052 8)。1H-NMR (DMSO-d6,400 MHz)δ:6.96 (2H,s,H-2,6),4.20 (2H,q,J=7.08 Hz,H-8),1.26 (3H,t,J=7.08 Hz,H-9);13C-NMR (DMSO-d6,100 MHz)δ:120.06 (C-1),108.93 (C-2,6),145.94 (C-3,5),138.78 (C-4),166.38 (C-7),60.57 (C-8),14.68 (C-9)。以上数据与文献[16]报道的没食子酸乙酯基本一致,故化合物5鉴定为没食子酸乙酯(ethyl gallate)。
3.6 化合物6 淡黄色粉末,HR-ESI-MSm/z:300.996 9[M-H]-,(calcd.for C14H6O8302.006 3)。1H-NMR (DMSO-d6,400 MHz)δ:7.46 (2H,s,H-5,5′);13C-NMR (DMSO-d6,100 MHz)δ:112.88 (C-1,1′),136.76 (C-2,2′),140.99 (C-3,3′),148.76 (C-4,4′),109.87 (C-5,5′),106.93 (C-6,6′),159.75 (C-7,7′)。以上数据与文献[17]报道的鞣花酸基本一致,故化合物6鉴定为鞣花酸(ellagic acid)。
3.7 化合物7 灰白色粉末,HR-ESI-MSm/z:137.023 7[M-H]-,(calcd.for C7H6O3138.031 7)。1H-NMR(DMSO-d6,400 MHz)δ:9.70 (1H,s,-CHO),7.27 (1H,dd,J=8.04,2.00 Hz,H-6),7.24 (1H,d,J=1.96,H-2),6.91 (1H,d,J=8.00 Hz,H-5);13C-NMR (DMSO-d6,100 MHz)δ:129.31 (C-1),114.80 (C-2),146.35 (C-3),152.59 (C-4),115.98 (C-5),124.98 (C-6),191.55 (C-7)。以上数据与文献[18]报道的原儿茶醛基本一致,故化合物7鉴定为原儿茶醛(protocatechuic aldehyde)。
3.8 化合物8 白色粉末,HR-ESI-MSm/z:153.018 0[M-H]-(calcd.for C7H6O4154.026 6)。1H-NMR (CD3OD,400 MHz)δ:7.41 (1H,brs,H-2),7.38 (1H,dd,J=8.84,2.08 Hz,H-6),6.77 (1H,d,J=7.64 Hz,H-5);13C-NMR (CD3OD,100 MHz)δ:123.09 (C-1),117.70 (C-2),146.05 (C-3),151.52 (C-4),115.74 (C-5),123.88 (C-6),170.24 (C-7)。以上数据与文献[19]报道的原儿茶酸基本一致,故化合物8鉴定为原儿茶酸(protocatechuic acid)。
3.9 化合物9 无色针晶(甲醇),HR-ESI-MSm/z:285.105 3[M-H]-,(calcd.for C13H18O7286.105 3)。1H-NMR (DMSO-d6,400 MHz)δ:6.29 (1H,brs,H-2),6.24 (1H,d,J=2.55 Hz,H-4),6.23 (1H,brs,H-6),4.74 (1H,d,J=7.60 Hz,H-1′),3.69 (1H,dd,J=11.44,2.36 Hz,H-6a),3.48 (1H,dd,J= 11.68,5.80 Hz,H-6b),3.30~3.15 (4H,overlapped,H-2~H-5),2.17 (3H,s,H-7);13C-NMR (DMSO-d6,100 MHz)δ:159.01 (C-1),101.31 (C-2),158.54 (C-3),108.28(C-4),139.70 (C-5),110.15 (C-6),21.78 (C-7),101.31 (C-1′),73.69 (C-2′),77.44 (C-3′),70.06 (C-4′),77.05 (C-5′),61.08 (C-6′)。以上数据与文献[20]报道的苔黑酚葡萄糖苷基本一致,故化合物9鉴定为苔黑酚葡萄糖苷(orcinol glucoside)。
3.10 化合物10 白色粉末,HR-ESI-MSm/z:137.023 5[M-H]-,(calcd.for C7H6O3138.031 7)。1H-NMR(CD3OD,400 MHz)δ:7.87 (2H,d,J=8.84 Hz,H-2,6),6.81 (2H,d,J= 8.84 Hz,H-3,5);13C-NMR (CD3OD,100 MHz)δ:122.65 (C-1),133.00 (C-2,6),116.02 (C-3,5),163.35 (C-4),170.04 (C-7)。以上数据与文献[21]报道的对羟基苯甲酸基本一致,故化合物10鉴定为对羟基苯甲酸(p-hydroxybenzoic acid)。
3.11 化合物11 淡黄色粉末,HR-ESI-MSm/z:463.320 7[M+H]+,(calcd.for C31H42O3462.313 4)。1H-NMR (CDCl3,600 MHz)δ:6.89 (1H,d,J=2.40 Hz,H-3),6.59 (1H,d,J=2.40 Hz,H-5),5.30 (1H,t,J=1.20 Hz,H-8),5.10 (3H,overlapped,H-12,15,20),3.35 (2H,d,J=7.20 Hz,H-7),2.57 (3H,s,H-5′),2.35 (3H,s,H-4′),2.17~1.92 (12H,m,H2-10,11,14,15,18,19),1.71 (3H,s,CH3-9),1.67 (3H,s,H-22),1.59 (3H,s,CH3-13),1.59 (3H,s,CH3-17),1.59 (3H,s,CH3-21);13C-NMR (CDCl3,150 MHz)δ:144.53 (C-1),124.57 (C-2),108.07 (C-3),151.62 (C-4),115.23 (C-5),125.24 (C-6),27.34 (C-7),120.61 (C-8),137.56 (C-9),39.66 (C-10),26.72 (C-11),124.36 (C-12),135.15 (C-13),39.70 (C-14),26.57 (C-15),124.18 (C-16),135.01 (C-17),39.70 (C-18),26.46 (C-19),123.98 (C-20),131.31 (C-21),25.69 (C-22),16.21 (CH3-9),16.04 (CH3-13),15.99 (CH3-17),17.67 (CH3-21),167.71 (C-1′),119.29 (C-2′),159.24 (C-3′),24.89 (C-4′),23.52 (C-5′)。以上数据与文献[22]报道的盐肤木内酯A基本一致,故化合物11鉴定为盐肤木内酯A(rhuscholide A)。
3.12 化合物12 黄色粉末,HR-ESI-MSm/z:609.146 1[M-H]-,(calcd.for C27H30O16610.153 4)。1H-NMR(DMSO-d6,400 MHz)δ:7.56 (1H,s,H-2′),7.55 (1H,d,J=7.52 Hz,H-6′),6.84 (1H,d,J=8.64 Hz,H-5′),6.39 (1H,d,J=2.00 Hz,H-8),6.20 (1H,d,J=2.04 Hz,H-6),5.35 (1H,d,J=7.36 Hz,H-1″),5.31 (1H,brs,H-1‴),0.99 (3H,d,J=6.16 Hz,H3-6‴);13C-NMR (DMSO-d6,100 MHz)δ:156.87 (C-2),133.73 (C-3),177.81 (C-4),161.66 (C-5),99.14 (C-6),164.54 (C-7),94.05 (C-8),157.06 (C-9),104.40 (C-10),121.62 (C-1′),115.67 (C-2′),145.19 (C-3′),148.86 (C-4′),116.71 (C-5′),122.04 (C-6′),101.20 (C-1″),74.52 (C-2″),76.88 (C-3″),70.44 (C-4″),76.36 (C-5″),67.45 (C-6″),101.62 (C-1‴),70.82 (C-2‴),71.00 (C-3‴),72.28 (C-4‴),68.70 (C-5‴),18.20 (C-6‴)。以上数据与文献[23]报道的芦丁基本一致,故化合物12鉴定为芦丁(rutin)。
3.13 化合物13 黄色粉末,HR-ESI-MSm/z:285.039 3[M-H]-(calcd.for C15H10O6286.047 7)。1H-NMR(DMSO-d6,400 MHz)δ:7.91 (1H,d,J=9.32 Hz,H-5),7.67 (1H,d,J=2.00 Hz,H-2′),7.53 (1H,dd,J=8.44,2.00 Hz,H-6′),6.91 (1H,m,H-6),6.90 (1H,m,H-8),6.86 (1H,m,H-5′);13C-NMR (DMSO-d6,100 MHz)δ:145.10 (C-2),137.32 (C-3),172.02 (C-4),126.50 (C-5),115.63 (C-6),162.61 (C-7),101.90 (C-8),156.42 (C-9),114.18 (C-10),122.50 (C-1′),114.86 (C-2′),145.00 (C-3′),147.32 (C-4′),114.97 (C-5′),119.70 (C-6′)。以上数据与文献[24]报道的漆黄素基本一致,故化合物13鉴定为漆黄素(fisetin)。
3.14 化合物14 黄色粉末,HR-ESI-MSm/z:285.039 5[M-H]-(calcd.for C15H10O6286.047 7)。1H-NMR(DMSO-d6,400 MHz)δ:12.49 (1H,s,OH-5),8.06 (2H,d,J=8.84 Hz,H-2′,6′),6.94 (2H,d,J=8.84 Hz,H-3′,5′),6.45 (1H,d,J=1.96 Hz,H-8),6.21 (1H,d,J=1.96 Hz,H-6);13C-NMR (DMSO-d6,100 MHz)δ:147.28 (C-2),136.12 (C-3),176.37 (C-4),159.65 (C-5),98.67 (C-6),164.35 (C-7),93.95 (C-8),161.18 (C-8a),103.52 (C-4a),122.14 (C-1′),129.97 (C-2′,6′),115.91 (C-3′,5′),156.64 (C-4′)。以上数据与文献[25]报道的山柰酚基本一致,故化合物14鉴定为山柰酚(kaempferol)。
3.15 化合物15 黄色粉末,HR-ESI-MSm/z:593.150 3[M-H]-,(calcd.for C27H30O15594.158 5)。1H-NMR(DMSO-d6,400 MHz)δ:7.99 (2H,d,J= 8.52 Hz,H-2′,6′),6.88 (2H,d,J= 8.48 Hz,H-3′,5′),6.39 (1H,brs,H-8),6.19 (1H,brs,H-6),5.31 (1H,d,J= 7.32 Hz,H-1″),4.38 (1H,s,H-1‴),0.99 (3H,d,J= 5.96 Hz,H3-6‴);13C-NMR (DMSO-d6,100 MHz)δ:157.18(C-2),133.62 (C-3),177.70 (C-4),161.66 (C-5),99.41 (C-6),165.43 (C-7),94.29 (C-8),157.02 (C-9),104.16 (C-10),121.31 (C-1),131.31 (C-2′,6′),115.56 (C-3′,5′),160.40 (C-4′),101.88 (C-1″),74.63 (C-2″),76.17 (C-3″),70.34 (C-4″),76.81 (C-5″),67.34 (C-6″),101.25 (C-1‴),71.03 (C-2‴),70.80 (C-3‴),72.27 (C-4‴),68.72 (C-5‴),18.21 (C-6‴)。以上数据与文献[26]报道的山柰酚-3-O-芸香糖苷一致,故化合物15鉴定为山柰酚-3-O-芸香糖苷(kaemferol-3-O-β-D-rutinoside)。
3.16 化合物16 黄色粉末,HR-ESI-MSm/z:271.060 6[M-H]-,(calcd.for C15H12O5272.068 5)。1H-NMR(CD3OD,600 MHz)δ:7.68 (1H,d,J=8.40 Hz,H-5),6.90 (1H,s,H-2),6.76 (2H,m,H-5′,6′),6.46 (1H,dd,J=8.40,1.80 Hz,H-6),6.32 (1H,d,J= 1.80 Hz,H-8),5.26 (1H,d,J=11.60 Hz,H-2),2.97 (1H,dd,J=16.80,11.40 Hz,H-3α),2.66 (1H,d,J=16.80 Hz,H-3β);13C-NMR (CD3OD,150 MHz)δ:80.82 (C-2),44.76 (C-3),193.38 (C-4),129.62 (C-5),111.65 (C-6),166.76 (C-7),103.67 (C-8),165.39 (C-9),114.75 (C-10),131.85 (C-1′),114.54 (C-2′),146.68 (C-3′),146.37 (C-4′),116.16 (C-5′),119.08 (C-6′)。以上数据与文献[27]报道的紫铆亭基本一致,故化合物16鉴定为紫铆亭(butin)。
3.17 化合物17 黄色粉末,HR-ESI-MSm/z:287.056 1[M-H]-,(calcd.for C15H12O6288.063 4)。1H-NMR(DMSO-d6,400 MHz)δ:7.62 (1H,d,J=8.40 Hz,H-5),6.87 (1H,d,J=1.80 Hz,H-2′),6.73 (2H,m,H-5′,6′),6.51 (1H,dd,J=8.80,2.40 Hz,H-6),6.29 (1H,d,J=2.40 Hz,H-8),4.95 (1H,d,J=11.60 Hz,H-2),4.40 (1H,d,J=11.20 Hz,H-3);13C-NMR (DMSO-d6,100 MHz)δ:83.57 (C-2),72.64 (C-3),192.47 (C-4),128.41 (C-5),110.93 (C-6),164.92 (C-7),102.45 (C-8),128.76 (C-1′),112.14 (C-2′),144.94 (C-3′),145.72 (C-4′),115.12 (C-5′),119.47 (C-6′)。以上数据与文献[28]报道的二氢漆黄素基本一致,故化合物17鉴定为二氢漆黄素(fustin)。
3.18 化合物18 白色粉末,HR-ESI-MSm/z:289.071 2[M-H]-,(calcd.for C15H14O6290.079 0)。1H-NMR(CD3OD,600 MHz)δ:6.83 (1H,d,J= 1.62 Hz,H-2′),6.76 (1H,d,J= 8.04 Hz,H-5′),6.71 (1H,dd,J=8.10,1.68 Hz,H-6′),5.92 (1H,d,J=2.10 Hz,H-8),5.85 (1H,d,J=2.04 Hz,H-6),4.56 (1H,d,J=7.50 Hz,H-2),3.97 (1H,m,H-3),2.84 (1H,dd,J=16.08,5.34 Hz,H-4a),2.50 (1H,dd,J=16.08,8.16 Hz,H-4b);13C-NMR (CD3OD,150 MHz)δ:81.46 (C-2),67.43 (C-3),27.11 (C-4),156.44 (C-5),94.93 (C-6),156.18 (C-7),94.14 (C-8),155.53 (C-9),99.45 (C-10),130.85 (C-1′),113.88 (C-2′),144.83 (C-3′),145.66 (C-4′),114.70 (C-5′),118.65 (C-6′)。以上数据与文献[29]报道的儿茶素基本一致,故化合物18鉴定为(+)-儿茶素((+)-catechin)。
3.19 化合物19 无色粉末,HR-ESI-MSm/z:273.076 8[M-H]-,(calcd.for C15H14O5274.084 1)。1H-NMR (DMSO-d6,400 MHz)δ:12.24 (2H,s,2′,6′-OH),10.35 (1H,s,4′-OH),9.14 (1H,s,4-OH),7.02 (2H,d,J=8.44 Hz,H-2,6),6.67 (2H,d,J=8.44 Hz,H-3,5),5.82 (2H,s,H-3′,5′),3.21 (2H,t,J=7.64 Hz,H-α),2.76 (2H,t,J=7.40 Hz,H-β);13C-NMR (DMSO-d6,100 MHz)δ:132.09 (C-1),129.61 (C-2,6),115.52 (C-3,5),155.84 (C-4),104.18 (C-1′),164.66 (C-2′,6′),95.12 (C-3′,5′),165.04 (C-4′),45.94 (C-α),29.90 (C-β),204.67 (C=O)。以上数据与文献[30]报道的根皮素基本一致,故化合物19鉴定为根皮素(phloretin)。
3.20 化合物20 黄色粉末,HR-ESI-MSm/z:435.127 9[M-H]-,(calcd.for C21H24O10436.136 9)。1H-NMR (CD3OD,400 MHz)δ:7.06 (2H,d,J=8.40 Hz,H-2,6),6.67 (2H,d,J=8.40 Hz,H-3,5),6.17 (1H,d,J=2.40 Hz,H-3′),5.94 (1H,d,J=2.40 Hz,H-5′),5.03 (1H,d,J=7.60 Hz,H-1″),3.90 (1H,dd,J=12.00,2.00 Hz,H-6a″),3.71 (1H,dd,J=12.00,5.20 Hz,H-6b″),3.50~3.39 (overlapped,H-α, H-2″~H-5″),2.87 (2H,t,H-β);13C-NMR (CD3OD,100 MHz)δ:133.27 (C-1),130.16 (C-2,6),115.83 (C-3,5),156.21 (C-4),106.20 (C-1′),167.57 (C-2′),98.00 (C-3′),162.14 (C-4′),95.22 (C-5′),165.42 (C-6′),46.26 (C-α),29.80 (C-β),206.37 (C=O),101.92 (C-1″),74.36 (C-2″),77.92 (C-3″),71.03 (C-4″),78.18 (C-5″),62.44 (C-6″)。以上数据与文献[31]报道的根皮苷基本一致,故化合物20鉴定为根皮苷(phloridzin)。
4 抗氧化活性研究
参照文献报道的实验方法[32]进行适当改进,精密称取适量DPPH,用甲醇配成50 μg·mL-1,避光备用。将单体样品用甲醇制成系列浓度,各取10 μL加入790 μL DPPH溶液于EP管中混匀,避光反应30 min。反应结束后,立即精密吸取200 μL反应液置于96孔板(n=3)中,于517 nm波长处检测吸光度(As)值。同时测定空白对照体系:10 μL甲醇溶剂与790 μL DPPH溶液混合后的Ac值,以及背景信号纯甲醇200 μL的Ab值,每个浓度重复测3次,根据公式计算清除率,以清除率为纵坐标(Y),
清除率=1-(As-Ab)/(Ac-Ab)
单体浓度为横坐标(X)进行线性回归计算,以清除率为50%时待测样品浓度(IC50)为评价指标,以维生素C为阳性对照。盐肤木中20种单体化合物的抗氧化活性结果见表1。
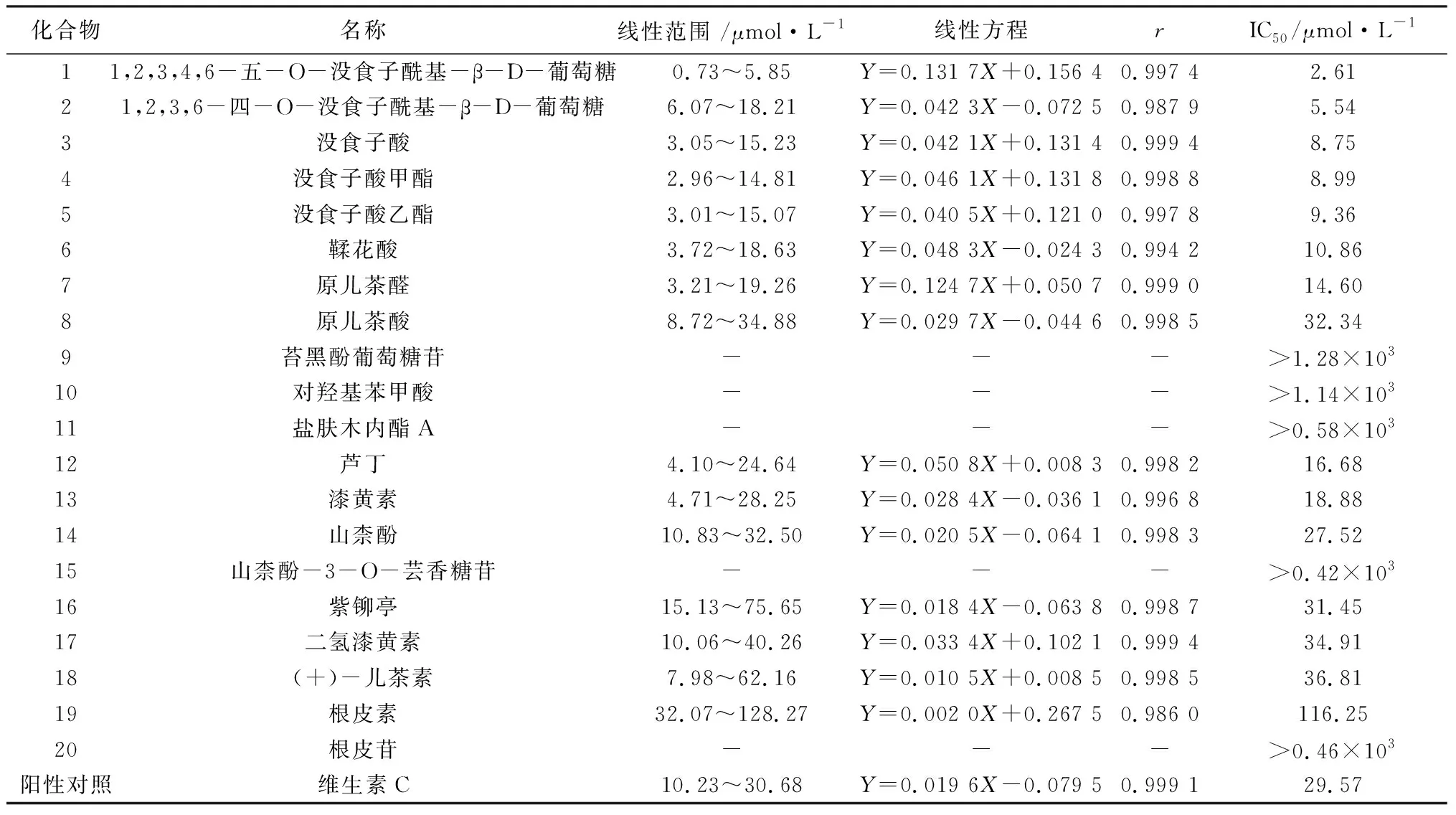
表1 盐肤木中20种化合物体外清除自由基活性检测结果
5 讨论
课题组从舒冠通糖浆原料盐肤木中共分离鉴定20个化学成分,通过对所分离得到化合物进行DPPH活性测试,结果表明1,2,3,4,6-五-O-没食子酰基-β-D-葡萄糖(1)、1,2,3,6-四-O-没食子酰基-β-D-葡萄糖(2)、没食子酸(3)、没食子酸甲酯(4)、没食子酸乙酯(5)、鞣花酸(6)、原儿茶醛(7)、芦丁(12)、漆黄素(13)、山柰酚(14)的抗氧化活性优于阳性对照药维生素C。
舒冠通糖浆原料盐肤木中20种化合物,抗氧化活性不同。对DPPH抗氧化活性进行分析。
5.1 对于酚酸类成分 首先,具有没食子酰基结构的化合物具有显著的抗氧化活性(均优于阳性药维生素C),并且其活性与含没食子酰基结构的数量呈正相关,1,2,3,4,6-五-O-没食子酰基-β-D-葡萄糖(1)其具有5个没食子酰基结构,其抗氧化活性为所有测试化合物中最强,IC50为2.61 μmol·L-1,其次为1,2,3,6-四-O-没食子酰基-β-D-葡萄糖(2),其具有4个没食子酰基结构,IC50为5.54 μmol·L-1,而具有单个没食子酰基结构的没食子酸(3)、没食子酸甲酯(4)和没食子酸乙酯(5)活性相当;其次,具有邻位酚羟基结构的酚酸类成分表现良好的抗氧化活性,其中鞣花酸(6)具有两个邻位酚羟基结构,其抗氧化IC50为10.86 μmol·L-1,原儿茶醛(7)和原儿茶酸(8)具有邻位酚羟基结构,但是因原儿茶醛还具有还原性结构醛基(IC50值为14.60 μmol·L-1),所以其抗氧化活性显著优于原儿茶酸(IC50值为32.34 μmol·L-1);第三,仅有酚羟基结构的苔黑酚葡萄糖苷(9)、对羟基苯甲酸(10)和盐肤木内酯A(11)没有表现出明显活性。
5.2 对于黄酮类成分 首先,黄酮醇或者黄酮苷,具有B环邻二酚羟基结构的芦丁(12)和漆黄素(13),其抗氧化IC50值分别为16.68、18.88 μmol·L-1,显著优于仅有单一酚羟基的山柰酚(14)和山柰酚-3-O-芸香糖苷(15),其中山柰酚结构C环的3位羟基苷取代后,抗氧化活性下降;其次,对于二氢黄酮类,二氢漆黄素(17)相比于漆黄素(13),由于2,3位的双键氢化,其活性下降为IC50值34.91 μmol·L-1,具有相似结构的紫铆亭(16)IC50值为31.45 μmol·L-1,而黄烷醇类黄酮(+)-儿茶素(18)由于其缺少了4位羰基结构,其抗氧化活性也相对较小,IC50值为36.81 μmol·L-1;第三,对于查尔酮类黄酮根皮素(19)和根皮苷(20),由于其B环结构上没有邻二酚羟基结构,仅有A环的间二酚羟基结构,其抗氧化活性显著低于本次分离的其他黄酮成分。
本试验对舒冠通糖浆原料盐肤木的化学成分进行研究,共鉴定出20个化合物,其中6个成分是首次从盐肤木中分离得到,可为其进一步的开发与利用提供依据。此外,本次分离所得到的化合物主要成分为黄酮类和酚酸类,并对其开展了DPPH抗氧化活性测试,结果表明多数成分均具有良好的抗氧化能力,可为加强和完善盐肤木化学成分的研究,明确其抗氧化的药效物质基础,同时也为舒冠通糖浆抗冠心病机制的研究奠定基础。

