草酸艾司西酞普兰片有关物质及其影响因素的研究
聂延君,王文心,郑静,窦艳丽,徐玉文
(山东省食品药品检验研究院,山东 济南 250101)
草酸艾司西酞普兰(escitalopram oxalate)是西酞普兰的右旋对映体(见图1),是一种选择性5-羟色胺再摄取抑制剂(SSRI),可抑制5-羟色胺的再摄取,主要用于治疗抑郁障碍,治疗伴有或不伴有广场恐惧症的惊恐障碍[1-3]。该药具有作用强、起效快、代谢快和耐受性好的特点,是一线抗抑郁药[4-5]。该药由Forest Laboratories和丹麦的 Lundbeck 公司联合研究开发,2002年3月首次以商品名Laxapro在瑞典上市[6]。西安杨森制药有限公司于2006年获得进口药品分装批准文号,该品种开始在国内上市,目前国内已有5家企业的仿制药在市场上销售。
草酸艾司西酞普兰片是2016年国家评价性抽验品种之一,共收集到了81批样品,规格有:5、10和20 mg 3种,来自国内5家仿制药企业和原研进口丹麦灵北制药厂(Lundbeck),企业覆盖率达到了100%。该品种在《中国药典》尚未收载,现行国外药典中仅《美国药典》第41版(USP41)收载。探索性研究发现国内部分企业与原研样品间有关物质差异较大,因此,为了更好提高产品质量,找到影响有关物质的关键因素,本文参照USP41有关物质检查方法开展了温湿度、辅料相容性、包装材料性能比较、水活度等一系列试验,为制定合理的处方工艺和储存方法,提高样品稳定性提供参考。
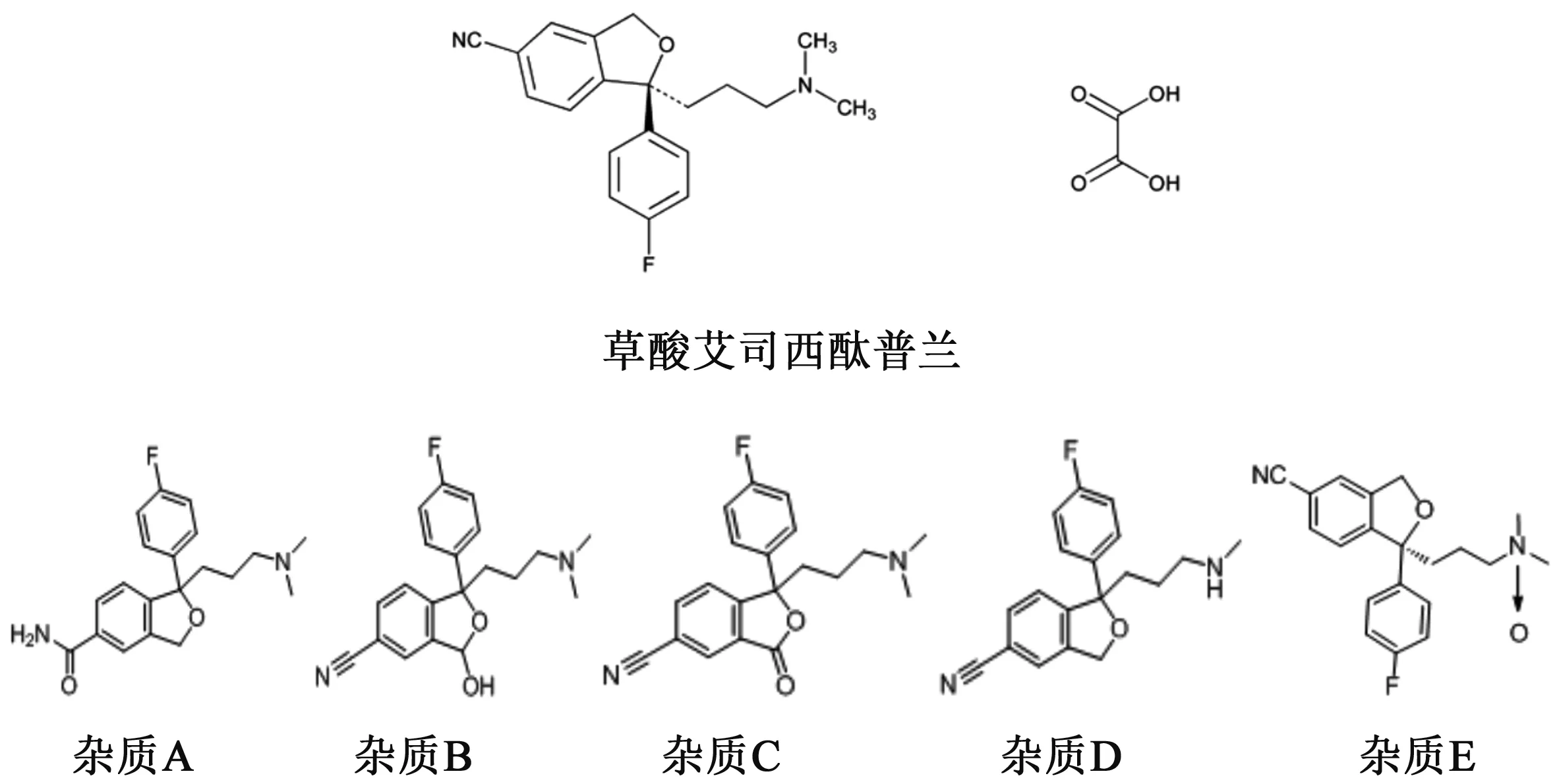
图1 草酸艾司西酞普兰和相关杂质结构
1 仪器与试药
1.1 仪器 Waters e2695高效液相色谱仪(美国Waters公司);Novasina Lab Master水活度测定仪(瑞士Novasina公司);KBF-P240恒温恒湿箱(德国Binder公司)。
1.2 试药 81批样品分别来自丹麦灵北(Lundbeck)和国内A、B、C、D和E企业,草酸艾司西酞普兰原料药由浙江华海药业股份有限公司提供(批号:5357-15-006),杂质A对照品(USP,批号:R015E0,含量100%),杂质B对照品(USP,批号:G0L552,含量100%),杂质C对照品(USP,批号:R030U0,含量100%),杂质D对照品(USP,批号:R01270,含量100%),杂质E对照品(USP,批号:G0M155,含量100%),磷酸、氢氧化钠、磷酸二氢钾均为分析纯;乙腈为色谱纯。
2 方法与结果
2.1 测定方法 参考USP41草酸艾司西酞普兰有关物质检查方法[7],采用资生堂Capcell C18柱;流动相A为0.025 mol·L-1磷酸盐溶液(pH 3.0)-乙腈(9∶1),流动相B为0.025 mol·L-1磷酸盐溶液(pH 3.0)-乙腈(7∶13),梯度洗脱:0~35 min,95%→65% A,35~45 min,65%→0% A,45.1~60 min,0%→0% A,60.1~68 min,95%→95% A;柱温为 45 ℃;检测波长为 237 nm;进样量为 20 μL。图谱见图2。
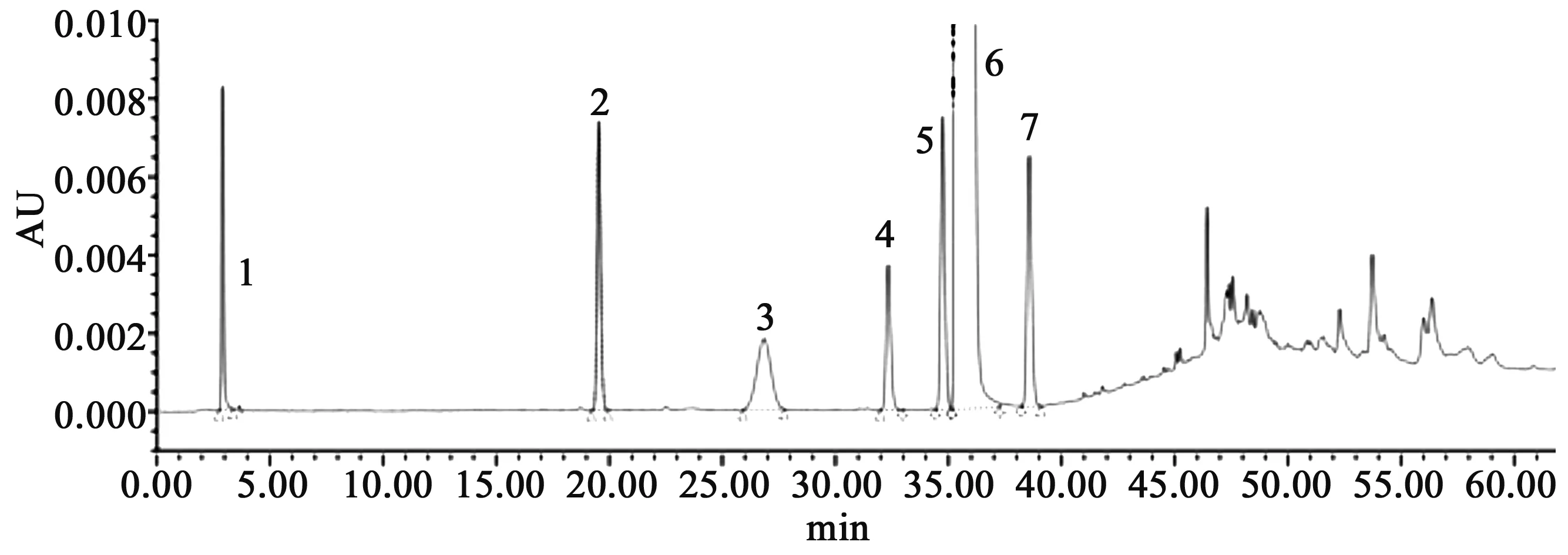
1.草酸;2.杂质A;3.杂质B;4.杂质C;5.杂质D;6.艾司西酞普兰;7.杂质E图2 草酸艾司西酞普兰相关杂质图谱和结构式图谱
2.2 方法学验证 ①专属性试验:分别采用强酸、强碱、光照、氧化和加热的方式对草酸艾司西酞普兰片进行破坏性试验,结果杂质与主峰以及杂质之间的分离度均较好,能够有效分离,杂质A、B、C和E为主要的降解杂质;②重复性试验:在空白辅料溶液中定量加入草酸艾司西酞普兰对照品,分别制备浓度为1 μg·mL-1的6份样品溶液进行重复性试验,RSD值小于2.0%;③稳定性试验:取0.5 mg·mL-1的供试品溶液,在0、2、4、6、8 h分别进样,结果8 h内的峰面积RSD值小于2.0%; ④线性试验:草酸艾司西酞普兰对照品在0.05~10 μg·mL-1浓度范围内呈线性,相关系数r=1.000;⑤回收率试验: 取已知含量的草酸艾司西酞普兰供试品溶液9份,分别定量加入对照品溶液,制备成2.0、2.2、2.4 μg·mL-1的溶液各3份,直接进样,回收率在98%~101%之间,RSD值小于2.0%;⑥检出限和定量限:分别取对照品适量,用流动相A逐步稀释,定容,进样测定,当草酸艾司西酞普兰峰信噪比(S/N)为3时,即为检出限,信噪比(S/N)值在10时,即为定量限;结果草酸艾司西酞普兰检出限为0.05 ng和0.15 ng。
2.3 检验结果 本次试验收集到的样品已知杂质A、B、C、E含量,其他单个杂质含量和杂质总量均低于拟定限度和USP41 限度,均符合规定,但6家企业样品间具有较大差异,结果见图3、表1。以最大单个杂质(杂质C)为例,企业B样品中杂质C含量最高,平均为0.27%,而原研为0.13%,相差1倍。总杂上,企业E样品最大的为0.70%,是原研的3.5倍,企业D的8倍,企业E样品批间差异均明显大于其他企业。国内D企业和原研Lundbeck的样品杂质水平相当,甚至优于原研。企业B和E的样品杂质离散性较大,可能与生产工艺和储存环境有关。
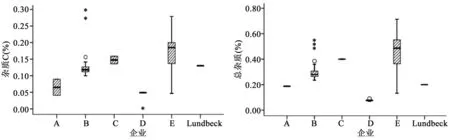
图3 有关物质检查结果汇总
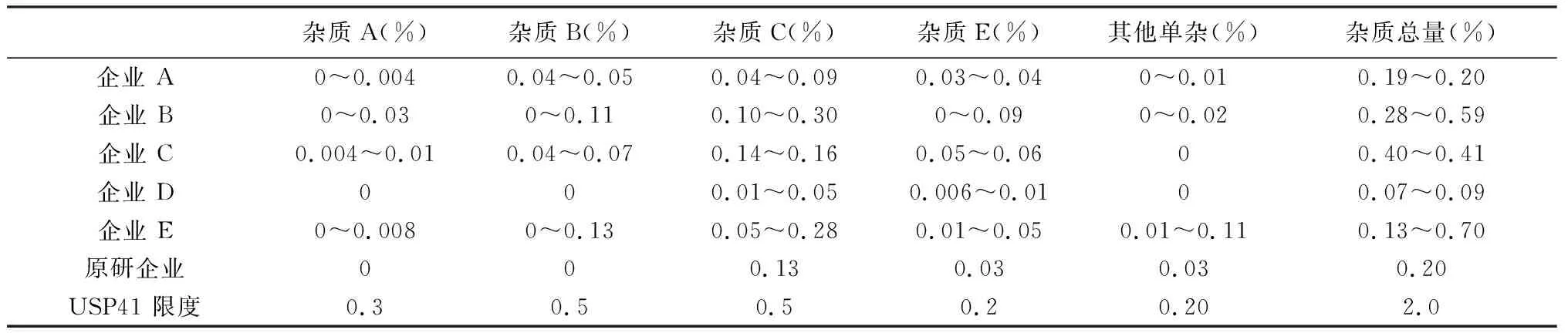
杂质A(%) 杂质B(%) 杂质C(%)杂质E(%)其他单杂(%)杂质总量(%)企业 A0~0.0040.04~0.050.04~0.090.03~0.040~0.010.19~0.20企业 B0~0.030~0.110.10~0.300~0.090~0.020.28~0.59企业 C0.004~0.010.04~0.070.14~0.160.05~0.0600.40~0.41企业 D000.01~0.050.006~0.0100.07~0.09企业 E0~0.0080~0.130.05~0.280.01~0.050.01~0.110.13~0.70原研企业000.130.030.030.20USP41 限度0.30.50.50.20.202.0
2.3 影响因素考察
2.3.1 温湿度影响试验 取6家企业样品放置在温度60 ℃ ,相对湿度75%的恒温恒湿箱中15 d、30 d,考察有关物质变化情况。结果见图4,6家企业样品总杂质均显著增加,在常温环境下,6家企业样品的总杂质均低于0.5%,但在高温高湿环境下杂质明显增多,其中C企业样品降解最为明显,杂质生成最多,30 d样品的杂质总量高达7.2%,是0 d的18倍。原研企业Lundbeck和国内D两家企业样品降解水平相当,杂质增加最少的为企业D样品,30 d杂质总量为1.7%,与企业C结果相差5.2%,由此可见不同企业样品受温湿度的影响程度不一样。
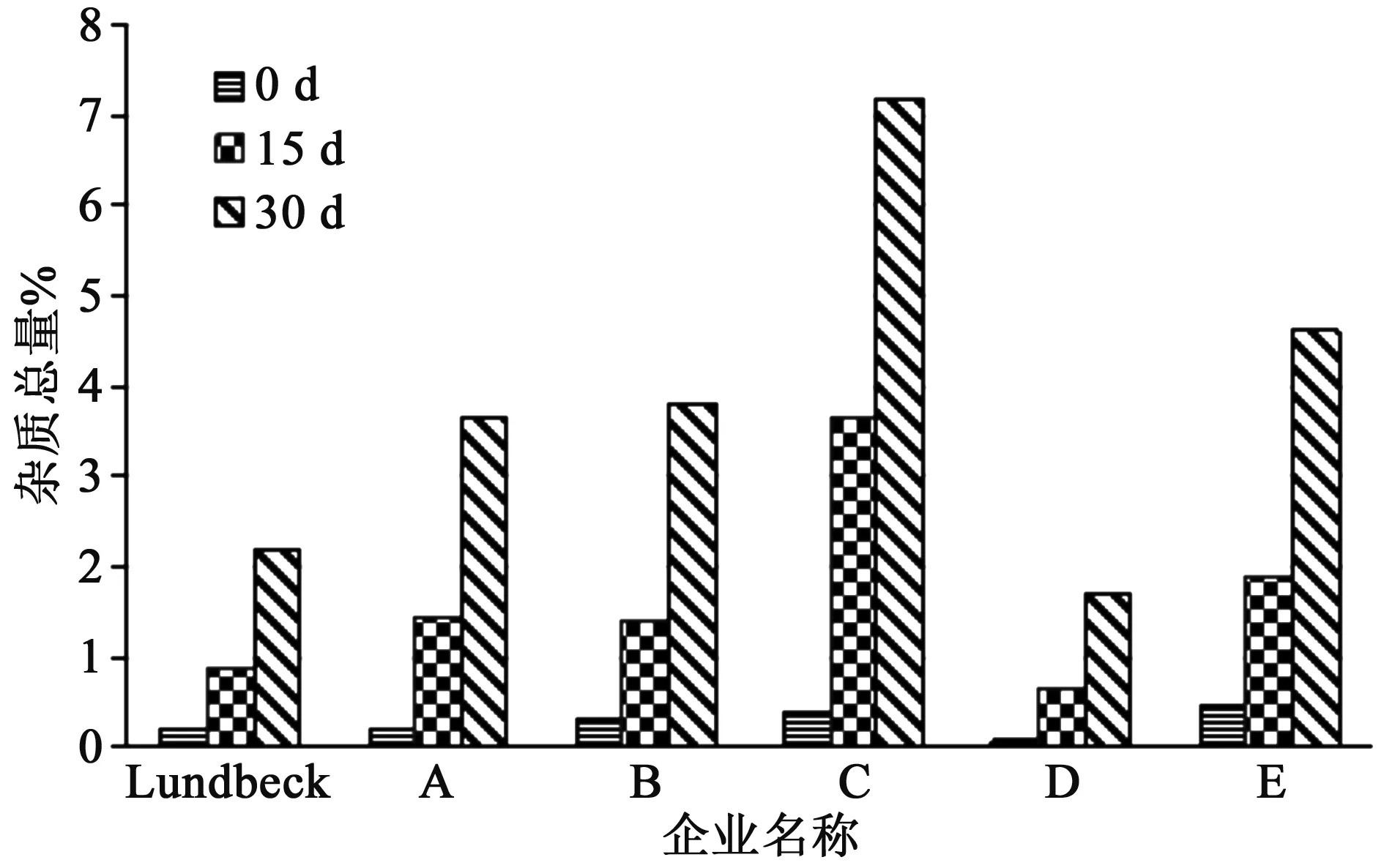
图4 温湿度试验结果
2.3.2 辅料相容性试验 参照《化学药物制剂研究基本技术指导原则》[7],用量较大的辅料(微晶纤维素MCC、淀粉、乳糖)按主药∶辅料=1∶5的比例混合,用量较小的辅料(二氧化硅、硬脂酸镁、羧甲基淀粉钠)按主药∶辅料 =20∶1的比例混合,并同时与同批号原料药一起放置在温度60 ℃,相对湿度75%条件下30 d,考察有关物质变化情况。结果见图5,微晶纤维素、二氧化硅、硬脂酸镁等辅料可明显加速样品降解,杂质总量增加显著。由此可见,辅料对有关物质有影响较大。
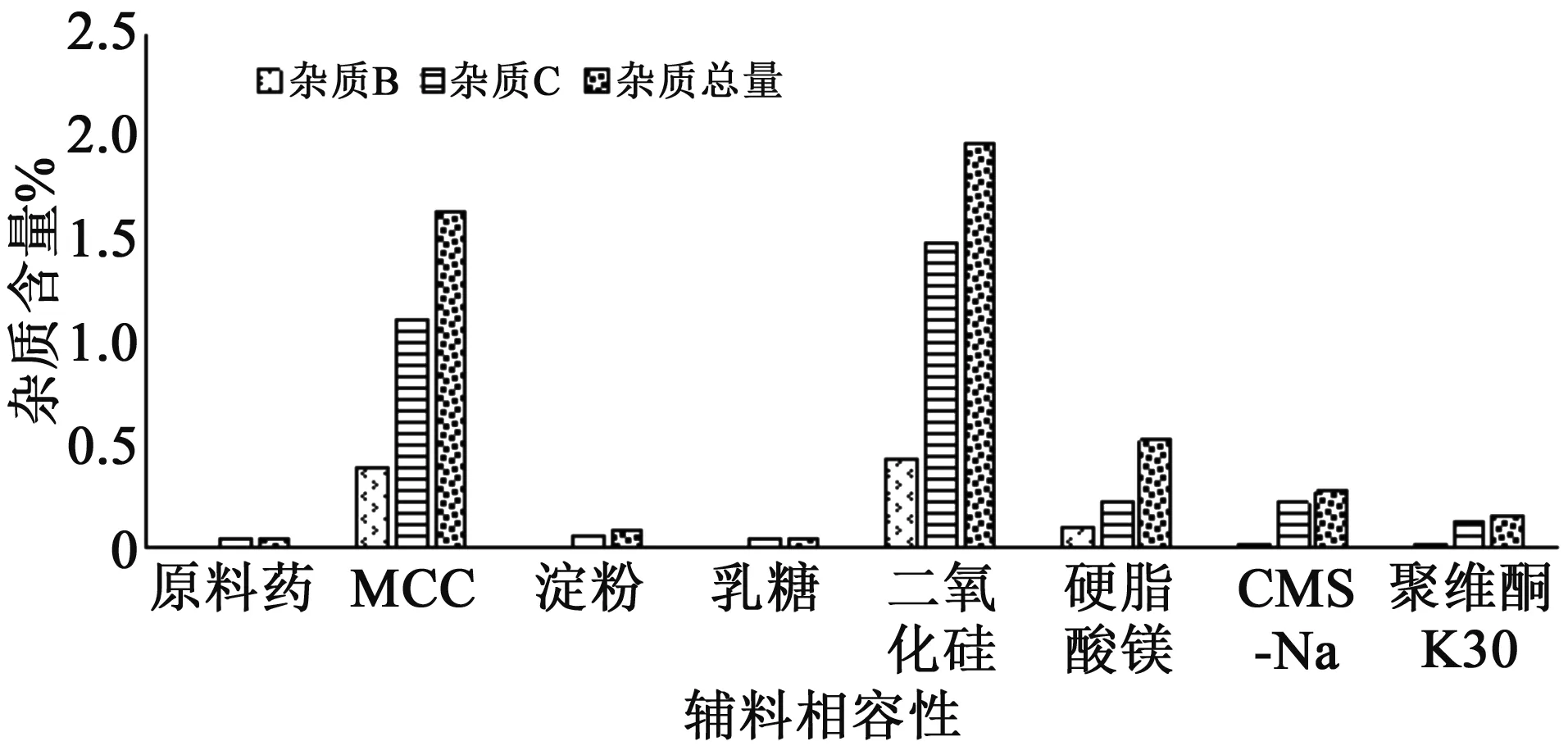
图5 原辅料相容性研究结果
2.3.3 包装材料性能比较 6家企业的包装材料有铝塑板、铝塑板加铝箔袋或内加干燥剂。取6家企业样品分别采用不带包装和带包装两种形式在温度60 ℃相对湿度75%试验条件下放置30 d,考察样品降解情况。结果见图6,在样品带包装时,E企业杂质最多,总量达到4.7%。除去包装后,6家企业样品均出现不同程度的降解,杂质明显增多,如C企业样品杂质总量是带包装样品的5.3倍,由此可见其包装材料对样品稳定性起到了良好的保护作用,包材阻隔性能好。而E企业不论包装与否,样品杂质均较大,其包装材料的阻隔性最差,从而呈现出不同企业间的包材质量具有较大差异。
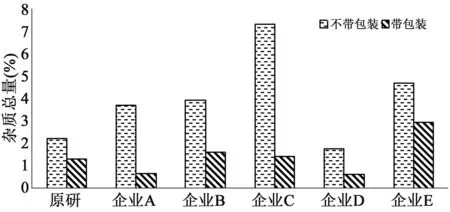
图6 包装材料性能比较
2.3.4 水活度测定 采用Novasina Lab Master水活度测定仪测定了52批样品的水活度,5家企业样品的水活度相差较大(见图7),其中E公司样品水活度高于其他4家企业,该企业样品在单杂和总杂上均高于其他企业。将水活度结果与杂质A、B、C、E和总杂质进行相关性分析。结果见表2,水活度与杂质B、杂质E和总杂质均具有相关性,且相关显著。由此可见,水活度是影响草酸艾司西酞普兰片有关物质的关键因素。
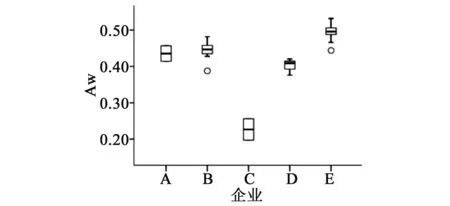
图7 水活度测定结果
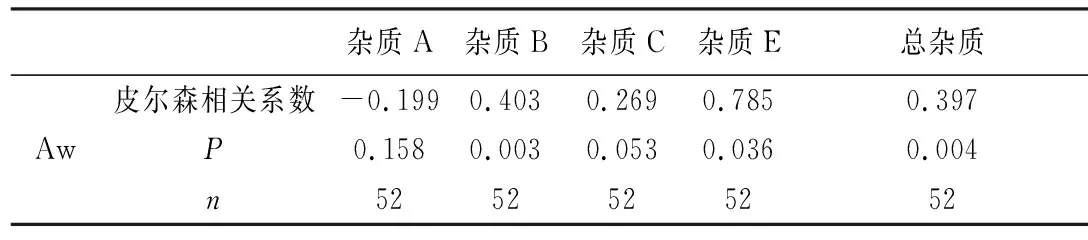
杂质A杂质B杂质C杂质E总杂质皮尔森相关系数-0.1990.4030.2690.7850.397AwP0.1580.0030.0530.0360.004n5252525252
注:P<0.05表示显著相关
3 讨论
3.1 比较国内5家仿制药和原研进口样品的有关物质发现不同企业间总杂质和单杂间差别较大,原研样品的总杂和单杂均较少,国内部分企业样品离散性大,样品批间差异明显,表现出国内的草酸艾司西酞普兰片质量参差不齐,部分企业质量亟待提高。
3.2 温湿度以及包装材料性能比较试验均表明水是影响草酸艾司西酞普兰片稳定性的关键因素。因此,在生产制备过程中需密切注意水的量,应降低生产环境的湿度和原辅料中的水分,防止原辅料受潮引发降解。储存过程中采用阻隔性能较好的包装材料或者在包装袋内添加干燥剂,使样品储存于较干燥环境中。
3.3 试验中原研Lundbeck和国内D两家企业样品的有关物质均处于较低水平,调研发现这两家企业均采用粉末直接压片法制备样品,其余4家企业为湿法制粒压片法。草酸艾司西酞普兰易受湿热影响,而粉末直接压片法没有湿法制粒、干燥过程,避免了药物受湿热影响,较少辅料的用量,更有利于药物稳定性[8],因此推荐草酸艾司西酞普兰片采用粉末直接压片法进行制备。
3.4 辅料相容性试验表明微晶纤维素、二氧化硅、硬脂酸镁等辅料均对草酸艾司西酞普兰产生不利影响,可引起主成分降解,使杂质明显增加。对上述几种辅料深入分析,微晶纤维素是一种多孔微粒组成的晶体粉末,吸水和保水能力强[9]。药用二氧化硅为具有吸湿性,能吸收大量水分而不液化[10]。硬脂酸镁比表面积大,具有极强的吸附作用和吸湿性[11]。这3种辅料均具有一定的吸湿性,在生产制备以及储存过程中均可吸收水分,从而对主药产生不利影响,引起主药降解。国内仿制企业的处方中均加入了微晶纤维素,而原研企业则采用了含2%微粉硅胶的微晶纤维素作填充剂,为提高药品稳定性,建议国内仿制药企业调整处方,减少使用微晶纤维素、二氧化硅、硬脂酸镁等易吸湿的辅料。

