国产口服苯唑西林钠的质量评价与影响因素分析
张斗胜,王晨,王立新,崇小萌,姚尚辰,许明哲
(中国食品药品检定研究院,北京 102629)
苯唑西林(Oxacillin)为国家基本药物目录药物[1],临床使用以注射剂、口服制剂为主;其中口服剂型包含片剂和胶囊。结构上通过异恶唑环取代、苯基和甲基引入等结构修饰,相比其他青霉素,苯唑西林不仅耐青霉素酶,而且对胃酸稳定;临床主要用于抗革兰阳性菌感染治疗[2-3]。尽管临床有更多抗生素选择,口服苯唑西林钠由于抗菌作用较强,价格较便宜,在基层医疗机构仍应用较广泛[4]。
通常口服药物经胃肠道崩解、释放、吸收等复杂生理过程,而良好的药品质量是保证临床疗效的首要前提条件[5-6]。目前,尚未见口服苯唑西林钠的系统质量评价报道。鉴于此,本文以2016年口服苯唑西林钠国家评价抽验为依据;在法定检验基础上,结合探索性研究,统计分析水分、装量、含量、崩解时限(溶出度)等重点质控项;探索研究杂质谱变化来评价本品质量现状以及可能的质量风险,分析影响本品的质量因素,为加强产品质量管理,进一步完善产品质量提供参考。
1 材料与方法
1.1 仪器与试剂 日本岛津LC-20A型液相色谱仪(SPD-M20A二极管阵列检测器);美国Waters 2690型液相色谱系统(Waters 996二极管阵列检测器);美国戴安U3000型液相色谱系统;美国AB-3200Q TRAP质谱仪(Analyst软件,Version 1.4.2);美国Agilent-RS8PLUS溶出度仪;美国赛默飞PE35紫外可见分光光度计。试剂:磷酸二氢钾、盐酸、氢氧化钠、氢氧化钾均为分析纯;甲醇、乙腈为色谱纯;水为纯化水。
1.2 样品 2016年国家药品评价性抽验共抽12批次样品,其中片剂9批次,涉及2家生产企业,企业及文号覆盖率100%;胶囊3批次,涉及1家生产企业,企业及文号覆盖率25%。苯唑西林钠对照品(批号:130482-201402,含量:90.0%)、氯唑西林对照品(批号:130423-200903,含量:91.0%),均由中国食品药品检定研究院提供。
1.3 试验方法
1.3.1 法定检验 2015年12月1日前生产的样品按国家药品标准WS-10001-(HD-1131)-2002(片剂)和WS-10001-(HD-0717)-2002(胶囊);2015年12月1日后生产的样品按《中国药典》2015年版(二部)[6]进行法定检验。
1.3.2 杂质谱研究 参考我室已发表文献[7],采用优化的液相质谱方法与《中国药典》2015年版(二部)[10]方法进行比较分析,建立适于苯唑西林钠口服制剂质控用杂质谱。
1.3.2.1 高效液相色谱(HPLC)条件 色谱柱为Capcell MG II C18柱(4.6 mm×250 mm,5 μm);0.02 mol·L-1磷酸二氢钾溶液(2 mol·L-1氢氧化钾溶液调解pH至6.6)为流动相A,甲醇为流动相B,梯度洗脱(0~32 min:69% A,32~37 min:55%A,37~50 min:65%A,50~51 min:31%A,51~65 min:69%A);检测波长:225 nm;柱温:30 ℃;流速:1.0 mL·min-1。
1.3.2.2 质谱(MS)条件 离子源:电喷雾(ESI)正离子化,喷雾电压:5 500 V;去簇电压(DP):49 psi;进口电压(EP):10 psi; 碰撞能(CE):8 eV;离子源温度(TEM):500 ℃ ;扫描范围(m/z):50~1 000。
1.3.3 崩解时限(溶出度)溶出度试验条件 照《中国药典》2015年版(二部)项下方法[8]。
1.3.4 溶液的配制
1.3.4.1 系统适用性溶液、对照品以及供试品溶液 照《中国药典》2015年版(二部)项下方法配制[7]。
1.3.4.2 强酸降解溶液 取对照品约10 mg,加2.7 g·L-1磷酸二氢钾(pH 5.0)-乙腈溶液(75∶25)5 mL使溶解,再加入1 mol·L-1盐酸溶液3 mL,放至室温,用1 mol·L-1氢氧化钠溶液调节pH至中性。
1.3.4.3 强碱降解溶液 取对照品约10 mg,加0.1 mol·L-1氢氧化钠溶液2 mL使溶解,室温放置1 min,再加2.7 g·L-1磷酸二氢钾(pH 5.0)-乙腈溶液(75∶25)7 mL,放至室温,用0.1 mol·L-1盐酸溶液调节pH至中性。
1.3.4.4 高温降解溶液 取苯唑西林对照品适量,置100 ℃烘箱内放置16 h,取出,放至室温,称取适量,照《中国药典》2015年版(二部)方法制备。
1.4 数据处理 采用Microsoft Excel 2010办公软件(美国微软公司)。
2 结果与讨论
2.1 总的检验结果 按照法定标准检验,9批苯唑西林钠片、3批胶囊结果均符合标准规定,合格率100%。进一步对主要检测项:水分、装量差异、含量测定结果作统计分析。
2.1.1 水分 分别以剂型、生产厂家为横坐标,以极差、均值和相对标准偏差(RSD)为纵坐标,对水分结果做统计图(见图1)。由图1可知:不同企业间以及同一企业的不同批间、批内差异均较大;企业2的片剂和胶囊的水分控制(RSD:8.8%、18%)较企业1差(RSD:6.7%),且1批胶囊水分值处在限度边缘(不得过6.0%);其反映了生产工艺和过程控制的优劣,是影响质量的关键因素之一。虽然按法定检验样品符合规定,但水分统计结果揭示出目前企业在水分控制方面仍存在的潜在质量风险;特别是对边缘产品,需要从原辅料质量、工艺合理性、工艺管理以及贮存运输等方面开展偏离分析以及风险评估报告;以进一步优化和改进工艺,降低质量风险。

图1 水分测定结果统计
2.1.2 装量差异 3批胶囊装量差异的RSD均小于2.5%;但对胶囊壳进行RSD分析发现,企业2生产的1批样品所用胶囊壳的RSD为3.5%,而其他2批次样品所用胶囊壳的RSD小于1.5%,尽管囊壳未造成产品不合格情况发生,但对工艺及过程控制来讲是个潜在质控风险点。
2.1.3 崩解时限(溶出度)检查 2家企业在的8批片剂样品崩解时限均符合规定(2015年12月1日前生产),企业2的3批胶囊和1批2016年生产的片剂,溶出度检查符合规定。研究提示:胶囊壳、糖衣片崩解程度与崩解速率是影响本品溶出的关键质量因素。
2.1.4 含量测定 分别以剂型、生产厂家为横坐标,以均值和相对标准偏差(RSD)为纵坐标,对含测结果做统计图,见图2。由图2可知:从整体看,2家企业产品含测均值在95.0%~102.0%之间,含量控制均较好;相比企业2,企业1的产品含测均值(101.5%)更接近理论中心值(100%),表明其投料控制更为精准、合理。
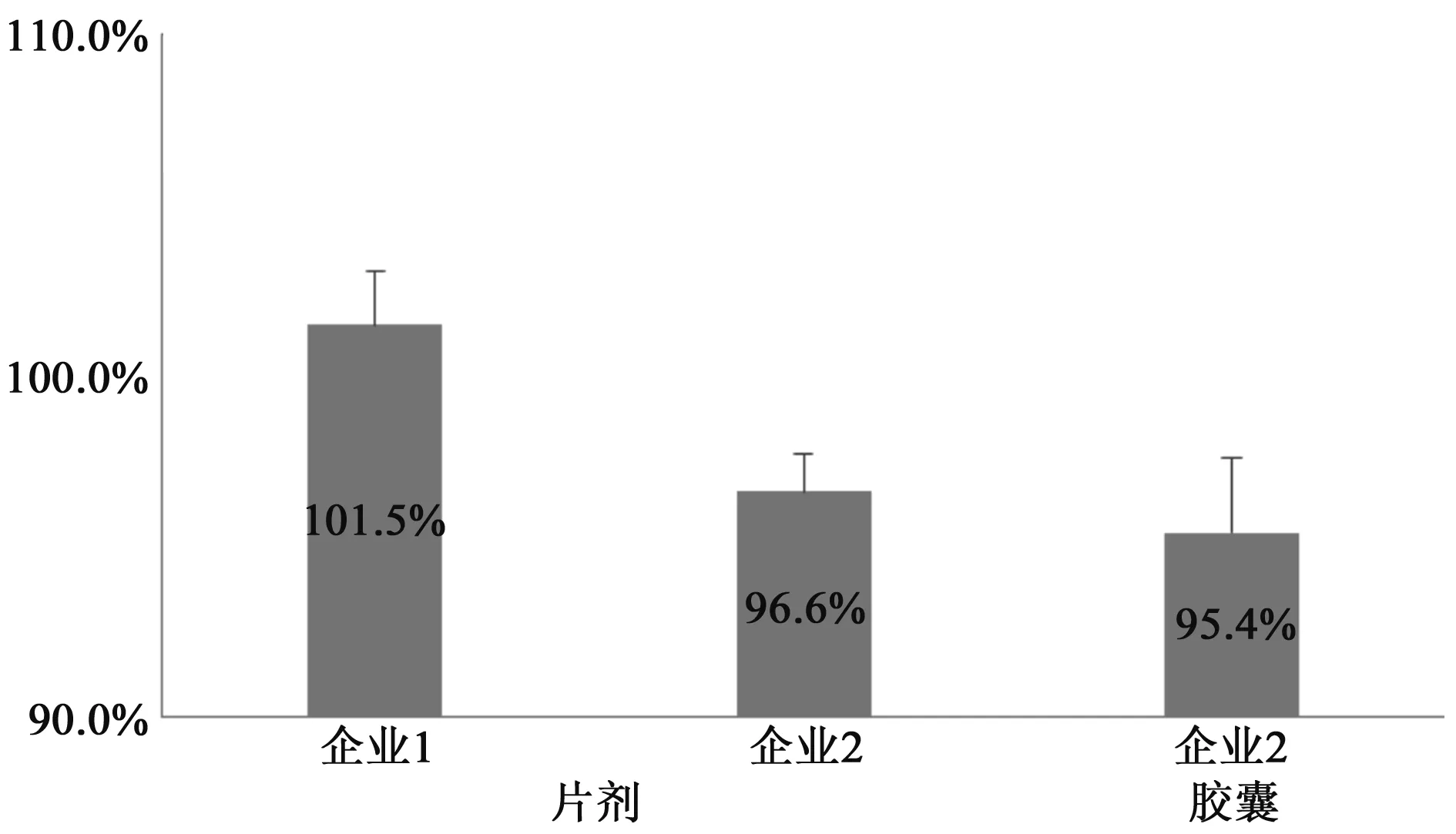
图2 含测结果统计
2.2 探索性研究结果 在法定检验基础上,为进一步评价国产苯唑西林钠片、胶囊的质量现状,从杂质谱方面开展探索性研究,探讨影响本品的关键质量因素。结合法定检验结果,通过与《中国药典》2015年版(二部)有关物质检查法相比较,系统评价分析方法并分析制剂工艺对杂质的差异性影响。
2.2.1 两种方法在制剂中分离效果比较 取系统适用性溶液和供试品溶液,分别采用优化后液相方法与《中国药典》2015年版(二部)方法进行比较分析,系统适用性试验结果见图3。
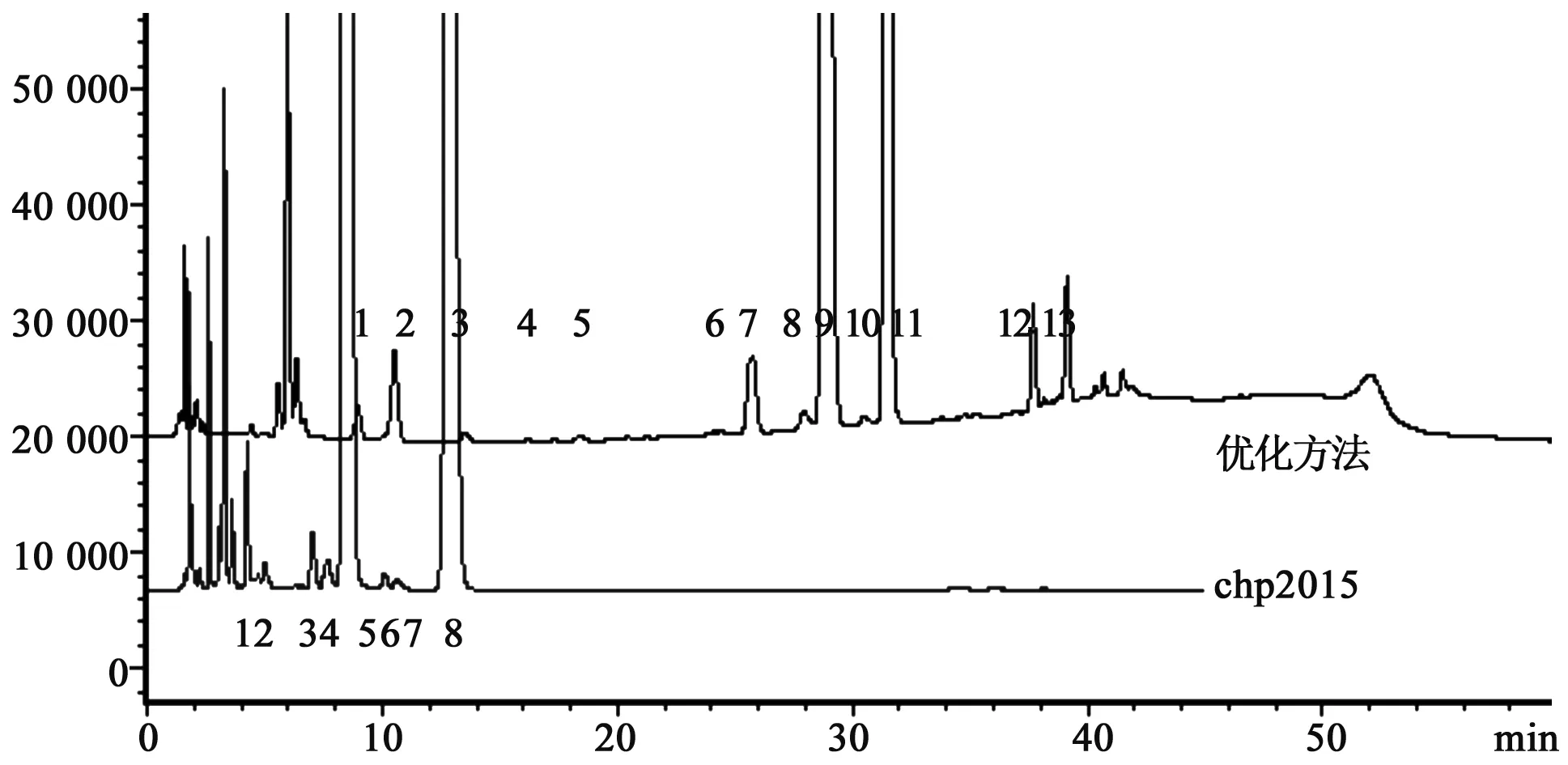
图3 系统适用性试验色谱图
如图3所示:虽然新优化方法与《中国药典》2015年版(二部)方法均可对系统适用性溶液有效分离;但新优化方法在杂质分离数,难分离杂质对的分离度改善方面更显出优势,专属性更好。供试品试验结果见图4。如图4所示:新优化方法可有效分离制剂中的各杂质。

图4 供试品色谱图
2.2.2 杂质归属 取系统适用性溶液,加速试验溶液以及供试品溶液,采用LC-MS分析,参考英国药典(BP2015)[9]初步推测苯唑西林钠(见图3)中所含杂质主要包括:苯唑西林噻唑酸及异构体、氯唑西林及异构体,开环及脱水物等杂质,且大部分可因酸、碱降解产生,详见表1。

表1 苯唑西林钠杂质归属
2.2.3 制剂中杂质检查结果 进一步按厂家、剂型对主要检出杂质进行统计分析,见图5。
如图5所示:不同厂家、不同批次产品检出结果差异较大,其中杂质D与单杂检出变化幅度范围较大,最大分别达0.4%和0.6%;是造成产品总杂质偏高的主要原因。2家企业生产的片剂和胶囊中含量较大的杂质均为杂质D和单杂。从现有检出情况可初步归纳出目前国产苯唑西林钠口服制剂的杂质谱概况:即国产苯唑西林钠口服制剂中主要检出杂质为杂质D和单杂;其中杂质D属于降解杂质,反映制剂工艺的优劣;杂质E为原料合成残留的氯唑西林杂质,反映原料质量的优劣;杂质D与杂质E作为指针杂质,用于评价和控制生产工艺及药品质量。
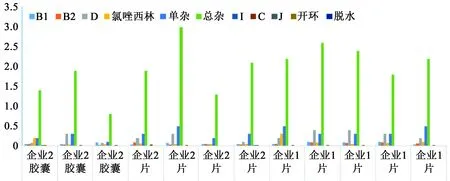
图5 制剂中杂质统计图
3 结论
综上分析,现行《中国药典》2015年版(二部)收载方法满足苯唑西林钠口服制剂质量控制需要。胶囊质量好于糖衣片,而主要检查项如水分、装量差异、有关物质在不同厂家、不同批次间差异较大;原、辅料质量及工艺水平是造成杂质谱差异变化的主要原因,是影响本品质量的关键工艺属性。提示生产企业应重视原、辅料质量,优化生产工艺,加强过程控制,提高产品质量。

