D-二聚体在女性恶性肿瘤病情监测中的应用价值
林颖欣 庞丹梅 胡 倩 段海波 李财枝
中山大学附属佛山医院(佛山市第一人民医院)乳腺肿瘤内科(佛山528000)
恶性肿瘤的发生与发展过程常常伴随凝血功能的紊乱,表现为患者凝血及纤溶功能异常激活和失衡。恶性肿瘤与凝血纤溶系统两者的相互关系日益受到广泛重视。D-二聚体(D-dimer, D-D)是交联纤维蛋白的特异性降解产物,其含量增高反映机体凝血和纤溶系统的激活。近年来研究发现,D-D含量与恶性肿瘤密切相关。本研究旨在通过分析女性恶性肿瘤患者化疗前后的D-D血浆浓度变化趋势,初步探讨D-D对辅助判断肿瘤病情和疗效观察的应用价值与诊断效能。
1 资料与方法
1.1 一般资料
选取2016年3月—2017年12月间在佛山第一人民医院乳腺肿瘤内科住院治疗的女性肿瘤患者共149例,进行回顾性分析。入组病例全部为女性。入组人群中位年龄为52岁(17~75岁),其中早期术后患者(术后组)58例,晚期复发转移患者(晚期组)91例。纳入标准:①经手术或组织活检病理学确诊;②术后组术后4周内,未接受过化疗;晚期病例未接受过一线挽救性化疗,有可按实体瘤疗效标准(RECIST 1.1)评价的病灶;③病历资料完整。排除标准:①合并第二原发肿瘤;②有明显出凝血功能异常疾病家族史的患者(如血友病);③合并深静脉血栓、肺栓塞、主动脉夹层等容易导致D-D水平增高的疾病;④合并终末期肝肾功能不全;⑤合并妊娠;⑥2周内发生过急性感染。具体病种分布见表1。根据各病种治疗指南制定辅助或一线挽救性化疗方案,挽救性化疗每2程评价疗效,有效者完成6程化疗,无效进展者出组。
1.2 研究方法
测定每例患者接受化疗前后的D-D水平,比较其治疗前后的变化,并发现D-D变化趋势与疗效的相关性。标本采集时间点:接受首次化疗前1周内、同方案末次化疗结束后2周内。血浆D-D测定采用酶联免疫荧光法,使用法国梅里埃VIDAS3_1全自动凝血功能仪及其配套试剂,严格按照说明书操作。
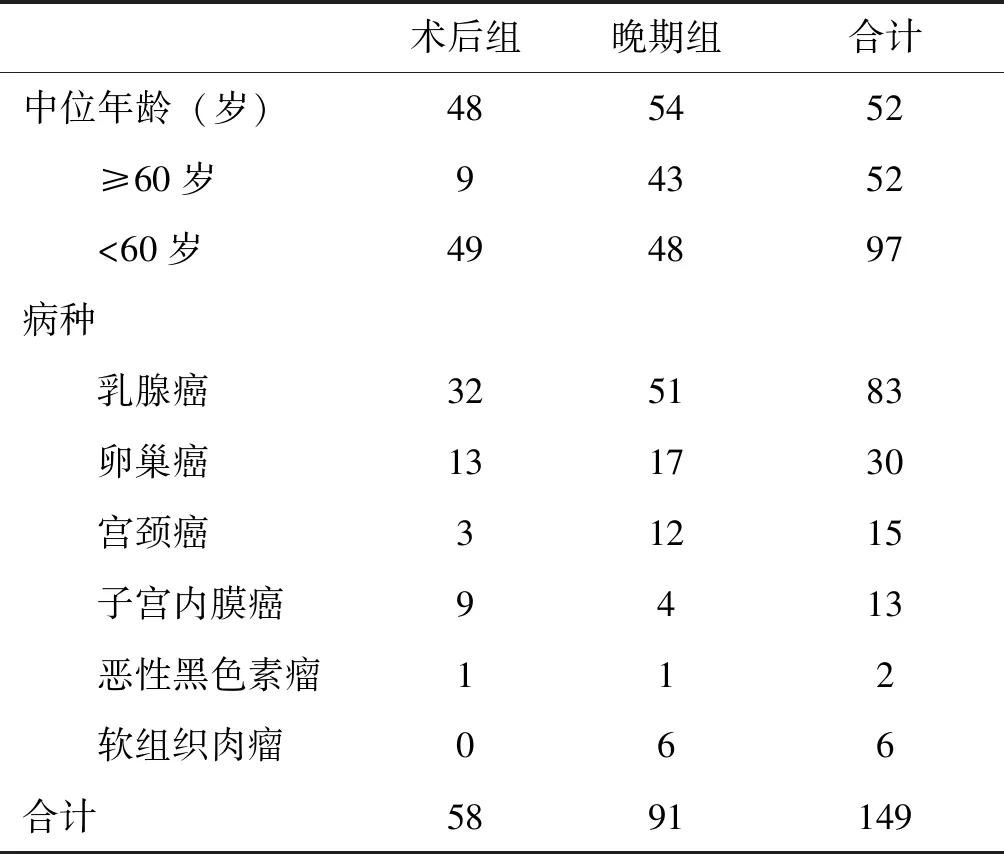
表1入组患者病种分布(例)
1.3 统计学方法
应用SPSS 22.0软件进行统计学处理。经Kolmogorov-Smirnov检验,D-D水平不符合正态分布,故计量资料用中位数(四分位间距)表示,治疗前后配对样本比较用Wilcoxon秩和检验,两组间独立样本比较用Mann-Whitney U检验,以Spearman法分析两组资料的相关性是否具有统计学意义。以一系列的数值为临界点,以每个临界点对应的敏感度为纵坐标,1-特异度为横坐标作图,建立ROC曲线。P<0.05表示差异有统计学意义。
2 结 果
2.1 术后组血浆D-D浓度变化
术后组患者化疗后血浆D-D水平(D2)为433.3(231.6,719.8)ng/mL,低于化疗前的水平(D1)642.5(368.8,1432)ng/mL,差值(ΔD=D2-D1)为-184.8(-887.2,- 4.035)ng/mL,差异有统计学意义(P<0.01,表2)。亚组分析,≥60岁组血浆D-D基础水平较<60岁组高(1 190 vs 608.9,P<0.05),化疗后两组水平均有下降趋势(P>0.05,差异无统计学意义),但≥60岁组D-D水平仍高于<60岁组(812.5 vs 340.7,P<0.05,见图1)。D1随年龄增长而升高,呈正相关(r2=0.356,P<0.01,见图2A)。接受化疗后D-D水平仍与年龄正相关(r2=0.389,P<0.01,见图2B)。

图1 术后组化疗前后血浆D-D浓度变化

表2术后组化疗前后D-D差值(ΔD=D2-D1)比较
注:*为P<0.05。
2.2 晚期组血浆D-D浓度变化
91例晚期患者,化疗后有33例出现病情进展(PD组),58例获得疾病缓解或稳定(非PD组)。PD组化疗前基线水平高于非PD组(P<0.01,图3),接受化疗后PD组D-D较基线水平升高(P<0.0001,见图4A),非PD组较基线水平下降(P=0.004 5,见图4B),PD组化疗后D-D水平高于非PD组(P<0.01,见图3)。亚组分析,≥60岁组血浆D-D基础水平与<60岁组相当(P>0.05),PD者D-D水平升高(P<0.05),非PD者下降(P<0.05),而不受年龄因素影响(P>0.05,见图3)。以ΔD、D1、D2诊断是否PD分别进行ROC分析,结果显示ROC曲线下面积(AUC)分别为0.860 3(95%CI:0.768 5~0.952 0)、0.674 0(95%CI:0.558 2~0.759 7)、0.895 6(95%CI:0.829 1~0.962 1),对诊断PD有一定准确性(见图5)。当ΔD<-145.4 ng/mL、D1>137 5 ng/mL、D2>103 3 ng/mL,Youden指数最大(见表3)。
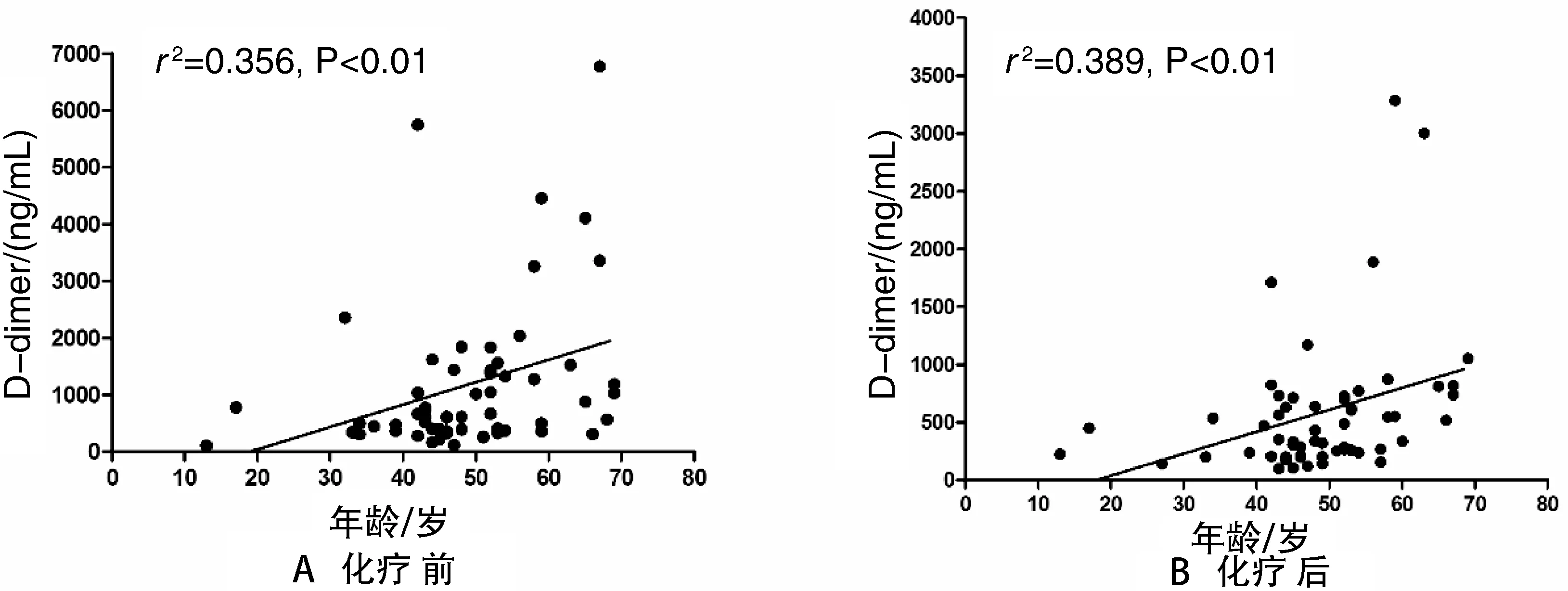
图2 术后组血浆D-D浓度与年龄相关性
3 讨 论
D-二聚体(D-D)是纤维蛋白单体经过ⅩⅢ因子交联作用后被纤溶酶水解所产生的一种特异性降解产物,其水平升高特异性反映体内高凝状态和继发性纤溶亢进,标志着机体凝血和纤溶系统的双重激活。恶性肿瘤患者均存在不同程度的凝血与纤溶功能异常,90%以上肿瘤患者的实验室检查提示凝血系统异常,尤其是血浆纤维蛋白原及D-D增高,与肿瘤高负荷有关[1]。肿瘤细胞与凝血系统相互作用,随着肿瘤细胞的生长扩散,患者体内凝血异常状态逐渐加重,同时激活的凝血系统又可以促进肿瘤的播散和转移[2-3]。伴有高凝状态的恶性肿瘤常常表现出巨大的瘤负荷,肿瘤进展活跃,化疗反应率低,以及最终预后差的临床特点[4]。因此检测肿瘤患者体内凝血功能可能间接反映肿瘤的生长状态。在肺癌、胰腺癌、结肠癌、乳腺癌、白血病等多种恶性肿瘤中均发现,D-D水平增高者生存期短,是独立的预后不良因子,不受年龄、静脉血栓栓塞症(venous thromboembolism,VTE)等因素影响[5- 6]。

表3 不同时点D-D浓度界值对PD患者的诊断价值

图3 晚期组各亚组化疗后血浆D-D浓度对比

图4 晚期组各亚组血浆D-D浓度变化对比

图5 D-D浓度对诊断PD患者的ROC曲线
恶性肿瘤引起D-D增高的机制尚未完全明确,可能与以下因素有关:肿瘤细胞会过表达组织因子,通过激活外源性凝血途径促进血液凝固,继发性激活纤溶系统[3];肿瘤患者抗凝和纤溶系统失衡,抗凝血酶活性下降,纤溶酶激活物在肿瘤组织中广泛表达;炎症反应是肿瘤发生与发展的重要环节,肿瘤微环境中炎症反应十分活跃,也会促进凝血系统的活化[7];肿瘤细胞高表达血管内皮生长因子,促进肿瘤细胞生长和增殖,加速激活纤溶系统[8]。本研究中,术后组D-D水平化疗前有“一过性升高”,可能是由于手术创伤等激活凝血系统及后继发血凝块溶解, 以及体内可能残留一定数量的肿瘤细胞,而引起血浆D-D暂时性升高。化疗后D-D水平较前下降,一方面可能由于体内残留的肿瘤细胞随化疗得到清除,另一方面手术创伤导致的血管内皮损伤愈合、血凝块基本吸收完成,于是凝血功能恢复“正常”。关于转移性乳腺癌、肺癌等肿瘤的多项研究发现,血浆D-D水平的变化在一定程度上反映肿瘤活跃程度,随病情变化波动。D-D水平升高往往预示着肿瘤的进展,D-D水平降低也客观代表肿瘤有所控制[9-10]。本研究中,晚期组也观察到类似现象。初诊时因肿瘤细胞对凝血功能的影响,大多数患者D-D水平升高;化疗后病情好转者,肿瘤负荷降低,原有肿瘤对患者体内凝血功能的影响解除,体内高凝状态得到了纠正,血浆D-D水平下降;而PD者则因肿瘤负荷增高,凝血异常进一步加重,D-D水平不降反升。这些结果提示血浆D-D水平与疾病转归有关,对恶性肿瘤疗效监测有一定的临床应用价值。
基于上述结果,若术后患者化疗后D-D下降不明显,是否更容易复发转移,D-D水平变化能否作为另一个预后预测指标,值得进一步研究。此外,抗凝治疗在一部分肿瘤中被证实具有抑制肿瘤生长转移的效果[11],甚至可改善肿瘤患者的生存[12]。我们对D-D水平持续较高的患者使用抗凝药物能否有助于纠正肿瘤与凝血系统之间的恶性循环,从而改善肿瘤患者预后,也是今后研究的方向之一。
年龄是影响D-D的常见因素,健康人群中老年人D-D水平较年轻人高。其可能机制:①老年人活动相对缺乏,体内血液流动缓慢,血管老化,凝血亢进而纤溶抑制,纤维蛋白水平较高,有形成血栓倾向;②D-D主要通过肾脏代谢,老年人肾功能下降,可能影响D-D代谢排出[13]。在本研究中,我们发现处于“无瘤”状态下的术后组患者,也符合上述规律。无论是化疗前或是化疗后的D-D水平,≥60岁组都明显高于<60岁组,而且表现出随年龄增长而升高的趋势,与年龄呈正相关,年龄越大,D-D水平越高。这表明当肿瘤负荷轻微时,年龄仍是影响D-D的重要因素。我们推断,这个阶段肿瘤细胞释放的促凝因子和炎症因子相对较少,不足以导致严重凝血系统异常,故对D-D的作用不如年龄相关因素明显。而处于“带瘤”状态的晚期组患者,肿瘤负荷大,肿瘤细胞释放的相关因子相对较多而持续,体内凝血异常状态与肿瘤播散转移反复相互作用,形成恶性循环,D-D水平因而增高,其作用比重甚至超越年龄因素。故而在本研究中可发现,当病情进展时,≥60岁组与<60岁组的D-D中位数水平并无明显差异,均较基线明显增高,年龄影响相对弱化,甚至年轻患者因肿瘤生长活跃,可能导致D-D水平更高;当病情缓解稳定时,肿瘤负荷降低,凝血异常状态有所改善,D-D水平也相应下降,两组的D-D差异不大,不受年龄影响。
在非肿瘤人群,D-D定量检测常用于VTE筛查和预防。根据文献报道及我院实验室数据,血浆D-D浓度在健康人群的参考上限为500 ng/mL,高于此值需警惕排除VTE、高龄、妊娠、术后、创伤、炎症、感染等引起D-D增高的病理和生理性原因。然而60%以上的肿瘤患者即使凝血功能检测正常,其D-D水平仍然会高于500 ng/mL[14],且可能随肿瘤负荷及治疗疗效相应变化。因此该阈值并不适用于肿瘤患者界定是否属于相对偏高水平,是否发生VTE等并发症,需要进一步探索总结出肿瘤患者的“特异性”参考范围,降低假阳性率。本研究分析了“无瘤(术后)”和“带瘤(晚期)”状态下恶性肿瘤患者的D-D血浆浓度变化趋势,为判断肿瘤预后提供了又一辅助参考指标。
从肿瘤因素对D-D影响的角度看,术后组化疗后的D-D水平可近似地看作恶性肿瘤患者病情稳定时的参考范围。通过分析ROC曲线,我们发现,化疗前基线D-D水平(D1)、化疗后D-D的下降程度(ΔD)、化疗后D-D水平(D2)均对晚期患者的病情转归有一定的诊断价值。尤其是ΔD和D2,AUC分别达到0.860 3、0.895 6,准确性较高,Youden指数最大的对应cut-off值分别为ΔD<-145.4 ng/mL、D2>1033 ng/mL。这意味着若化疗后D-D水平较基线下降少于145.4 ng/mL,或者经化疗后D-D水平仍达1033 ng/mL以上,则该晚期患者病情进展的可能性较大,预后欠佳,通过动态监测D-D水平变化有助于辅助判断疗效。此外,本研究中D1与疗效也有一定相关性,基线D1水平较高者化疗效果有可能不理想,尽管其AUC小于0.7,准确性不如ΔD、D2。有荟萃分析认为治疗前D-D高水平是PFS、OS的不良预后因素[15],这可与我们的结果相互印证。
本研究分析了术后和晚期女性恶性肿瘤患者化疗前后的血浆D-D水平变化,发现术后患者的D-D水平与年龄呈正相关,晚期患者的D-D水平则随病情转归而波动,血浆D-D的变化与肿瘤负荷密切相关,在监测病情与疗效观察中具有一定有临床应用价值;同时也初步探讨了恶性肿瘤患者D-D水平参考范围和诊断病情进展的cut-off值,评估D-D对肿瘤病情的诊断效能。由于本研究为回顾性分析,受入组样本量及性别限制,可能存在偏倚,尚需要大规模多中心的前瞻性研究和更长时间的随访来更加充分地评价D-D在肿瘤患者中的价值,并结合临床实践确定最佳的诊断分界点。

