外泌体源性miRNA-200b对糖氧剥夺/再灌注相关神经元损伤的影响
葛俊文 李红梅 张儒舫 沈 立
体外循环(cardiopulmonary bypass,CPB)下心脏手术创伤较大,且难以避免地会诱发脑缺血再灌注损伤,造成严重的早期或晚期中枢神经系统并发症,严重影响患者预后[1]。微小RNA(microRNA,miRNA)是一类进化上高度保守的单链非编码小分子RNA,由21~25个核苷酸组成,miRNA与靶基因mRNA分子的3′端非编码区域(3′-UTR)互补配对后,通过降低mRNA分子稳定性和翻译抑制参与靶基因表达调控[2]。其中miRNA-200家族包含5个成员,分成两组:①miR-200a、miR-200b以及miR-429;②miR-200c和miR-141[3]。miR-200家族在胚胎和神经发育中发挥重要的调控作用[4]。
外泌体(exosomes,Exo)是由细胞内多泡体与细胞膜融合后,释放到细胞外基质中的一种直径约40~150nm的膜性囊泡[5]。神经干细胞/祖细胞、神经元细胞、星形胶质细胞等大多数的中枢神经系统细胞均可形成及分泌外泌体[6]。外泌体完善了中枢神经系统细胞之间的交流网络。大量的研究表明外泌体及内含的miRNA在中枢神经系统疾病的发生、发展过程中发挥重要作用,可为中枢神经系统疾病的诊断和治疗提供参考价值[7, 8]。本研究中,笔者通过构建原代海马细胞糖氧剥夺再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)模型,探究外泌体miR-200家族成员对OGD/R脑损伤的影响。
材料与方法
1.材料:(1)实验动物(卡文斯实验动物有限公司)。(2)主要试剂与材料:FBS、DMEM培养基(美国Hyclone公司);BSA、1% Triton x-100、Hoechst33258(中国碧云天公司,C1011);二甲基亚砜(DMSO)、Trizol试剂(美国Invitrogen公司)、Total Exosome Isolation(美国Invitrogen公司,4478359)、BCA蛋白定量试剂盒(中国Biosharp公司,BL521A);SYBRGreen PCR试剂盒 (美国Thermo公司,F-415XL),反转录试剂盒(美国Thermo公司,#K1622);噻唑蓝(美国Sigma公司)、活性氧检测试剂盒(中国碧云天公司,S0063)、Annexin V-FITC/PI试剂盒(美国BD 公司,556547),pvdf膜(美国millipore公司,HATF00010)。
2.方法:(1)原代海马神经元细胞分离培养:参照文献[9]原代培养海马神经元并进行鉴定。新生SD大鼠,75%乙醇浸泡5min,无菌解剖,小心分离暴露海马区,以0.25%胰蛋白酶 37℃水浴消化15min。待组织块沉淀后吸取上清液至另外一个5ml离心管,1500r/min离心3min,将细胞接种至多聚赖氨酸包被的6cm培养皿中培养,按时半量更换培养液。(2)OGD/R模型:神经元细胞铺板培养好后,用PBS 洗涤细胞,换入新鲜glucose-free DMEM,参照文献[10],以5% CO2、95% N2、37℃缺氧孵育2h,然后将培养基换为无外泌体的完全培养基,常温常氧培养24h构建OGD/R细胞模型用于后续实验。(3)实验分组:分别提取OGD/R刺激前后及antagomiR-200b预处理后的海马细胞来源性外泌体:NC-Exo,OGD/R-Exo及antagomiR-200b+OGD/R-Exo。①antagomiR-200b转染步骤如下:按照使用说明制备RNA-Lipofectamine 2000复合物,加到10μl的Opti-MEM中,室温孵育20min,弃上清。PBS清洗细胞。每孔加入20μl RNA-Lipofectamine 2000复合物到96孔培养板中, 37℃ 5% CO2培养箱内培养6h后,吸掉上清液,加入100μl的完全培养基,于培养箱内培养24h。先转染再进行OGD/R处理;②收集各组细胞培养液,2000×g离心30min后滤膜过滤,去除凋亡细胞、碎片及大的粒子(外泌体的提取步骤参考说明书)。取上清,加1/2体积的Total Exosome Isolation,4℃过夜。将过夜放置后的样品10000×g,4℃离心1h。弃上清,根据沉淀的量加入适量的PBS重悬沉淀,即得外泌体。将提取的外泌体在电镜下进行形态观察并拍照,NTA技术检测外泌体直径,应用Western blot法检测外泌体表面标记分子CD63的表达;③取各组外泌体(100μg/ml)与正常海马细胞在常温、常氧条件下共培养24h,实验分组如下:A组:与NC-Exo共培养;B组:与OGD/R-Exo共培养;C组:与antagomiR-200b+OGD/R-Exo共培养。(4)实时PCR检测miR-200表达:按照Trizol试剂说明书提取外泌体及受体细胞中RNA。采用第一链cDNA合成试剂盒合成cDNA,使用TaqMan MicroRNA反转录试剂盒配制反转录体系,在PCR反应管中分别加入ddH2O、SybrGreen qPCR Master Mix、Forward primer、Reverse primer、cDNA模板,充分混匀。扩增条件:94℃ 10min,(94℃ 20s, 55℃ 20s, 72℃ 20s) 40个循环。以GAPDH为内参,2-ΔΔCT值评估miRNA的相对表达量,每组实验设置3个复孔。(5) MTT检测受体细胞增殖:将海马细胞调整细胞浓度为5×104个/毫升,接种于96孔培养板,与各组外泌体共培养24h后,以MTT比色法检测受体细胞增殖:每孔加入15μl的MTT,37℃ 5%CO2培养箱内培养避光孵育4h。吸净孔内的液体,加入200μl DMSO,室温于摇床震荡10min。酶标仪630nm波长测出同一时间点A值,用测得的A值进行细胞活性的分析。(6)DHE探针检测受体细胞内活性氧(ROS):用无血清培养基稀释DHE探针(1∶2000),37℃细胞培养箱中孵育细胞20min。每隔3~5min颠倒混匀下,使探针和细胞充分接触。用无血清培养基洗涤细胞3次,充分去除未进入细胞内的DHE。将细胞置于荧光显微镜下观察拍照,根据荧光信号强度分析ROS水平。(7)Western blot法检测凋亡相关蛋白:同上方法收集细胞。每组分别加入300μl的RIPA裂解液,并加入适量的PMSF,置于冰上裂解1h;12000r/min,4℃离心10min;移上清于新的EP管中,进行BCA蛋白质定量。10%SDS-PAGE电泳分离蛋白样品。PVDF转膜90min,恒流200mA。5%脱脂奶粉封闭液封存非特异性抗原结合位点,按抗体说明书加入Bcl-xl、Bcl-2、Bax和GAPDH一抗及相应二抗,ECL显色,暗室X胶片显影,拍照后进行条带灰度分析。
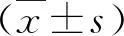
结 果
1.原代海马细胞的分离鉴定与OGD/R刺激:原代海马神经元细胞种板12h,大部分细胞可贴壁,少数细胞伸出1~2个突起。培养3天后,神经元突起进一步增多并延长,形成网格,胞体呈椭圆形,椎体形;海马神经元细胞OGD/R处理后存活率下降,出现胞体肿胀,胞膜不完整,核固缩,突起减少等形态变化(图1A)。免疫荧光结果显示细胞NSE的表达呈阳性,细胞纯度>90%,可用于后续实验(图1B)。

图1 原代海马细胞分离鉴定与OGD/R造模(×400)A.OGD/R刺激前后海马细胞形态(标尺50μm);B.海马细胞免疫荧光鉴定图
2.外泌体分离鉴定: Western blot法检测结果显示外泌体表面可表达CD63表面分子标志物(图2A);NTA技术检测外泌体的粒径分布,直径主要集中在70~80nm,平均直径为104.0±57.5nm(图2B)。在投射电镜下观察外泌体呈圆形或椭圆形囊泡状,可分散或聚集分布(图2C)。
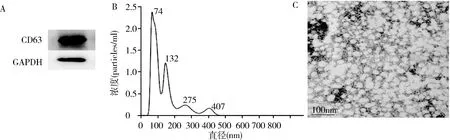
图2 外泌体提取与鉴定 A.外泌体表面特异性膜蛋白CD63表达;B.外泌体粒径分布;C.透射电镜下外泌体形态
3.OGD/R外泌体中miR-200家族表达上调,其中miR-200b最显著:与NC-Exo比较,OGD/R-Exo中miR-200家族成员均表达上调,其中miR-200b上调最为显著(P<0.01),故选择miR-200b进行深入研究;为进一步确定共培养后海马细胞内的变化,将所提取的NC-Exo、OGD/R-Exo和antagomiR-200b+OGD/R-Exo与正常海马细胞共培养24h,提取受体细胞内的miRNA,发现与A组(与NC-Exo共培养)比较,OGD/R-Exo使受体细胞内miR-200b表达显著上调(P<0.01);与B组(与OGD/R-Exo)比较,OGD/R刺激之前预先用antagomiR-200b处理海马细胞,此来源的外泌体使受体细胞内miR-200b表达下调(P<0.01,图3)。
图3 RT-PCR检测外泌体及共培养细胞内miR-200家族表达与A组比较,*P<0.01;与B组比较,#P<0.01
4.miR-200b高表达的外泌体导致受体细胞增殖抑制:MTT检测结果表明,与A组(与NC-Exo共培养)比较,OGD/R-Exo可抑制受体细胞增殖(P<0.01);与B组(与OGD/R-Exo共培养)比较,OGD/R刺激之前预先用antagomiR-200b转染海马细胞,此来源的外泌体可改善共培养细胞的状态,修复受损细胞(P<0.01,图4)。

图4 MTT检测外泌体共培养后细胞增殖情况与A组比较,*P<0.01;与B组比较,#P<0.01
5.miR-200b高表达的外泌体诱导受体细胞ROS水平升高:将miR-200b高表达的OGD/R-Exo与正常海马细胞共培养24h后,采用DHE探针检测受体细胞内ROS水平,结果可知与A组比较,OGD/R-Exo共培养后受体细胞内荧光强度增强,提示ROS的释放量增加;与B组比较,OGD/R刺激之前预先向海马细胞内转染antagomiR-200b,它所分泌的外泌体使共培养细胞内荧光强度减弱,提示此外泌体可逆转受体细胞内ROS水平升高(图5)。
6.miR-200b高表达的外泌体诱导受体细胞凋亡:与A组(与NC-Exo共培养)比较,B组抗凋亡蛋白Bcl-xl和Bcl-2表达减少,凋亡蛋白Bax蛋白表达增多(P<0.01);与B组(与OGD/R-Exo共培养)比较,antagomiR-200b预处理后的外泌体可使抗凋亡蛋白Bcl-xl和Bcl-2表达增多,凋亡蛋白Bax表达减少(P<0.01,图6)。
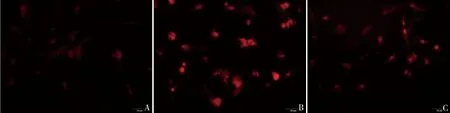
图5 共培养细胞内ROS水平荧光图像A.与NC-Exo共培养(A组);B.与OGD/R-Exo共培养(B组);C.与antagomiR-200b+OGD/R-Exo共培养(C组)
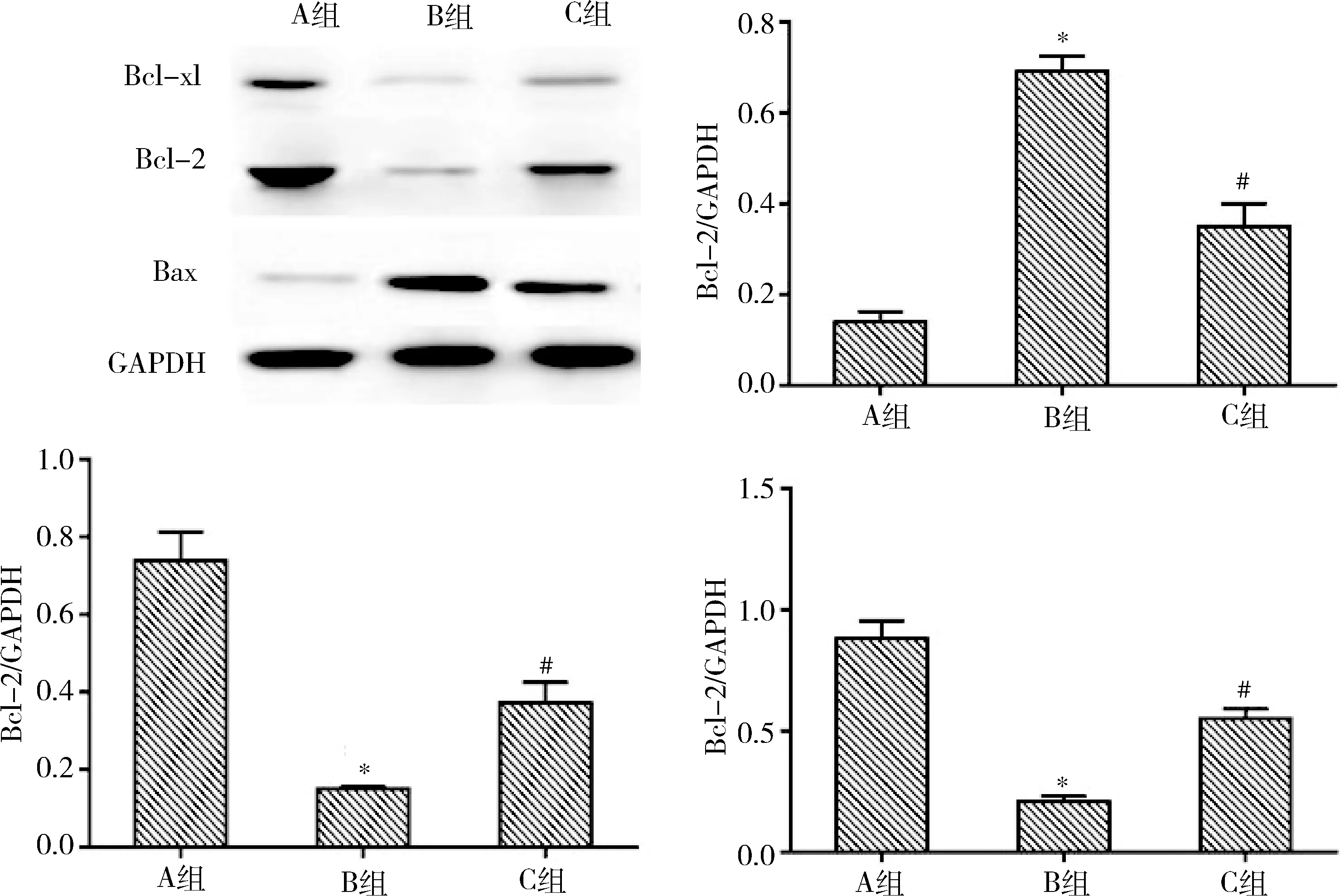
图6 共培养细胞内凋亡相关蛋白免疫印迹分析及蛋白定量与A组比较,*P<0.01;与B组比较,#P<0.01
讨 论
外泌体可由大部分细胞释放并存在于几乎所有体液中,作为细胞释放出来的囊泡,可以在相邻或远端细胞间递送miRNA、mRNA、非编码RNA、细胞蛋白等多种生物活性分子,介导细胞间物质交换并引起信号反应。细胞所释放的miRNA主要包裹于外泌体中,作为分泌分子影响受体细胞表型[11, 12]。研究发现外泌体在中枢神经系统的细胞交流网络发挥了重要的作用。神经元可分泌外泌体到脑实质中被邻近细胞内吞或释放到脑脊液中传输到其他部位[13];外泌体还可以到达突触间隙,被突触后或突触前神经元摄取,对突触的可塑性和神经元再生发挥调控作用[14]。由于多数中枢神经系统疾病损伤形成机制尚不明确,治疗手段相对匮乏,外泌体及其内含的miRNA研究成为了科研及临床研究的热点之一。
本研究分离培养原代海马细胞,并成功从其培养基中获得了外泌体, Western blot法鉴定特异性表面标志蛋白CD63阳性;外泌体直径集中在70~80nm,平均直径为(104.0±57.5)nm与目前大多数文献结果一致;投射电镜下观察其近似为圆形的囊泡。综合以上结果,证实所提取物为外泌体。
miRNA的调控作用几乎囊括了所有真核生物的基本生物学过程,其中miR-200家族可参与调控中枢神经系统的分化与增殖、神经存活和突触功能[15, 16]。miR-200家族在脑缺血、缺氧损伤方面也存在明显的表达差异。Stary等[17]发现在脑缺血损伤小鼠模型中抑制miR-200c的表达可降低脑损伤程度。笔者前期研究发现,在缺氧/复氧HT-22细胞模型中可观察到miR-200家族表达上调,抑制miR-200家族表达可以通过减少ROS的产生降低缺氧/复氧导致的神经元细胞死亡[18]。阿尔兹海默病患者及动物模型相关脑区miR-34a高度表达,miR-34a高表达外泌体被邻近神经元细胞摄取后,受体细胞内出现β-样淀粉蛋白形成与沉积[19]。星形胶质细胞感染HIV Tat后,它所分泌的外泌体内miR-29b含量增加,神经元细胞摄取该外泌体后,细胞内miR-29表达上调并导致细胞凋亡和坏死,干预外泌体的形成可逆转这一过程[20]。本研究中,笔者成功构建海马细胞OGD/R模型,发现OGD/R刺激后海马细胞内miR-200b表达显著上调,将miR-200b高度表达的OGD/R-Exo与正常海马细胞共培养,受体细胞内miR-200b表达显著增加,以antagomiR-200b预处理后,受体细胞内miR-200b表达下调。这些结果提示神经元之间可通过外泌体转运损伤相关的miR-200b,这与多数文献报道的外泌体RNA传递作用一致。
缺血/再灌注损伤是CPB的主要病理生理之一,组织器官在缺血/再灌注之后产生大量的自由基,过量自由基可以与核酸、脂质和蛋白质反应并最终导致细胞凋亡和坏死。OGD/R-Exo与正常海马细胞共培养后,受体细胞出现增殖受抑和胞内ROS增多;antagomiR-200b+OGD/R-Exo可使共培养细胞内ROS水平恢复。Bcl-2、Bcl-xl和Bax分别是主要的抑制凋亡和促进凋亡蛋白,通过检测Bcl-2、Bcl-xl与Bax的表达量可以反映出细胞凋亡情况[21]。共培养之后,受体细胞内Bcl-2、Bcl-xl水平降低,Bax水平升高;而以antagomiR-200b抑制miR-200b高表达外泌体的形成则可逆转这一过程,提示神经元之间可能通过外泌体miR-200b进行损伤“毒性”的散布,进而促进OGD/R相关损伤形成与发展。
综上所述,外泌体可以通过转运miR-200b传播OGD/R神经元细胞损伤信息,介导细胞损伤,促进OGD/R相关脑损伤形成。但是,本研究仅分析了外泌体miR-200b在OGD/R细胞模型中的作用,今后将纳入其他miR-200家族成员,深入探讨外泌体miRNA在体外循环脑损伤中可能的机制。

