MTH1蛋白与结肠癌进展和预后的相关性研究
刘腾辉 李 瑾 张 禾 田馨园 蔡剑平
结直肠癌是全球发生率第3位、病死率第4位的恶性肿瘤,肿瘤的侵袭、转移是导致患者死亡的主要原因,其发生、发展机制仍未完全明了。结直肠癌的主要治疗方法是以手术为主的综合治疗,包括新辅助放射治疗和辅助化学治疗,以及靶向治疗等。目前的研究表明DNA、RNA和蛋白质等大分子物质已成为靶向药物研发及肿瘤靶向治疗的关键[1]。
生物体细胞在正常生长发育过程中会受到内外环境因素的刺激产生大量的活性氧 (reactive oxygen species, ROS),对DNA、RNA和游离核苷酸造成氧化损伤[2]。在已检测到的20多种的氧化碱基中,鸟嘌呤(guanine, G)因具有最低的氧化电势易被羟自由基氧化生成8-氧化鸟嘌呤(8-oxo-7,8-dihydroguanine,8-oxoG)[3]。8-oxoG可以与腺嘌呤(adenine, A)发生错误配对,其效率几乎等同于正常配对的胞嘧啶(cytosine, C)[4~6]。因此,8-oxoG的错配可以导致DNA复制、转录及蛋白质翻译的错误。哺乳动物中的MutT 同源蛋白1可以降解含有8-oxoG的核苷酸,包括8-oxo-dGTP和8-oxoGTP,从而保证复制和转录的正确性[6,7]。
多项研究证明MTH1蛋白在胃癌、肺癌和食管鳞癌等肿瘤中表达量增加[8~10]。本研究笔者以结肠癌临床标本为模型,研究了MTH1蛋白在结肠癌组织中表达情况,分析其表达量与临床病理特征之间的相关性,探讨其对结肠癌患者预后判断的价值。同时利用结肠癌细胞株初步探索了MTH1蛋白在结肠癌发展中的作用及机制。
材料与方法
1.材料:(1)细胞株及培养基:人胚胎肠黏膜细胞CCC-HIE-2、人结肠癌细胞株HCT116、SW620和LoVo(中国医学科学院基础医学研究所基础医学细胞中心);人结肠癌细胞株SW480、Colo320和T84(美国ATCC);DMEM、IMEM、F-12K、L15、 RPMI-1640培养基、胎牛血清、0.25%胰蛋白酶-EDTA消化液(美国Gibco公司)。(2)引物及寡核苷酸的合成:针对MTH1的siRNA委托广州市锐博生物科技有限公司合成,其靶序列为siMTH1:5′-CGACGACAGCTACTGGTTT-3′;MTH1及GAPDH基因实时荧光定量PCR扩增引物由北京天一辉远生物科技有限公司合成,引物序列为:MTH1上游引物: 5′-CTCAGCGAGTTCTCCTGG-3′;MTH1下游引物: 5′-GGAGTGGAAACCAGTAGCTGTC-3′;GAPDH上游引物: 5′-CCTCTCCAGAACATCATCC-3′; GAPDH下游引物: 5′-GTGTCGCTGTTGAAGTCAG-3′。(3)实验试剂及仪器:结直肠癌组织芯片(HCol-Ade180Sur-07,上海芯超生物科技有限公司);兔抗人MTH1多克隆抗体(英国Abcam公司);鼠抗人GAPDH抗体、羊抗兔辣根过氧化物酶标记二抗、抗体稀释液、DAB显色液(北京中杉金桥生物技术有限公司);TRIzolTMReagent(美国Life Technologies公司);TransScript One-Step gDNA Removal and cDNA Synthesis Super-Mix(北京全式金生物技术有限公司);TanonTMHigh-sig ECL Western blot Substrate、Tanon 5200化学发光图像分析系统(上海天能科技有限公司); Transwell 24孔小室、基质胶Matrigel Matrix(美国Corning公司);纤维粘连蛋白(美国Sigma-Aldrich公司);RIPA普通型裂解液(北京索莱宝科技有限公司);去铁胺甲磺酶盐、DEPC水(美国Sigma-Aldrich公司);PierceTMBCA Protein Assay Kit(美国Thermo Fisher公司);Nikon80i正置荧光显微镜(日本尼康株式会社);普通PCR仪(美国AB公司)、定量PCR仪SmartCycler(美国Cephield公司)。(4)其他常规试剂均来自北京化学试剂公司。
2.方法:(1)结肠癌组织芯片免疫组化:结肠癌芯片脱蜡后、以枸橼酸缓冲液加热煮沸进行抗原修复,PBS清洗3次,滴加3%H2O2工作液消除内源性过氧化物酶影响。PBS清洗后以进口山羊血清封闭液封闭30min,1∶300稀释兔抗人MTH1抗体4℃孵育12h。PBS缓冲液清洗3次,用山羊抗兔IgG/HRP 聚合物室温孵育20min,DAB显色液显微镜下观察显色。苏木素复染15s合并1%盐酸酒精分化2s,中性快干胶封片。(2)组织芯片统计学方法:由两位经验丰富的病理科医生对MTH1染色的结肠癌组织芯片(包括87例癌组织和癌旁组织)进行染色强度和染色面积评分。对于染色强度:无染色计0分、轻度染色计1分、中度染色计2分、重度染色计3分;染色面积:0~25%计1分、25%~50%计2分、50%~75%计3分、75%~100%计4分。最终得分是染色强度×染色面积,其中,乘积低于7为MTH1表达量低,乘积高于7为表达量高。(3)结肠癌细胞中mRNA检测:于6孔板中培养结直肠癌肿瘤细胞HCT116、SW480、SW620、LoVo、COLO320和T84及人胚胎肠黏膜细胞CCC-HIE-2,待细胞密度达到80%~90%时,弃培养基并用PBS清洗两遍,于每孔加入1ml Trizol试剂提取总RNA,紫外分光光度计检测浓度后取1μg总RNA作为模版,反应体系及条件:将RNA模版、引物与RNase-free Water混匀,65℃反应5min,以提高合成效率。加入2× TS Reaction mix、Transcript RT/RI Enzyme mix和gDNA Remover并混匀,分别25℃ 10min,42℃ 15min及85℃ 5s合成cDNA并去除gDNA。以cDNA为模版,加入实验室合成的引物及2×Transtart TOP/TIP Green Qpcr SuperMix,95℃作为变性条件。定量PCR仪SmartCycler检测荧光信号。数据分析以GAPDH为内参,计算MTH1的相对表达量。(4)结肠癌细胞中蛋白质检测:RIPA裂解液裂解6孔板中培养的结肠癌肿瘤细胞及人胚胎肠黏膜细胞,4℃ 12000×g离心20min,取上清液。经BCA蛋白定量试剂盒定量。取20μg总蛋白120V恒压下进行12%SDS-PAGE电泳,260mA恒流2h转移至PVDF膜,后以5%脱脂奶粉封闭2h,1∶1000稀释的兔抗人MTH1和鼠抗人GAPDH抗体4℃孵育12h。TBST清洗5次后室温孵育1∶2000稀释的羊抗兔及羊抗鼠二抗1h,TBST洗液清洗3次后,使用TanonTMHigh-sig ECL Western blot Substrate配合X线片曝光检测。(5)用siRNA针对MTH1基因瞬时干扰肿瘤细胞:转染前12h于12孔板内铺细胞HCT116(1×105个/孔)、LoVo(2×105个/孔),先将无血清培养基与RNA-MAX混合,室温放置5min。待siRNA与无血清培养基混合均匀。将上述RNA-MAX与siRNA混合均匀,室温放置15min后,加入无抗生素的培养基于37℃培养箱培养。每种细胞各转染3个孔作为重复,并设立3个无siRNA阴性对照。转染72h后,提取总蛋白,用Western blot法检测敲减效果。(6)细胞增殖能力验证:转染前12h于24孔板内铺细胞HCT116(5×104个/孔)、LoVo(1×105个/孔),转染细胞。37℃培养24h后,胰酶消化重悬细胞并于96孔板内铺细胞HCT116(5×103个/孔)、LoVo(1×104个/孔),各重复6孔。分别培养24、48、72和96h后,于相应时间点每孔加入10μl CCK试剂,37℃孵育1h,Tecan GENios 多功能酶标仪检测450nm吸光度值。(7)细胞迁移及侵袭能力验证:在Transwell小室外侧底部滴加50μl浓度为10μg/ml 的纤维粘连蛋白,并使其均匀覆盖小室底部,在超净台放置2h使其自然晾干。用冷的无血清培养基将提前冰上融化的Matrigel稀释至浓度为200μg/ml,充分吹打混匀后吸取100μl,加入经纤维粘连蛋白预处理的小室,放入37℃培养箱4h备用(细胞迁移不需加入Matrigel)。胰酶消化瞬时敲减MTH1的HCT116及LoVo细胞,并使用无血清培养基重悬细胞、计数。于24孔板中加入700μl含20%FBS的培养基,将纤维粘连蛋白及Matrigel预处理的小室(细胞迁移只需使用经纤维粘连蛋白预处理的小室)放入其中,小室内侧分别加入浓度为2.5×105/ml的HCT116及浓度为5×105/ml的LoVo各200μl,吹打混匀,37℃孵育48h。后吸弃小室内培养基,PBS清洗2次,将小室放入4%多聚甲醛中固定30min。PBS清洗2次后,以1%结晶紫染色1h,PBS清洗3次后,用棉签轻轻拭去小室内侧底部细胞。显微镜下观察小室外侧底部细胞,在200倍镜下随机选取10个视野进行计数后求得平均值。
3.统计学方法:应用SPSS 19.0统计学软件对数据进行统计分析,独立样本t检验比较两组均值。Spearman等级相关系数评价MTH1基因mRNA 和蛋白表达的相关性。Log-ranktest比较两组总的生存率 (overall survival, OS)。COX比例回归风险模型明确CRC临床病理参数和MTH1蛋白表达对CRC患者生存率和预后的影响,所有参数先进行单因素分析,具有显著意义的参数再进行多因素分析,以P<0.05为差异有统计学意义。
结 果
1.结肠癌组织中MTH1蛋白的表达:免疫组化结果显示,癌旁正常组织MTH1蛋白免疫染色强度很弱,肿瘤组织染色呈现轻、中、重不同程度的分级(图1)。87例癌组织中高表达54例,低表达33例。应用log-rank检验比较MTH1高表达组和低表达组的生存率,结果显示MTH1高表达组生存率更低(P=0.005)。应用COX比例风险回归模型对临床资料和MTH1进行多因素统计发现,MTH1表达量是患者预后的影响因素(HR=2.256,95% CI:1.008~5.049,P=0.048)。
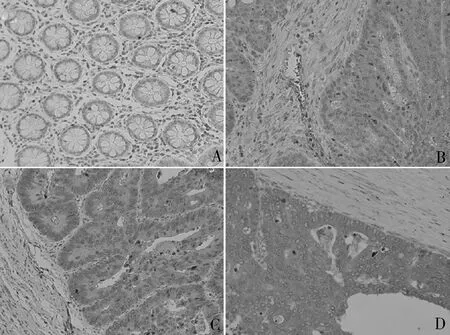
图1 结直肠癌组织芯片MTH1染色代表性图片(×200)A.癌旁正常组织;B~D.不同染色程度的结肠癌组织
2.结肠癌细胞株中MTH1基因mRNA和蛋白质的表达:如图2B所示,肿瘤细胞中MTH1基因mRNA表达量高于正常的肠上皮细胞。独立样本t检验分析表明肿瘤细胞中MTH1基因mRNA表达显著增加(P<0.05)。Western blot法检测结果表明肿瘤细胞中MTH1蛋白表达同样显著高于正常肠上皮细胞(独立样本t检验,P<0.05,图2中A、C)。Spearman相关性分析结果显示这些细胞株中MTH1基因mRNA表达水平与蛋白表达水平具有显著相关性(P=0.000),表明MTH1基因表达主要在转录水平进行调节。

图2 结肠癌细胞株中MTH1基因mRNA和蛋白的表达A.Western blot法检测细胞株中MTH蛋白表达水平;B.实时荧光定量PCR检测细胞株中MTH1基因mRNA表达水平;C.MTH1蛋白相对定量结果;与CCC-HIE-2比较,*P<0.05
3.细胞增殖实验:瞬时敲减后HCT116和LoVo细胞中MTH1蛋白表达水平明显下降(图3A)。CCK实验表明MTH1低表达导致HCT116和LoVo细胞活力显著下降,细胞增殖能力下降(P<0.05,图3中B、C)。
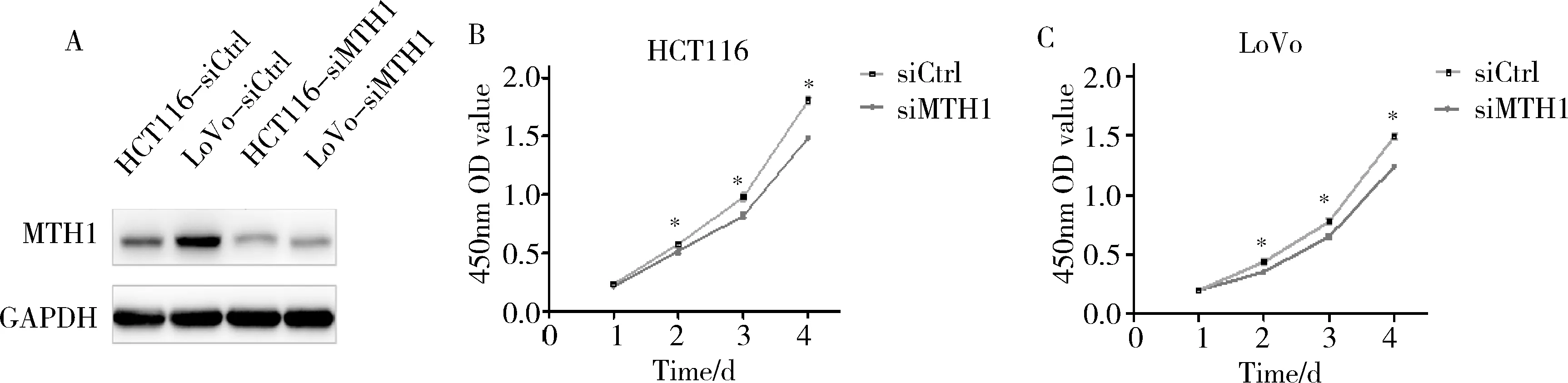
图3 CCK检测siMTH1敲减后HCT116和LoVo细胞活力A.Western blot法验证细胞株敲减效果;B、C. siMTH1组和对照组细胞增殖曲线;与siCtrl比较,*P<0.05
4.细胞侵袭及迁移实验:在显微镜下观察和计数Transwell小室外侧底部细胞(图4),与对照组细胞比较,HCT116和LoVo细胞敲低MTH1后,小室外侧底部细胞明显减少。独立样本t检验分析表明敲减MTH1后,结肠癌细胞的迁移和侵袭能力显著下降(P<0.05,图5)。
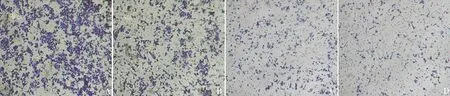
图4 siMTH1敲减后HCT116和LoVo细胞迁移和侵袭能力代表性结晶紫染色图(×40)
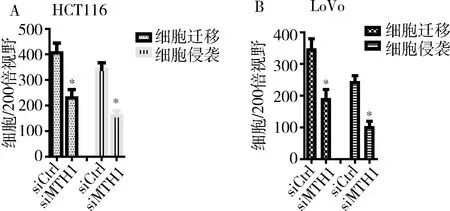
图5 Transwell检测siMTH1敲减后HCT116和LoVo细胞迁移和侵袭能力A.siMTH1组和对照组的HCT116细胞每200倍视野下细胞数;B.siMTH1组和对照组的LoVo细胞每200倍视野下细胞数;与siCtrl比较,*P<0.05
讨 论
1992年关口睦夫等发现 MutT蛋白可以降解DNA合成时一种致突变的底物8-oxo-dGTP阻止复制错误[6]。1997年关口睦夫等与法国M.Radman教授合作,证明了大肠杆菌MutT蛋白不仅可以分解核苷酸池中引起8-oxo-dGTP,也可以分解核苷酸池中8-oxoGTP,从而阻止这一变异原性物质在转录水平结合到RNA上[7]。与大肠杆菌比较,哺乳动物细胞中拥有更为精密机制参与核苷酸池中氧化核苷酸的清除,这一类蛋白命名为Nudix水解酶或MutT同源蛋白。目前研究最多是MTH1蛋白,很多肿瘤组织的发生、发展过程中均出现了MTH1蛋白的异常表达,例如大肠癌、胃癌、肺癌、乳腺癌、卵巢癌等肿瘤组织中MTH1 mRNA或蛋白的表达量明显高于癌旁组织或正常组织[8,9,11~13]。
本研究发现结肠癌细胞株和结肠癌组织中MTH1表达量显著增加,MTH1高表达患者总的生存率降低,MTH1高表达是患者低生存率的独立预测因素。更重要的是,进一步研究证明MTH1低表达导致HCT116和LoVo细胞活力、迁移和侵袭能力下降,提示MTH1高表达对癌细胞的生长和侵袭发挥重要作用。
早期研究发现,在MutT缺陷大肠杆菌中表达 MTH1基因的cDNA 可显著降低大肠杆菌自发突变率以及变异蛋白质的产生;在哺乳动物293T细胞中敲减 MTH1后加入外源性8-oxo-dGTP增加了 A:T 到 C:G颠换突变[14]。近年来,Thomas Helleday等将MTH1小干扰RNA分别导入肿瘤细胞和正常细胞,发现肿瘤细胞DNA损伤增加和存活率降低,而正常细胞无明显变化[15]。笔者所在实验室前期研究证明在结直肠癌组织中DNA和RNA氧化水平显著高于癌旁组织。本研究显示AJCC分期Ⅲ+Ⅳ期的结肠癌中MTH1表达高者更多,有淋巴结转移的结肠癌中MTH1表达高者更多;敲低MTH1可导致结肠癌细胞生长、迁移和侵袭能力下降;MTH1高表达的患者生存率下降。考虑到肿瘤中氧化还原失衡、ROS增加以及DNA和RNA氧化增加,MTH1蛋白表达上调可以维持氧化应激下DNA复制和转录的保真性,有利于肿瘤的生长和转移,进而缩短肿瘤患者的生存期。另外,RAS致癌基因与肿瘤的增殖、侵袭、迁移、血管生成等恶性特征有关[16]。人非小细胞肺癌中,MTH1 mRNA表达水平与KRAS突变及表达相关,提示MTH1可以通过调节RAS通路影响肿瘤的恶性程度[17]。
肿瘤靶向治疗有利于提高患者生存率,改善患者预后。2014年瑞典科学家Thomas Helleday等将MTH1小干扰RNAs分别导入肿瘤细胞和正常细胞,发现肿瘤细胞存活率降低,而正常细胞无明显变化,他们用MTH1抑制剂TH287和TH588的研究进一步证明了在肿瘤细胞中抑制MTH1的表达可选择性地杀死肿瘤细胞。此外,黑色素瘤、SW480结直肠癌和MCF7乳腺癌的裸鼠移植实验也对TH588的处理产生了疗效[15]。因此,MTH1被认为是一种新的抗肿瘤靶点。通过本研究笔者证明了干扰MTH1表达,不仅抑制结肠癌细胞增殖,还影响了癌细胞的迁移和侵袭能力。
综上所述,MTH1蛋白在结肠癌组织中表达上调,其表达量与肿瘤的进展和患者的预后有关。MTH1蛋白在其他肿瘤中的分子机制研究还需要进一步的实验加以证明。

