沉默 annexin A5对喉癌Hep-2细胞增殖和侵袭的影响
周晓芳 刘 杨 侯秀秀 赵智翔 许敏达
喉癌是耳鼻喉科常见的恶性肿瘤之一,在头、颈部上皮来源的原发恶性肿瘤中排名第2位,其中男性的发生率约为女性的10倍,且发生率呈逐年增高的趋势[1]。近年来,激光治疗在早期喉癌中虽然起到较好的治疗效果,但对于患者的5年生存率并无明显改善。目前对于中、晚期喉癌的治疗仍以手术为主联合放射治疗和化学治疗的综合治疗,然而手术造成的患者术后呼吸、发声困难等相关后遗症,特别是晚期喉癌患者,广泛的喉部器官切除严重影响了患者的生活质量,为了更好的改善喉癌患者的诊疗和预后,从喉癌的生物学特性深入研究,寻找治疗的新靶点,可能成为提高喉癌治疗效果及改善患者生存质量的关键[2]。
作为膜联蛋白家族重要成员之一的膜联蛋白A5(annexin A5,ANEX5),在肿瘤的发生、发展中起到重要作用,通过多种途径调控肿瘤细胞的生物学活性[3]。Zhao等[4]证实喉癌组织中annexin A5表达较癌旁正常组织明显上调,且与喉癌的临床分期、病理学分级及颈部淋巴结转移等密切相关。笔者前期体外细胞实验研究发现,有效阻低annexin A5的表达后,喉癌细胞凋亡减弱,因此笔者推断annexin A5可能促进喉癌细胞的凋亡[5]。本研究采用RNA干扰技术体外沉默annexin A5基因在喉癌细胞中的表达,以进一步探讨阻低annexin A5基因前后对喉癌Hep-2细胞增殖和侵袭的影响,为喉癌的基因治疗提供可能的依据。
材料与方法
1.材料:人喉癌细胞 Hep-2购自上海生物科学研究院细胞总库,细胞培养基RPMI-1640购自美国HyClone公司,LipofectamineTM2000 及Trizol购自美国Invitrogen公司,青霉素、链霉素、小牛血清购自美国Gibco公司,反转录试剂盒、taq酶购自日本TaKaRa公司,annexin A5单克隆抗体、β-actin单克隆抗体、二抗辣根过氧化物酶(horseradish peroxidase),HRP购自美国Epitmics公司,ECL化学发光试剂盒、Fibronectin购自美国Millipore公司,CCK-8 kit、蛋白裂解液、SDS-PAGE凝胶制备试剂盒购自中国碧云天公司,阴性对照siRNA和annexin A5-siRNA购自日本TaKaRa公司,Matrigel购自美国BD公司。
2.用siDirect Version2.0设计annexin A5基因的特异性siRNA序列:通过Pubmed比对及前期实验证实有效的特异性RNA序列,并由大连宝生物公司合成。特异性siRNA序列为:上游引物:5′-CCAUGAUACUUUAAUCAGAAG-3′,下游引物:5′-UCUGAUUAAAGUAUCAUGGTT-3′;无关siRNA片段的上游引物:5′-AGGUGACUAGCACUGUUAGTT-3′,下游引物:5′-GUAACAGUGCUAGUCACCUTT-3′。
3.细胞培养:Hep-2细胞从液氮中复苏,低速离心后去除冻存液,将Hep-2细胞培养于含10%小牛血清和1%青链霉素的1640培养基中, 5%CO2孵箱、37℃,48~72h传代或换液。
4.细胞转染:将对数生长的Hep-2细胞以2 ×105/孔接种到6孔板中,培养24h后参照脂质体(LipofectamineTM2000)说明书进行细胞转染,siRNA浓度为50ng/L。实验分成siRNA干扰组(含annexin A5-siRNA干扰片段及脂质体)、空白对照组(仅含脂质体)及阴性对照组(含无关序列siRNA片段和脂质体)3组,转染液为RPMI-1640基础培养基。转染6h后换常规细胞培养基。
5.半定量实时PCR:细胞转染后48h,用Trizol试剂提取Hep-2细胞的总RNA,检测合格后反转录成cDNA,并用半定量PCR技术扩增膜联蛋白A5基因,引物序列为:annexin A5(342bp):上游引物:5′-TCTCGGCTTTATGATGCTTATG-3′,下游引物:5′-TCGTGTTCCAAAGATGGTGAT-3′;β-actin(594bp):上游引物:5-GACCCAGATCATGTTTGAGACC-3′,下游引物:5′-ATCTCCTTCTGCATCCTGTCG-3′;将PCR扩增产物进行琼脂糖凝胶电泳,嗅化乙锭染色,将成像系统采集的图片通过PDQuest软件分析比对,β-actin做内参,实验重复3次。
6.Western blot法检测:将转染48h后的Hep-2细胞进行总蛋白提取,BCA蛋白定量后进行蛋白质电泳,根据蛋白质分子量选择相应的SDS-PAGE凝胶,去30μg总蛋白上样浓缩胶,80V恒压电泳至样品进入分离胶,改120V继续恒压电泳,当指示剂迁移至分离胶下游边缘时停止电泳,200mA恒流转膜40min后用封闭液封闭1h,4℃孵育annexin A5抗体过夜,用二抗IgG 室温振荡孵育1h后,洗涤液洗膜3次,ECL试剂盒法显色,Bio-Rad成像系统成像,并用该系统对图像进行分析,β-actin为内参,实验均重复3次。
7.CCK-8检测细胞增殖:将对数生长的Hep-2细胞接种于96孔板中,细胞浓度为1×104/孔,细胞铺满96孔板50%时进行细胞转染,转染siRNA终浓度50nmol/L,总体积为100微升/孔。细胞转染24、48、72h分别加入CCK8试剂,37℃CO2孵箱中培育1h,酶标仪测定波长450nm的细胞吸光度,分析细胞增长情况。
8.Transwell小室侵袭实验:50mg/L的Matrigel胶稀释4倍后包被Transwell小室上室面,小室的下室面用10mg/L的Fibronectin均匀涂抹,37℃孵育1h;将培养板中残余液体吸出,小室内每孔加入10g/L的BSA无血清培养液50μl,37℃孵育30min,然后将小室置于24孔板中,小室外加入常规1640培养基(含双抗及10%小牛血清)600μl,将转染48h的He-2细胞以1×105/200μl的浓度加入到小室内,37℃、CO2孵箱中培养24h后取出小室,并用棉签仔细擦除微孔膜上层的细胞,将微孔膜下层的细胞用10%结晶紫进行染色,剪下微孔膜并固定载玻片上于在高倍显微镜下观察计算细胞数,每个样本各个方位随机计数10个高倍视野(200倍),每组实验重复3次。
结 果
1.siRNA干扰组能抑制annexin A5 mRNA的表达:如图1所示,转染48h后,siRNA干扰组中annexin A5基因mRNA相对表达水平为0.197±0.013,空白对照组为0.712±0.037,阴性对照组为0.674±0.063。结果提示siRNA干扰组annexin A5 mRNA表达较阴性对照组及空白对照组明显下降(F=134.484,P<0.05),阴性对照组和空白对照组mRNA表达比较,差异无统计学意义(P>0.05)。
图1 实时PCR检测各组annexin A5 mRNA表达结果
2.siRNA干扰组能抑制annexin A5蛋白的表达:如图2所示,转染48h后,siRNA干扰组膜联蛋白 A5蛋白相对表达水平为0.449±0.064;而空白对照组为0.949±0.074;阴性对照组为1.001±0.107。结果提示siRNA干扰组蛋白明显下降,空白对照组和阴性对照组比较, 差异有统计学意义(F=39.849,P<0.05), 空白对照组和阴性对照组蛋白表达比较,差异无统计学意义(P>0.05)。
图2 Western blot法检测各组annexin A5蛋白表达结果
3.siRNA干扰组能抑制Hep-2细胞的增殖:如图3、表1所示,转染24h后,siRNA干扰组对比空白对照组和阴性对照组,差异无统计学意义,转染48、72h后,siRNA干扰组细胞增殖低于空白对照组和阴性对照组,而空白对照组、阴性对照组细胞增殖比较,差异无统计学意义。
图3 CCK-8法检测Hep-2细胞增殖曲线
表1 CCK-8检测细胞A值
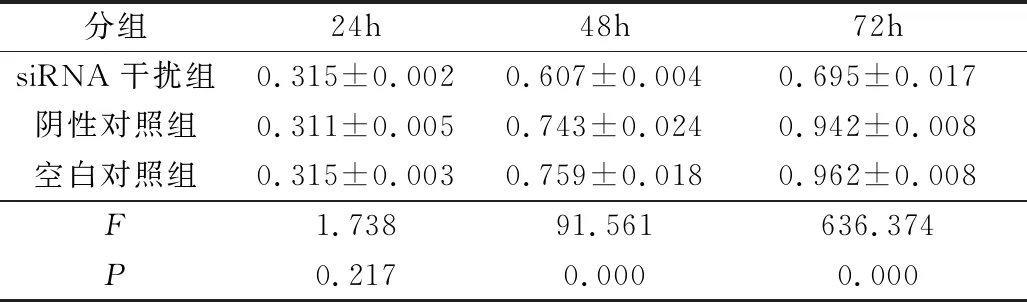
分组24h48h72hsiRNA干扰组0.315±0.0020.607±0.0040.695±0.017阴性对照组0.311±0.0050.743±0.0240.942±0.008空白对照组0.315±0.0030.759±0.0180.962±0.008F1.73891.561636.374P0.2170.0000.000
4.siRNA干扰组能抑制Hep-2细胞的侵袭能力:Transwell小室实验结果如图4所示:空白对照组、阴性对照组细胞数分别为62.333±6.994和61.433±5.328,而siRNA干扰组为22.467±3.980个,siRNA干据组明显低于空白对照组及阴性对照组(F=500.546,P<0.05),而空白对照组和阴性对照组细胞数比较,差异无统计学意义(P>0.05),沉默annexin A5基因的表达能够在体外抑制喉癌Hep-2细胞的侵袭能力。
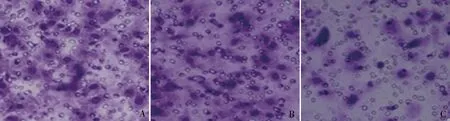
图4 各组喉癌Hep-2细胞侵袭情况(结晶紫染色,×200)A.空白对照组;B.阴性对照组;C.siRNA干扰组
讨 论
annexins是通过钙离子调节的多功能蛋白家族,在细胞的信号转导、钙离子通道形成、炎性反应、肿瘤的增殖与分化、细胞骨架蛋白间的相互作用以及维持细胞外基质的完整性等方面具有重要作用[6]。annexin A5是膜联蛋白家族中分布最广泛、含量最丰富的成员之一,位于人染色体4q26~q28,由319个氨基酸组成,常以Ca2+依赖的形式与膜磷脂结合,参与一系列的细胞生物学过程[7]。近年来对annexin A5蛋白的研究备受关注,研究发现在多种恶性肿瘤中存在异常表达,并通过多种途径调控肿瘤细胞的增殖和浸润转移[8~12]。研究发现,在头颈部鳞状上皮来源的恶性肿瘤中膜联蛋白A5表达明显上调,且其表达与肿瘤的恶性程度、侵袭转移等密切相关[13]。
本研究通过化学合成的siRNA对annexin A5基因进行表达沉默。RNA干扰(RNA interference,RNAi)是一种已被证实能有效沉默目的基因表达的常见基因沉默的技术。通过实时PCR及Western blot法分别从mRNA水平和蛋白水平验证siRNA对annexin A5基因干扰效果。图1、图2显示,PDQuest软件分析后显示特异性的siRNA片段能有效干扰annexin A5基因mRNA和蛋白在喉癌细胞中的表达。通过CCK-8试剂盒检测法及Transwell小室侵袭实验发现,有效阻低annexin A5基因的表达后,喉癌细胞增殖、侵袭能力均明显减弱,结果提示annexin A5可能促进肿瘤的增殖和侵袭转移。
前期研究发现,annexin A5低表达抑制喉癌细胞的凋亡,同时又在喉癌晚期及伴淋巴转移的癌组织中表达较早期喉癌表达明显增高[4]。然而,干扰annexin A5在喉癌细胞中的表达后,喉癌细胞凋亡抑制,同时增殖和侵袭能力也减弱,即在同一种肿瘤细胞中,兼具促瘤和抑瘤作用。这可能与annexin A5参与细胞的炎性致癌相关,即annexin A5可能通过介导癌细胞凋亡而促使免疫反应发生,使低致瘤、低转移的肿瘤细胞通过接触早期炎性细胞而转换成高致瘤、转移性的肿瘤细胞[3]。此外研究发现,在调控肿瘤的侵袭和转移过程中膜联蛋白 A5起着重要作用,且在不同肿瘤细胞中annexin A5同时兼具促瘤和抑瘤作用[3,14]。Peng等[15]发现过表达annexin A5能够增加小鼠肝癌细胞株的体外侵袭和转移,且其表达水平与小鼠肝脏肿瘤的恶性程度及淋巴转移密切相关,提示膜联蛋白A5具有促瘤作用。Wang等[8]研究发现在宫颈癌细胞中annexin A5表达阻低后可能通过影响 E-cadherin和 MMP-9的表达来促进HeLa细胞的迁移和侵袭,提示膜联蛋白A5具有抑癌作用。Sun等[16]发现在肺癌细胞中annexin A5通过调节多种细胞信号通路影响肺癌的发生、发展。Wu等[17]也发现在胃癌中上调annexin A5的表达能激活多药耐药相关蛋白(multidrug resistance-associated protein,MRP),而影响胃癌的预后。通过研究发现在不同肿瘤细胞中干扰annexin A5后对细胞侵袭转移能力的影响并不一致。因此笔者推测,在喉癌细胞中annexin A5也可能通过影响某些肿瘤相关基因的表达或通过调节多种细胞信号通路来促进喉癌细胞的侵袭能力。
另外,有研究发现annexin A5 的酸性磷脂是其参与细胞内外重要功能的关键。annexin A5的酸性磷脂位于一个由4个相同区域构成的高度保守核心内,其中的蛋白核心都被折叠成5α螺旋后反转缠绕成右手超螺旋,其氨基酸特殊的排列顺序从而形成了annexin A5功能多样性的特点[18]。因此推断阻低annexin A5在喉癌Hep-2细胞中的表达阻低后,还可能引起部分annexin A5异常的磷酸化或在细胞内表达异位,从而使喉癌Hep-2细胞的生物学活性发生一定改变;或通过annexin A5介导Ca2+流动异常而影响肿瘤细胞的发生和发展[19]。
综上所述,喉癌的发生、发展是多种因素影响的复杂过程,本研究发现,通过体外改变annexin A5在喉癌Hep-2细胞中的表达,能一定程度影响Hep-2喉癌细胞的增殖与侵袭能力,提示annexin A5可能在喉癌的发生、发展中发挥促癌作用,有望成为喉癌早期诊断和预后判断的参考指标,但是annexin A5在喉癌中的作用及相关分子机制仍有待于深入研究。

