TAZ基因在喉癌组织中的表达规律及其对Hep2细胞增殖的影响
程秀琴 艾力根·阿不都热依木 唐 亮
喉鳞状细胞癌 (LSCC)是头颈部常见肿瘤之一,在我国东北地区高发,且发生率逐年上升,但病因不明[1,2]。病因学上统计结果显示其发生可能与吸烟、饮酒、人类乳头瘤病毒感染、喉咽反流及胃食管反流疾病等诸多因素有关,另外还与ras、c-myc、EFGR、PRAD、Int-2等癌基因和p53、p16、FHIT等抑癌基因有关[3~5]。目前其主要治疗手段为手术切除配合放射治疗、化学治疗,随着治疗手段的进步,喉癌患者术后生活质量不断改善,但近30年来喉癌术后患者5年生存率仍没有明显提高[6]。因而寻找与喉癌发生有关的新基因,对了解喉癌发生、发展的分子机制及临床干预具有重要意义。
Hippo信号通路是一个涵盖30多个组件复杂的信号网络,越来越多的调节因子逐渐被鉴定,最核心的部分包括一系列级联激酶和转录共活化因子。以哺乳动物为例,Hippo核心成员包括Mst、Lats,相关辅因子WW45和Mob等激酶及转录共活化因子YAP/TAZ等。该通路上游的核心成员主要通过逐级磷酸化抑制下游转录共活化因子YAP/TAZ,减少其核内转录复合物活性,进而抑制细胞增殖,促进细胞凋亡和控制细胞数目[7,8]。TAZ是Hippo信号通路主要的下游效应因子之一,影响增殖分化等相关基因的表达,属于致癌基因,据报道其在多种人类癌症中表达异常。但目前并未有TAZ在人喉癌组织中的相关报道。
本研究首次检测了32例喉癌组织及癌旁组织中TAZ的表达,并证实了TAZ在喉癌Hep2细胞中促进细胞增殖的作用,旨在发现与喉癌发生、发展有关的新基因。
材料与方法
1.化学试剂:脂质体转染试剂购于美国Invitrogen公司;MTT粉购自美国Amresco公司;实时PCR引物及过表达载体均购自广州锐博公司;鼠抗人TAZ、LATS1、E-cadherin、Vimentin、GAPDH、β-actin单克隆抗体购自美国CST公司。
2.细胞株及组织:Hep2细胞为人喉癌细胞系购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。32例原发性喉癌组织标本来自2010年1月~2017年8月期间笔者医院手术切除的喉癌根治术标本,所有患者术前均未接受放射治疗、化学治疗处理,经病理证实为喉鳞状细胞癌。患者年龄为43~75岁,取癌和癌旁<1cm范围内正常组织于-80℃冻存。
3.免疫组织化学:将收集的患者组织样本,用4%PFA固定后石蜡包埋切片,湿纸巾铺于载玻片盒底部做成加湿盒备用:切片常规脱蜡至水,hydrogen peroxide block中孵育10min将以降低非特异性背景染色;缓冲液清洗后滴加一抗工作液37℃孵育2h;洗去一抗滴加一抗增强子(primary antibody enhancer)室温下孵育20min;缓冲液清洗后滴加酶标二抗室温下孵育30min;洗去二抗,向1ml DAB+基质(plus substrate)中滴加2滴 DAB+色原(plus chromogen)混匀后滴加到切片上,孵育10min;自来水充分冲洗、复染、脱水、透明、封片。
4.MTT法检测细胞增殖活性:细胞用MTT比色测定细胞增殖活性:将细胞接种于12孔板,细胞104个/孔,24h后吸去上清液,分别转染pcDNA3.1-TAZ质粒及对应空载48h。分别在1、2、3天收集培养好的TAZ过表达细胞及对应空载细胞经胰酶消化后制成细胞悬液接种于96孔板中,浓度为1×105/ml,每孔100μl,孵育24h后换液,每孔加入10μl的MTT,浓度为5mg/ml,4h后,通过酶标仪检测各孔495nm波长的吸光度(A)值。按以下公式计算细胞增殖率:增殖率(%)=(实验组A平均值/对照组A平均值)×100%。
5.细胞集落形成实验:将培养好的细胞接种于12孔板,细胞104个/孔,24h后吸去上清液,分别转染pcDNA3.1-TAZ质粒及对应空载48h。将培养好的TAZ过表达细胞及对应空载细胞经胰酶消化后制成细胞悬液接种于平板中,在每60mm培养皿中置入1000个细胞,每隔3天更换培养基。7天后,在显微镜下观察细胞集落形成情况并拍照。
6.实时PCR检测TAZ及EMT相关基因的 mRNA水平:将收集的患者组织样本用TRIZOL法提取总RNA,用Thermo公司的Nanodrop 2000分光光度计测定RNA的浓度和纯度,点样量为1μl,通过仪器分析及计算机直接读出浓度(ng/μl),并根据A260/A280比值判断纯度。然后按照反转录试剂盒说明书方法进行反转录得到cDNA,再以cDNA为模板,按照实时PCR试剂盒说明书方法检测样本中TAZ的转录水平。引物序列详见表1,每个样本3个复孔,按两步法PCR扩增,条件为:步骤1:95℃ 30s;步骤2:95℃ 5s,60℃ 30s(40个循环);步骤3: Melt Curve(美国Bio-Rad公司,CFX96)。反应结束后确认实时PCR的扩增曲线及溶解曲线是否满足要求,仪器软件中自动输出Ct值,计算相对表达量采用2-△△Ct方法,按照下列公式计算:△Ct(目的基因)=Ct(目的基因)-Ct(内参基因),ΔΔCt=ΔCt(转染YAP1细胞)-ΔCt(转染空载细胞)。
7.Western blot法检测TAZ、Hippo及EMT相关基因的蛋白表达:将培养好的细胞接种于6孔板,细胞105个/孔,24h后吸去上清液,分别转染pcDNA3.1-TAZ(LATS1)质粒及对应空载,48h后收集细胞提取蛋白。细胞用改良的RIPA缓冲液裂解(美国Sigma-Aldrich公司),蛋白质含量用Bradford reagent(美国Thermo Scientific公司)测量。所提取蛋白(50μg)在变性聚丙烯酰胺凝胶中分离,然后转移到PVDF膜(微孔),以5%的脱脂牛奶封闭(印度HiMedia公司)。然后使用增强化学发光(ECL)暗室显影,凝胶成像仪(美国Bio-Rad Laboratories公司)扫描纪录,以β-actin作为内参,进行分析比较。

表1 RT-PCR引物序列
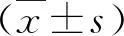
结 果
1.TAZ在喉癌组织中高表达:收集32例患者喉癌组织及癌旁组织样本进行免疫组织化学染色,结果显示喉癌组织中TAZ的表达明显增加(图1A)。分别提取32例患者喉癌组织及起癌旁组织样本总RNA并反转录得cDNA,经实时PCR分析发现癌组织中TAZ转录显著上调(图1B)。
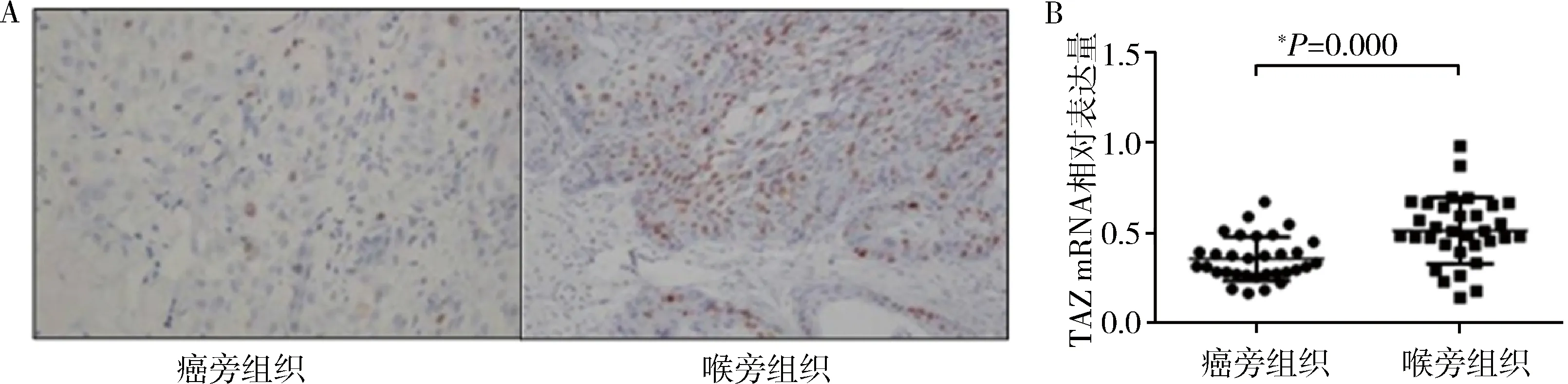
图1 TAZ在喉癌组织和癌旁组织的表达规律A.免疫组化结果;B.32例喉癌组织临床样本实时PCR结果
2.TAZ对人喉癌细胞系Hep2细胞增殖的影响:为进一步探知TAZ对喉癌细胞的作用,笔者将TAZ基因克隆到pcDNA3.1载体中,并转染到喉癌Hep2细胞中,Western blot法检测转染效果,结果如图2A所示,表明转染成功。过表达TAZ细胞用MTT比色测定细胞存活率,结果显示TAZ过表达后Hep2细胞活力增加(图2B),同时细胞集落形成实验也证实TAZ过表达后Hep2细胞增殖情况显著增加(图2C)。
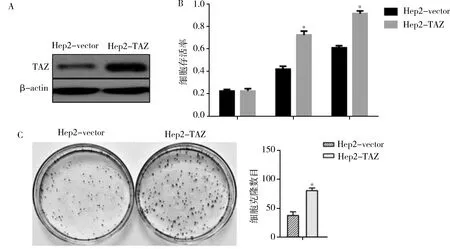
图2 TAZ促进Hep2细胞增殖A.Hep2细胞TAZ过表达检测;B、C.MTT分析及菌落形成实验表明,过表达TAZ促进Hep2细胞增殖;与Hep2-vector组比较,*P<0.05
3.TAZ对人喉癌细胞系Hep2细胞EMT过程的影响:为继续探究TAZ促进人喉癌细胞增殖的原因,笔者将TAZ基因克隆到pcDNA3.1载体中,并转染到喉癌Hep2细胞中,检测过表达TAZ后细胞EMT过程中相关指标的变化。实时PCR结果显示,Twsit、Slug、Vimentin等间质细胞特异性基因表达显著上调,而E-cadherin等上皮细胞特异性基因表达显著下降(图3A),表明过表达TAZ后,喉癌细胞系Hep2出现上皮间质样转变,Western blot法检测结果得到一致的结论(图3B)。
图3 TAZ激活Hep2细胞EMT过程A.RT-PCR分析;B.Western blot法检测;与对照组比较,**P<0.05
4.TAZ影响Hep2细胞EMT过程与Hippo信号通路的关系:为进一步探讨TAZ促进Hep2细胞EMT过程是否与Hippo信号通路有关,笔者将Hippo信号通路关键基因LATS1基因克隆到pcDNA3.1载体中,并转染到喉癌Hep2-TAZ细胞中,检测过表达LATS1激活Hippo通路后细胞EMT过程中相关指标的变化。Western blot法检测结果显示,与对照组比较,过表达LATS1抑制TAZ表达,同时Vimentin等间质细胞特异性基因表达显著降低,而E-cadherin等上皮细胞特异性基因表达显著增加(图4A),表明过表达LATS1后,喉癌细胞系Hep2-TAZ上皮间质样转化受到抑制,实时PCR结果得到一致的结论(图4B)。
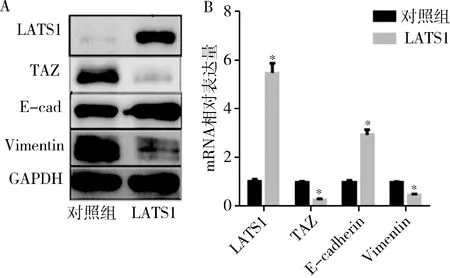
图4 TAZ激活Hep2细胞EMT过程依赖Hippo信号A.实时PCR分析;B.Western blot法检测;与对照组比较,*P<0.05
讨 论
TAZ,一个由WWTR1基因编码带PDZ结合基序的共转录激活因子,因与14-3-3蛋白结合而被发现,属于Hippo通路的另一个效应基因,能与TEAD、RUNX2、Glis3等转录因子结合发挥不同功能,如细胞增殖,迁移及分化等,其功能异常导致细胞过度增殖,甚至诱发肿瘤[9,10]。此外,其亦可响应许多胞外或胞内的信号,包括细胞密度、机械压力、能量状态、缺氧等[11]。据报道,TAZ 作为一个致癌基因在多种人类癌症中表达并扮演重要角色,如肝内胆管癌,乳腺癌,横纹肌肉瘤等,调控着癌细胞的增殖、分化、凋亡、迁移、入侵、间充质转化(EMT)及多能性[12~15]。但TAZ基因与喉癌的相关性及其在喉癌中的作用国内外尚未见报道。
本研究中笔者发现较癌旁组织,喉癌组织中TAZ基因显著高表达(图1)。免疫组化结果显示,喉癌组织中TAZ细胞核内定位明显增加,提示喉癌组织中过表达的TAZ可能通过入核与相关转录因子结合,调节下游增殖等相关基因的表达进而调控细胞增殖等,从而参与喉癌的发生、发展。本研究构建了重组真核表达载体pcDNA3.1-TAZ,并转染喉癌Hep2细胞,使TAZ蛋白在Hep2细胞中表达增加,后续的细胞增殖能力分析显示,TAZ基因表达增加能明显增加Hep2细胞的增殖能力(图2A)。此与笔者在喉癌组织中的表达检测结果相符,证实TAZ基因能发挥致癌基因的作用,诱导Hep2肿瘤细胞增殖及喉癌的发展形成。进一步研究其促进喉癌细胞增殖过程中发现,TAZ促进喉癌细胞系Hep2细胞的增殖可能是通过促进EMT过程实现,实时PCR及Western blot法检测结果显示Twsit、Slug、Vimentin等间质细胞特异性基因表达显著上调,而E-cadherin等上皮细胞特异性基因表达显著下降,表明过表达TAZ后,喉癌细胞系Hep2出现上皮间质样转变(图3)。同时在该TAZ活化细胞系中转染LATS1表达载体以激活Hippo信号通路,并检测EMT过程相关基因的变化,实时PCR及Western blot法检测结果显示过表达LATS1后,喉癌细胞系Hep2-TAZ上皮间质样转变受到抑制,证明TAZ促进喉癌细胞Hep2增殖的过程是依赖Hippo信号通路的(图4)。
作为 Hippo 通路的一个效应基因,TAZ与TEAD、RUNX2、MyoD等转录因子结合发挥功能,并受 Hippo 依赖或非依赖的方式调控[16]。TAZ与MyoD结合促进肌细胞分化[17]。在非酒精性脂肪肝病中,TAZ肝细胞表达增加促进炎症、细胞死亡及纤维化[18,19]。除调控细胞组织发育外,TAZ在多种人类癌症中也扮演非常重要的角色,调控着癌细胞的增殖、分化、凋亡、迁移、入侵、间充质转化(EMT)及多能性,在多种人类癌症如肝内胆管癌,乳腺癌受到重视[20]。笔者的研究结果显示,TAZ在喉癌组织中高表达并以Hippo依赖的方式促进细胞EMT转换过程,此结论为人类TAZ基因在癌症中的重要性和广泛性予以补充,同时为喉癌的发生、发展提供新的理论基础。
综上所述,喉癌的发生、发展与TAZ高表达相关,且TAZ高表达能促进Hep2细胞增殖,对进一步了解喉癌发生、发展的分子机制及临床干预具有重要意义。

