细胞衰老与肿瘤发生
李 苑, 王宇彤,2, 徐 越 综述, 俞作仁 审校
(1. 同济大学附属东方医院转化医学研究中心,上海 200120; 2. 锦州医科大学基础医学院系,锦州 121001; 3. 同济大学生命科学院,上海 200092)
据统计,我国人口的老龄化进程加快,20世纪90年代中国就已经步入了老年化时代。2017年全国60周岁及以上人口2.41亿人,占总人口的17.3%,预计到2020年,80岁以上老年人口将达到3067万;2025年,60岁以上人口将达到3亿,成为老年型国家[1]。人口老龄化已经成为我国严峻的社会问题,严重影响社会、经济、健康等各方面的发展。
步入老龄化社会,我国老年人健康问题也亟需更多关注。中国城市居民疾病死亡率调查统计,恶性肿瘤排第1位,已然成为威胁老年人身体健康的第一杀手。60岁以上的老年人是肿瘤高发人群。其中,老年人恶性肿瘤死亡率排前5位的依次是: 肺癌、胃癌、肝癌、食管癌、结直肠癌、前列腺癌的高发人群[2]。
衰老和肿瘤的发生密切相关,互相影响,互相促成。衰老是肿瘤发生的一个重要风险因素,肿瘤发生一定程度上是衰老的自然结果[3]。反之,肿瘤患者因为免疫力低下,DNA损伤修复能力降低,也容易导致细胞及器官的衰老。而肿瘤细胞逃逸凋亡,无限生长的信号和复制能力,是否为抗衰老研究提供一些信息和借鉴?利用细胞衰老机制,能否用于肿瘤细胞的诱导性早衰?研究二者的关系,对临床抗肿瘤疾病、抗衰老、延年益寿等均具有重大意义。
1 细胞衰老
细胞衰老是细胞分裂进入“不可逆”停滞状态。通常在应激状态下或随着时间的推移,细胞周期和DNA复制停滞,细胞正常生理功能和增殖能力衰退,同时伴随细胞形态学改变、功能改变、代谢异常和免疫下降。分子水平表现在基因突变积累、表观遗传学改变、线粒体功能异常、细胞周期因子表达下降、细胞周期抑制因子和衰老相关基因表达升高、DNA/RNA/蛋白质等合成效率下降、DNA损伤修复相关基因表达抑制[4],等等。细胞衰老由多种因素引起,目前较为公认的包括自由基学说和端粒学说。
1.1 自由基学说
1956年Harman[5]首次提出自由基衰老学说,认为衰老是代谢产物自由基攻击生命大分子造成组织细胞损伤引起。氧化应激也是诱发肿瘤等恶性疾病的重要原因。自由基引起的细胞氧化应激,导致DNA损伤,包括DNA片段缺失,染色质结构和表观遗传学调控异常,发生基因组的不稳定性,这是部分体内细胞衰老的主要诱因[6]。另有学说认为,炎症因子参与自由基诱导的衰老过程。细胞衰老时,胞内氧化还原状态发生改变,活性氧及氧化应激对炎性基因的激活,介导了衰老和疾病发生[7]。
1.2 端粒学说
端粒是染色体末端重复的一段非编码碱基序列。细胞每分裂一次,染色体末端就有约40~100bp DNA丢失[8],当缩短到一定程度时,启动细胞内DNA损伤反应,激活细胞衰老过程。如何抑制端粒的缩短;维持细胞端粒的长度,将是抑制细胞衰老的途径之一。研究表明,端粒酶能够保护端粒末端不被降解。在生殖细胞和干细胞中,端粒酶表达高,活性强,维持了端粒长度,保护细胞不进入衰老状态,保证干细胞的增殖和自我更新能力[9]。最近研究表明,在肿瘤细胞,尤其是肿瘤干细胞,端粒酶表达特异上调,酶活性特异升高[10]。端粒酶的活性及端粒长度的维持,可能对肿瘤干细胞的干性维持以及肿瘤发生有重要调控作用[11]。
2 衰老是肿瘤发生的重要因素
2.1 衰老引起的基因突变积累
衰老及肿瘤,均为基因突变积累的结果,二者在发生机制上具有一定的共性,可谓是“一条大路上的两个岔道”,见图1。发育阶段体细胞的基因突变,可能引起机体发育异常,而成体细胞的基因突变及积累,往往导致肿瘤发生。众所周知,DNA复制及细胞分裂,伴随着基因的自然突变。有研究表明,衰老相关的基因突变量平均每8年增加1倍,肿瘤发生的突变积累大约需要15年[12]。大部分的基因突变无明显表型,对机体功能影响不大,但有些突变严重影响细胞功能,导致疾病发生,比如p53基因的突变,广泛性诱导肿瘤发生[13]。NRMT1、REGγ等基因的突变,诱导细胞和机体早衰[14]。
细胞衰老与肿瘤发生、发展、逃逸治疗等均有重要关联。通过癌基因激活诱导的衰老被称为癌基因诱导凋亡(oncogene-induced senescence, OIS)。人成纤维细胞中致癌HRASG12V过表达会导致细胞周期永久性停滞[15]。RAS过表达会促使细胞衰老,这种机制可以阻断体内肿瘤生长。c-MYC、E1A和DRIL1的共表达通过RASG12V诱导衰老。HER2、EGFR和PI3K的过度表达驱动原代和肿瘤细胞的衰老[16]。由此可见,衰老是抑制肿瘤病变的生理性抑制途径之一。另一方面,癌基因的失活也可以诱导衰老。MYC失活诱导不同肿瘤标本中的细胞衰老和消退,如淋巴瘤,骨肉瘤和肝细胞癌。这些效应由多种机制驱动,反映了癌基因诱导肿瘤和诱导衰老的复杂性[17]。
2.2 衰老引起的炎性反应
普遍认为在肿瘤发生早期,炎性反应有利于清除衰老及变异细胞,有助于预防和抑制肿瘤[18]。衰老细胞可以分泌多种细胞因子,如炎性因子、细胞因子、免疫调节因子等,改变细胞微环境,启动机体免疫系统,产生炎性反应。衰老的肿瘤细胞被间质细胞、未衰老的肿瘤细胞和浸润的免疫细胞围绕[19],炎性细胞因子通过与周围细胞相互作用、招募和激活免疫细胞,抑制肿瘤发生。比如,IL-8及其同源受体CXCR2相互作用可诱导衰老[20];抑制IL-6或IL-6受体可抑制癌基因诱导的细胞衰老[21]。
在肿瘤发展后期,衰老细胞分泌的炎性因子、生长因子等,炎性微环境诱导肿瘤细胞的上皮-间质转化,促进肿瘤细胞的增殖、迁移、侵袭和和转移[22]。另外,衰老的肿瘤细胞通过SASP可以促进细胞增殖和驱动肿瘤血管生成[23]。比如,癌症患者的治疗诱导衰老(therapy-induced senescence, TIS)。虽然TIS最初有利于阻断肿瘤细胞的增殖,但TIS有可能导致肿瘤和正常组织中衰老细胞及其分泌因子的积累,反而促进了非衰老肿瘤细胞的增殖及恶变[24]。
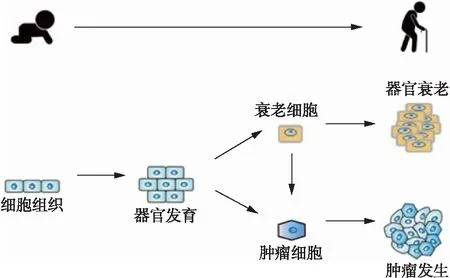
图1 组织细胞的衰老和癌变过程Fig.1 Lifelong interplay betweencellular senescence and tumorigenesis
衰老往往伴随着免疫功能的生理性衰退。体液免疫及细胞(T细胞、B细胞、NK细胞等)免疫均高度依赖于年龄。随着年龄的增长,首先是免疫器官(如胸腺)的衰老和萎缩,胸腺素分泌下降,免疫细胞分化及成熟过程延长,T细胞分裂和增殖能力下降,NK细胞活性也降低[25]。有研究表明,人到60岁左右时,血清中已经很难检测到胸腺素的活性[26]。其次,衰老导致免疫细胞对抗原刺激的反应下降,削弱了机体对体内外抗原反应的免疫应答能力和免疫监视能力。当免疫功能的生理性衰退到一定程度,则变为病理性衰退,容易产生病原微生物感染、自身免疫性疾病以及恶性肿瘤的发生。
肿瘤和衰老的相关研究蓬勃发展,出现多个新的研究热点,如非编码RNA、m6A甲基化、免疫治疗、自噬、铁死亡、细胞通讯、蛋白修饰等。越来越多的研究结果表明,非编码RNA在细胞衰老和肿瘤中的多个重要通路中发挥关键调控作用。miR-17-92家族由6位成员组成,与肿瘤发生和衰老过程关系密切,并对多种年龄相关疾病如心脏病、神经退行性疾病和骨质疏松症具有保护作用。随着年龄增长,miR-17-92表达水平呈下降趋势[27]。也有研究表明,miR-17-92家族部分成员的功能具有多效性,比如miR-17/20对管腔型乳腺癌增殖有促进功能[28]。近几年兴起的研究热点环状RNA(circRNA),在多种恶性肿瘤组织中表达异常[29]。如环状RNA 0058063在膀胱癌发生过程中通过作用CDK6促进恶化,并参与细胞信号传导[30]。环状RNA在细胞周期、细胞凋亡和细胞衰老等生命过程中发挥重要的调控功能。
3 肿瘤和衰老的交叉应用展望
3.1 利用细胞衰老机制,治疗肿瘤
利用衰老细胞的分裂停滞调控机制,如何诱导肿瘤细胞走向衰老,有望成为肿瘤治疗的突破口之一。有多种方法可以诱导肿瘤细胞衰老,例如,抑制原癌基因过表达人细胞s期激酶相关蛋白2或增加CD4+辅助细胞诱导肿瘤细胞衰老使细胞生长周期延长或完全停止[31];化疗药物抑制或者破坏肿瘤细胞的DNA复制,抑制细胞周期调控因子cyclins、CDKs或者激活细胞周期因子依赖性激酶抑制剂(CDK抑制剂)等,均能诱导肿瘤细胞衰老和分裂停滞[32]。也有研究发现化疗诱导的肿瘤细胞衰老,容易引起肿瘤细胞的耐药,导致较差预后[33]。此外,靶向抑制肿瘤细胞的线粒体功能,或者给予肿瘤细胞氧化应激刺激,也能诱导肿瘤细胞的衰老,而长寿基因和长寿干预措施又能够促进机体保持青春活力,对预防肿瘤发生及发展也具有重要意义[34]。
3.2 利用肿瘤细胞的永生机制,为预防衰老提供新的思路
延年益寿一直在人们探索和追求的一个梦想,利用肿瘤细胞的无限增殖、逃逸凋亡、有氧状态下糖酵解代谢等生物学特征,以及基因激活或者失活、端粒酶高表达等分子学特征,实现衰老细胞的逆转,或者保持细胞的“青春”和“永生”,也许是预防和抵制衰老的一个突破点。然而,肿瘤相关基因的人为改造或者癌性特征的赋予,在有助于细胞衰老逆转或者保持青春的同时,有可能细胞增殖失控而成瘤。因此,如何实现精准调控,有效控制成瘤风险,是一个巨大挑战。
衰老和肿瘤的关系一直是值得深入探讨的话题,肿瘤细胞无限增殖,衰老细胞周期阻滞,两者相互制约,目前对二者分子调控机制的了解尚处于初步认识阶段。随着生命科学领域前沿技术的日新月异和全世界科学家的不懈追求和探索,早日阐明衰老退变及肿瘤发生的精准调控机制和信号网络,在细胞增殖和保持活力的调控中找到平衡点,既防止肿瘤细胞的失控增殖,又能延缓组织和细胞的生理性衰老,为抗衰老、抗肿瘤提供新思路和新方法。

