特殊医学用途婴儿配方食品产品特点与有效清洁实施探讨
缪小静,姜艳喜,何光华,华家才,张小玲,储小军
(1.贝因美(杭州)食品研究院有限公司,杭州311106;2.浙江大学生物系统工程与食品科学学院,杭州310058;3.贝因美婴童食品股份有限公司,杭州311106)
0 引 言
特殊医学用途婴儿配方食品指针对患有特殊紊乱、疾病或医疗状况等特殊医学状况婴儿的营养需求而设计制成的粉状或液态配方食品。在医生或临床营养师的指导下,单独食用或与其它食物配合食用时,其能量和营养成分能够满足0~6月龄特殊医学状况婴儿的生长发育需求[1]。常见的特殊医学用途婴儿配方食品有无乳糖配方或低乳糖配方、乳蛋白部分水解配方、乳蛋白深度水解配方或氨基酸配方、早产/低出生体重婴儿配方、母乳营养补充剂、氨基酸代谢障碍配方。
特殊医学用途婴儿配方食品的生产需满足国家相关法律法规的要求,尤对不同配方类型产品共线生产时的有效清洁提出了要求。但对食品的有效清洁如何开展与验证的相关研究较少,而对制药企业关于药品生产的清洁验证要求由来已久,并且国内外都有此要求,如中国《药品生产质量管理规范(2010年修订)》对清洁的要求贯穿始终,特别是第八十四条、第一百四十三条、第一百四十四条分别对清洁操作规程、清洁验证和持续验证做出了规定[2];美国FDA cGMP211.67对设备清洁方法做出了规定[3];欧盟事法规(第4卷),欧盟人与兽药药品生产质量管理规范附录15确认和验证对设备清洁和清洁方法做出了规定[5]。可以按照特殊医学用途婴儿配方食品清洁的相关要求,参考借鉴药品的清洁验证案例,对特殊医学用途婴儿配方食品生产实施有效清洁。
1 特殊医学用途婴儿配方食品概述
常见的特殊医学用途婴儿配方食品有无乳糖配方或低乳糖配方、乳蛋白部分水解配方、乳蛋白深度水解配方或氨基酸配方、早产/低出生体重婴儿配方、母乳营养补充剂、氨基酸代谢障碍配方。每种特殊医学用途婴儿配方食品均有其自身的产品特点。
无乳糖配方粉剂产品要求乳糖含量小于0.5g/100g,低乳糖配方粉剂产品要求乳糖含量小于2g/100g;若是液态产品可以按照稀释倍数做相应折算。该类产品主要针对原发性或继发性的乳糖不耐受婴儿,在临床医生指导下进行使用。
乳蛋白部分水解配方食品除遵循GB 25596-2010标准规定的能量和各营养素指标以及其他污染物限量指标与微生物限量指标等要求外,配方主要技术要求此类食品是将牛奶蛋白经过加热和(或)酶水解为小分子乳蛋白、肽段和氨基酸,以降低大分子牛奶蛋白的致敏性[4];标准对此类食品中碳水化合物的组成无明确要求,可以完全使用乳糖,也可以使用其他碳水化合物部分或完全替代乳糖。
乳蛋白深度水解配方或氨基酸配方的配方特点是应用一定工艺手段将过敏原去除或不含过敏原,适用于牛奶蛋白过敏的婴儿,另还需要根据婴儿的代谢情况调整部分维生素和矿物质[2]。氨基酸配方中的蛋白质来源一般由18种单体氨基酸组成。对此类食品的过敏原限量,法规无明确限值。
早产/低出生体重婴儿配方适用的特殊医学状况为早产/低出生体重儿,在临床上将孕37周前出生的婴儿称为早产儿,将出生体重低于2 500 g的婴儿称为低出生体重儿,早产儿多为低出生体重儿[5]。该类产品要满足目标人群追赶生长的营养需求,所以能量、蛋白质以及一些维生素和矿物质的含量明显高于普通婴儿配方食品。允许使用容易消化吸收的中链脂肪作为脂肪的来源,但其总量不应超过总脂肪的40%。
母乳营养补充剂需添加到早产/低出生体重婴儿的母乳中使用,满足这类人群因追赶生长需要更高的能量、蛋白质、部分维生素和矿物质的要求。这类产品的设计需要更多的早产/低出生体重婴儿母乳的基础数据。
氨基酸代谢障碍配方是为对一种或多种氨基酸有代谢障碍的婴儿研制,另可参照乳蛋白深度水解配方或氨基酸配方可调整的范围进行能量和营养素含量的调整[2],以使产品能满足患儿对营养素的吸收利用,维持患儿正常生长发育。
综上,由于特殊医学用途婴儿配方食品面向的是患有特殊紊乱、疾病或医疗状况等的婴儿,所以对此类产品自原料采购与存贮直至终产品生产上市需严格管控,尤其需要重视的是生产环节。各类产品存在明显差异,一些指标如乳糖对其他产品可能不是限量指标,但对无乳糖配方就是限量指标,所以不同品种共线生产时的有效清洁显得尤为重要。
2 特殊医学用途婴儿配方食品共线生产有效清洁探讨
自《药品生产质量管理规范(2010年修订)》实施以来,清洁验证受到了制药企业以及监管机构的广泛关注;后原食品药品监管总局于2015年5月26日发布了“计算机系统”和“确认与验证”两个附录,其中“确认与验证”中明确“确认与验证应当贯穿于产品生命周期的全过程”[6]。产品生命周期包括产品研发、技术转移、商业生产、产品退市这4个阶段。基于生命周期理论,结合智晓日[7]、熊浪[8]、刘雅静[9]等对药品清洁验证的研究成果,探讨特殊医学用途婴儿配方食品共线生产的有效清洁实施过程。以下以无乳糖配方为例,讨论如何实施有效的清洁如下图1所示。
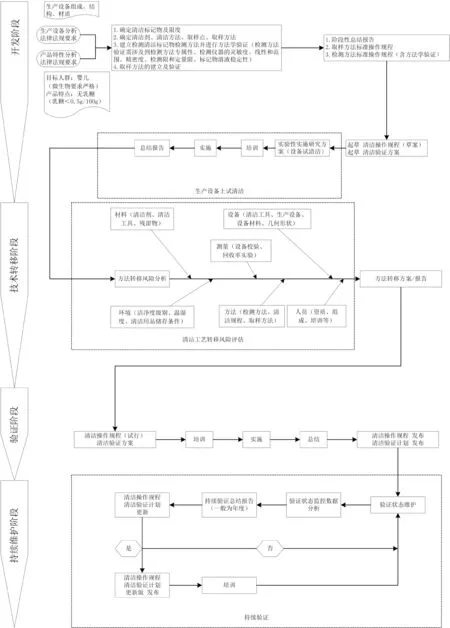
图1 无乳糖配方有效清洁实施流程
有效清洁的实施过程包括:①开发阶段:包括清洁剂选择、清洁方法、清洁标记物及限度、清洁标记物检测方法的确定、清洁验证取样点、清洁验证取样方法(方法建立、验证、确定)等,经过研究后形成阶段性总结、输出检测方法操作规程和取样方法操作规程,并经设备试清洁形成总结报告;②技术转移阶段:开发阶段形成的成果经风险评估(包括材料、设备、测量、环境、方法、人员等因素)后形成方法转移方案;③验证阶段:风险评估后转移形成的清洁操作规程、清洁验证方案、取样方法、检测方法等清洁的相关文件经培训、实施、验证,验证结果分析、偏差分析,形成验证总结,根据验证结果进一步完善修订清洁操作规程并正式发布,同时发布清洁验证计划;④持续维护阶段:清洁操作规程实施期间,定期分析验证数据、产品质量数据,根据分析结果不断完善修订清洁操作规程与清洁验证计划,确保有效清洁的持续稳定。
综上所述有效清洁的实施是一个持续循环的过程,需要不断实施、验证、反馈、维护。
3 有效清洁实施的关键
特殊医学用途婴儿配方食品适用特殊医学状况的患儿,且不同品种间的配方会有显著差异,所以有效清洁的实施就显得尤为重要。有效清洁实施的关键包括三部分:清洁操作规程、清洁验证、有效清洁的持续。
3.1 清洁操作规程
清洁操作规程的制定小组成员应包括设备、生产、品控(QC)、研发人员,是实施有效清洁的关键点。药品清洁操作规程一般包括的内容有:清洁的范围和对象、责任人、洁具、清洁剂及消毒剂(名称、成分、规格及配制方法、配制的浓度)、存放地点;清洗、消毒方法和步骤,包括清洗时间、温度、压力、清洁剂用量和流量等参数,清洁过程监控记录;清洁后的检查要求、干燥和储存条件、使用前的检查、洁具的干燥和存放;清洁周期、有效期、超过有效期的清洁处理等[10]。
特殊医学用途婴儿配方食品的清洁操作规程可以参考药品的执行:①需分析清洁对象的材质、结构、难清洁点,将最难清洁点作为验证取样点;②清洁剂、消毒剂的选用应考虑所生产产品的物料性质,选择清洁效果好的清洁/消毒剂,同时还需考虑可能的残留以及残留对生产产品品质的影响;③清洁操作程序需确保操作者能以可重现的、有效的方式对各类设备进行清洁,以保证每次清洁效果的一致性;④清洁时间需规定连续生产的最长周期、生产完成后至开始清洁的最长时间间隔、已清洁设备最长的保存时限。
当不同品项产品共线生产时,需分析不同产品的产品特性,根据不同产品的特性确定清洁操作规程,一般建议同一条生产线同一设备的清洁制定一个清洁操作规程,以免不同清洁操作规程在实施时产生混淆。分析同生产线上各产品的特性,根据最难清洁产品的清洁要求,制定清洁操作规程,以使其适合同线所有生产产品的清洁。当所生产的产品间差异较大,采用一个清洁操作规程时,对部分产品存在较大的清洁过剩和清洁资源浪费时,可考虑对生产的产品进行分组,根据每组产品的特点制定多个清洁操作规程。
清洁操作规程形成初稿后需由各部门相关人员评审,根据评审意见进行修定,发布后需进行人员培训后方可实施。清洁操作规程需具有可实施性、有效性和可重现性。
3.2 清洁验证
清洁验证指通过科学的方法采集足够的数据,以证明按照规定方法清洁后的设备,能始终如一地达到预定的清洁标准[11]。清洁方法应当经过验证,证实其清洁的效果,以有效防止污染和交叉污染。清洁验证应当综合考虑设备使用情况、所使用的清洁剂和消毒剂、取样方法和位置以及相应的取样回收率、残留物的性质和限度、残留物检验方法的灵敏度等因素[4]。应当根据验证的结果确认工艺规程和操作规程。这对于共线生产特殊医学用途婴儿配方食品极为重要。
清洁验证需有代表性、科学性,以此为目标,清洁验证方案的制定过程需完成以下任务。
3.2.1 清洁标记物及其限度的确定
清洁可接受标准一般包括特征成分、清洁剂(消毒剂)残留、微生物残留等三方面内容。传统食品企业在做清洁时,一般使用乙醇做清洁消毒剂,乙醇溶液没有残留。

表1 共线生产各产品特征指标要求举例说明
乳糖在设备允许残留量计算:300 kg×0.5%=1.5 kg
全乳蛋白在设备允许残留量计算:
0.1 mg/180 g×300 kg=0.56 mg/kg×300 kg=180 mg
根据产品的物料组成、清洁剂性质,选定量较大而又较难溶解于清洁剂的物料;另根据产品特性比较对某种物质的限量要求确定几个配方共线生产时的清洁标记物。
按以上两原则,因全乳蛋白属于大分子有机物,难溶于酒精,所以在以上四种产品共线生产时确定全乳蛋白作为清洁标记物。
进一步计算到设备物料接触表面单位面积所允许的残留量限度。展开特殊医学用途婴儿配方食品物料接触的设备表明:筛网(两面)、输送管道、混合设备等,算得设备接触表面的面积为300 000 cm2。
计算1 cm2的全乳蛋白残留限量=108 mg/300 000 cm2=0.56μg/cm2
除理化指标的清洁标记物外,清洁验证还需根据产品要求及GB 29923《食品安全国家标准特殊医学用途配方食品企业良好生产规范》中附录B粉状特殊医学用途配方食品清洁作业区沙门氏菌、阪崎肠杆菌和其他肠杆菌的环境监控指南等法规要求确定肠杆菌、阪崎肠杆菌、沙门氏菌等作为常规验证指标,除以上微生物指标目视被普遍采用作为清洁验证的指标。常规验证指标限量、确定依据见表2常规验证指标限量、确定依据。
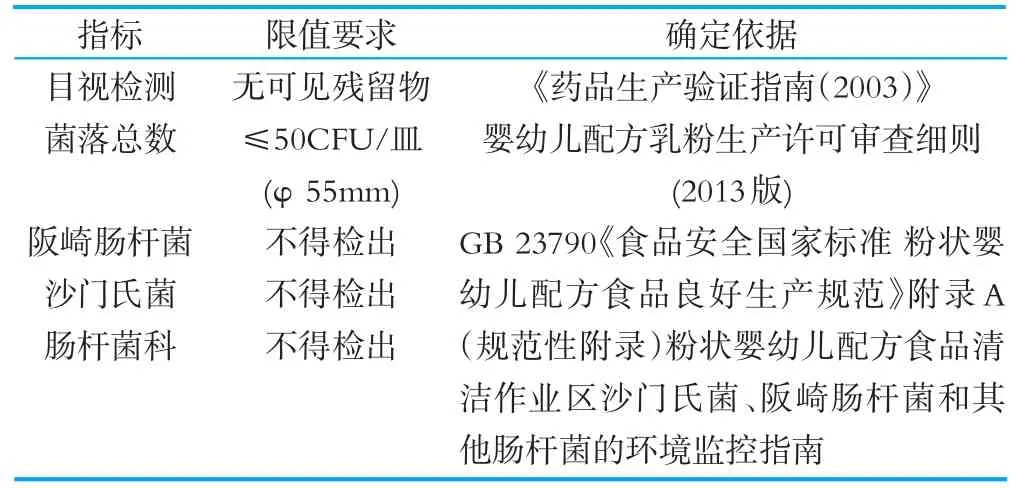
表2 常规验证指标限量、确定依据
3.2.2 取样方法和取样方法的验证
取样方法的确定可参照擦拭法,擦拭的溶解液需考虑标记物的溶解性及残留。
取样方法验证需验证其取样回收率、不同取样次数间的取样相对标准偏差(RSD),《药品生产验证指南(2003)》第三篇检验方法和清洁验证、无菌保证第二章清洁验证中“取样回收率和检验方法回收率在内的综合回收率一般不低于50%,多次取样回收率的RSD不大于20%。采用《药品生产验证指南》(2003版)擦拭取样操作规程,取擦拭面积100 cm2。
3.2.3 满足清洁标记物最低限度的检测方法的建立及方法学验证
结合3.2.1和3.2.2计算检测方法的检出限限度:
擦拭面积100 cm2允许的残留量=0.56μg/cm2×100 cm2=56μg
擦拭棉签润湿、溶解的溶液为5 mL,计算溶解液允许检出限量:
56 ug/5 mL=11.2×10-6g/mL。
结合考虑取样方法回收率,按最差条件50%计算溶液允许检出限量:
11.2 ×10-6×50%=5.6×10-6g/mL
要求检测方法的灵敏度应高于5.6×10-6g/mL,拜发全奶蛋白检验试剂盒(R 4652)测定其全奶蛋白含量的最低检测限为2.5×10-6g/mL,满足检测要求。但需对该试剂盒检测方法进行方法学验证,通常包括专属性、灵敏度、检测限、精密度、线性范围、回收率实验等,通常要求线性范围应达到清洁标记物限度的50%~150%,精密度RSD≤10%。
常规验证指标已经有较成熟的取样和检测方法,常规验证指标的取样、检测方法见表3清洁验证常规指标取样、检测方法。

表3 清洁验证常规指标取样、检测方法
设备表面微生物的检测可采用ATP(三磷酸腺苷)生物发光法快速检测和微生物平板计数相结合的方式,并对两种检测方法进行比对,通过统计分析方法,制定适合特殊医学用途婴儿配方食品生产线清洁验证的检测标准限制。日常监控可以采用ATP(三磷酸腺苷)生物发光法快速检测,快速判定清洁效果,结合定期的平板计数检测,提高日常监控效率,降低成本。
验证样品需按验证方案上规定的方法进行检测,以使检测结果的灵敏度和精确度满足要求。
3.2.4 验证取样点和取样时间的确定
验证取样是验证是否成功的关键,取样要确保三个正确即时间、位置、方法。验证方案制定批准后,对验证相关人员进行培训,考核培训的效果,确保验证计划的有效实施及验证结果的准确性。验证取样需严格按照验证方案规定的取样时间点、取样位置及方法进行取样,以确保验证结果具有代表性。
特殊医学用途婴儿配方食品干法生产的设备主要有杀菌隧道、微负压称量室、称量台、投料站、筛网、暂存仓、混合设备、自动计量包装机等,最差清点的确定要基于风险评估的基础上,根据设备的结构,选择不平、有衔接、难清洗点、和产品直接接触的点作为最难清洁取样点。一般验证取样点有筛网、混合设备混合浆和中心轴交界处、输送螺杆、自动计量包装机的料斗底部和螺杆交界处等。
企业可以结合以往类似产品清洁验证检测的情况,选择出现不合格几率较高,或检测值偏高的点作为最差取样点,一般开始验证的时候取样点要相对较多,后续根据实际验证的结果,对表现一直较好的取样点进行删减或减少频率。
清洁时间需规定连续生产的最长周期、生产完成后至开始清洁的最长时间间隔、已清洁设备最长的保存时限。应根据生产需要结合以往其余产品生产经验,预先设定一个最长生产周期以及生产时间结束后至开始清洁的时间间隔,在最差产品生产最长生产周期后,维持车间的空气洁净度,放置生产结束后至开始清洁最长的时间间隔,按清洁操作规程进行清洁,清洁完成作为最差取样时间点。已清洁设备最长的保存时限可在上次取样后放置预设定的时间,进行取样验证,因清洁后至下次在生产最长时间主要是要考虑微生物的生长,取样可只检微生物指标。
在验证时能在最差取样时间点取样验证能省却很多的验证,但往往由于生产的安排、产量的限制等原因不能在最差取样时间点时进行取样,此时只能在合理的前提下进行安排,在后续出现更差时间点时经风险评估进行补充验证。
3.2.5 清洁验证方案
清洁验证方案准备工作完成后便可结合清洁验证规程、生产工艺流程等制定验证方案,验证方案内容包括:
①验证目的:明确待验证的设备和清洁方法;
②清洁操作规程:以列表的方式列出相关设备的清洁操作规程,明确各设备所采用的清洁操作规程,确保在清洁的过程中按指定的清洁操作规程进行清洁;
③验证成员:列出参加验证人员名单,说明所属部门和职位,验证人员一般需包含生产、品控、检测、技术各部门至少一个人员,明确相关人员的培训要求,以便后续进行对应的培训,确保验证的有效开展;
④验证取样位置及方法:用图示或文字的方法明确取样位置和方法,避免出现取样偏差;
⑤验证指标、限度及对应的检测方法:建议以列表的方式列出各验证指标、对应的限度以及检测方法,以便后续按要求进行检测、判定;
⑥验证的次数:一般要求连续验证三次;
⑦偏差分析:提出出现偏差时的分析及处理要求。
3.2.6 验证报告
验证方案制定后,经培训、实施、检测。样品检测完成后对验证结果进行分析总结,并对出现的偏差进行分析、判定。验证结果的输出应该是阶段性的,一般建议一次验证结束后先进行总结,以确定是否需要完善清洁操作规程、验证方案等。
如出现超限值的情况,需从验证过程、验证方案限度制定的合理性及考虑清洁操作规程可改进的可能性等多方面进行分析,当确定验证过程无问题、限值合理、清洁操作规程无再改进的空间,则需在风险评估的基础上确定某个产品如乳蛋白深度水解婴儿配方食品和无乳糖或低乳糖婴儿配方食品生产的合理性,考虑采用另一种方式生产。
3.3 有效清洁的持续
确认和验证不是一次性的行为。首次确认或验证后,应当根据产品质量回顾分析情况进行再确认或再验证。关键的生产工艺和操作规程应当定期进行再验证,确保其能够达到预期结果[4]。由3.1和3.2的论述可知清洁操作规程和验证有效清洁实施的开始、关键,但有效清洁的实施是一个持续的过程,开发的过程固然重要,后续的维护同样重要,工厂相关人员需积极统计应用清洁验证的结果,根据结果对清洁操作规程进行修订完善,并在参考清洁验证结果、参照法规要求的基础上经风险评估确定清洁效果监控计划和定期验证计划,定期统计分析监控、验证结果结合产品质量控制情况,修订、完善清洁操作规程、监控计划、验证方案,以此让清洁效果持续有效并处于一种良性循环。
4 讨 论
特殊医学用途婴儿配方食品适用的对象为患有不同特殊医学状况的婴儿。不同产品间具有明显差异,如乳糖、牛奶蛋白、苯丙氨酸等于早产/低出生体重婴儿配方是必须的营养素组成,但却分别是无乳糖配方、乳蛋白深度水解配方/氨基酸配方、氨基酸代谢障碍配方(苯丙酮尿症)的限制营养素。因此交叉污染是影响共线生产产品质量的关键点,如不能有效实施清洁验证,将会直接影响患有特殊医学状况婴儿的生长发育,甚至危害其健康。所以为了进行持续有效清洁,引用药品的风险评估,贯穿开发、转移、验证、持续等各阶段,保证有效清洁开发、转移、验证、持续各阶段的科学性、合理性、有效性。在生产时可采用阶段性生产方式生产,即在共用生产区内,在一段时间内集中生产某一产品,再对相应的共用生产区、设施、设备、工器具等进行彻底清洁,更换生产另一种产品的方式[4],从而有效避免交叉污染。在增加或减少共线、同区域生产产品时,需根据产品特性重新进行风险评估,确定是否需要修订清洁操作规程、验证方案,以及验证的深度、广度等,从而保证清洁的有效性,确保有效防止污染和交叉污染。

