酪蛋白胰酶水解物的抗氧化活性及稳定性
陈旭峰,王佳丽,樊伟鑫,许女
(山西农业大学a.实验教学中心,b.食品科学与工程学院山西太谷030801)
0 引 言
1979年,Brantle等人[1]首先报道发现了一类短肽,其具有类吗啡活性,这类短肽源自喂食了牛乳酪蛋白酶解产物的豚鼠小肠。该短肽命名为β-酪啡肽-7(β-casomorphins-7,β-CM-7),是由 7个氨基酸组成,对应于β-酪蛋白第60~66氨基酸残基片段。此后,人们对于有关乳源性活性肽的研究进展十分迅速,并且逐步成为乳品界的探索重点。人们已经发现,可能广泛存在一些功能域于乳蛋白多肽链中,许多生物活性肽包含在其中,并且蛋白酶水解作用可以将其释放,使其在体内表现出特定的生理作用。目前人们对于乳源抗氧化活性肽的探究重点为抗高血压肽[2]、免疫调节肽[3-4]、抗血栓肽[5]、促进金属离子吸收的肽[6-7]、抗菌肽[8-9]、细胞生长的促进[10]、阿片肽等[11],而关于抗氧化活性肽的研究则相对较少。
沈浥[12]通过响应面优化了胰蛋白酶水解乳清蛋白以制备抗氧化肽工艺,最终获得的酶解产物在浓度为10 mg/mL时1,1-二苯基-2-苦基肼基自由基(1,1-Diphenyl-2-picrylhydrazyl,DPPH)清除率为78.78%,并且大孔纯化产物通过凝胶过滤色谱Sephadex G-15和反相高效液相色谱(Reverse phase high-performance liquid chromatography,RP-HPLC)分离,最终获得两个肽段A3a和A3b,具有较好的抗氧化活性。刘志东等[13]则比较了4种不同的酶水解酪蛋白产物的抗氧化性,结果表明木瓜蛋白酶和胃蛋白酶酶解产物清除DPPH、超氧阴离子自由基(O2-·)、羟自由基(·OH)的能力强于胰凝乳蛋白酶和胰蛋白酶酶解产物;而后两者酶解产物的还原性却强于前两者。毛学英等[14]和纪银莉等[15]对牦牛乳酪蛋白酶解过程进行了优化及抗氧化活性研究,结果表明具有DPPH自由基清除能力的酪蛋白酶解产物的制备采用碱性蛋白酶时产量较高,却具有含量较低的氨基氮,适合作为具有功能性的健康食品基材。
本文主要优化了酪蛋白酶解制备抗氧化肽的工艺,系统研究了体外和体内抗氧化活性,并进行了耐热性、耐酸碱性、耐消化性和储存稳定性试验,为其广泛的开发和应用提供了数据支持。
1 材料与方法
1.1 材料与试剂
酪蛋白、胰蛋白酶、胃蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、DPPH、邻苯三酚、抗坏血酸(Vitamin C,VC)、丙二醛(Malonaldehyde,MDA)检测试剂盒、水杨酸、三氯化铁、过氧化氢、铁氰化钾等。
酶生产厂家提供的各种蛋白酶的最适反应p H值以及温度条件如表1所示。
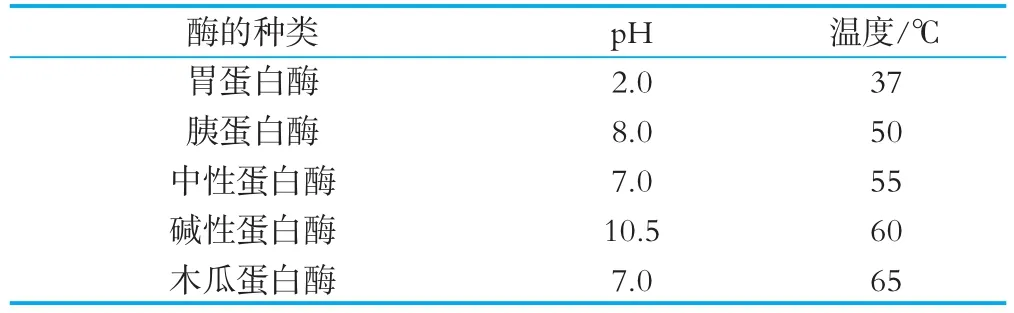
表1 各种蛋白酶的最适反应条件
1.2 仪器与设备
BS2010S电子分析天平、电热鼓风干燥箱、TDL-4低速离心机、HHS-21-4数显恒温水浴锅、F22E可见分光光度计、R 201D-11旋转蒸发仪、真空冷冻干燥机、SM 800临床专用全自动酶标仪。
1.3 试验方法
1.3.1 酪蛋白酶解物的制备
称取酪蛋白30 g溶于500 mL蒸馏水中,加入蛋白酶启动反应。水解过程中维持最适酶反应温度,最适pH值,并不断搅拌,分别在0,30,60,90,120,150,180,210,240 min取样,调pH到7.0,煮沸灭酶10 min,冷却后,在4℃,以4 000 r/min离心20 min,测定部分上清液的蛋白水解度,并将其余上清液冻干以分析抗氧化活性。
1.3.2 酪蛋白水解度及酶解物肽浓度的测定
按照文献[16]中的方法,采用甘氨酸标准曲线法测定水解蛋白液中-NH2的含量(μmol/mL),水解度计算公式如下:

式中:htot为每g蛋白质的肽键毫摩尔数,查得酪蛋白htot=8.2(mmol/g);6.25×N为水解底物蛋白质含(g/L),本实验酪蛋白为11.66。
按照文献[10]中的方法,采用Folin酚法测定多肽浓度。
1.3.3 体外抗氧化活性测定
按照文献[17]中的方法,对酪蛋白水解物冻干样品进行总还原能力、羟自由基(·OH)、超氧阴离子自由基(O2—·)、一氧化氮自由基(NO·)的清除能力和抑制脂质过氧化能力进行测定。
1.3.4 体内抗氧化活性测定
(1)D-半乳糖致衰老模型 将小鼠按体重随机分为三组,即:正常对照组(每日灌胃生理盐水),模型组(每日灌胃生理盐水),CTH组(每日灌胃酪蛋白胰蛋白酶水解物 400 mg/kg.bw),每组各10只,模型组和CTH组每日颈背部皮下注射用生理盐水配制的灭菌D-gal(150 mg/kg·d),正常组补充等量生理盐水,连续6周,自由饮食。
(2)抗氧化指标检测及方法 采用试剂盒对小鼠血清、肝、脑组织中SOD活性、GSH-Px活性和MDA含量进行测定。
2 结果与讨论
2.1 不同蛋白酶对酪蛋白酶解物性质的影响
肽的氨基酸序列和酶解物的抗氧化活性有着密切联系,各种蛋白酶的底物特异性以及作用位点的不同对其起到决定性作用,根据酶生产厂家提供的酶的最适反应p H值以及温度条件(见表1),考察不同蛋白酶对酪蛋白酶解物水解度及DPPH清除率的影响,试验结果如图1和图2所示。

图1 各种蛋白酶对酪蛋白的酶解进程曲线
由图1可知,酶解酪蛋白后水解度最高的是碱性蛋白酶和胰蛋白酶。在120 min内,各种酶水解酪蛋白的水解度都随水解时间的延长而不断增大,120 min时水解度达到最大值(除碱性蛋白酶外),之后趋于稳定,说明此时大多数的酪蛋白已经被酶水解成小肽段和游离氨基酸。对于中性蛋白酶,120 min后水解度呈下降趋势,水解度的降低是由于一些游离氨基酸与小肽的结合作用,由此导致了此类现象的出现。此结果与叶挺等[18]在不同蛋白酶和水解条件对酪蛋白酶解产物性质的影响研究中得到的结论相似,其结果表明碱性蛋白酶水解酪蛋白的速度最快,酪蛋白的水解程度最大,说明酪蛋白上有较多的碱性蛋白酶酶切位点。

图2 酪蛋白不同酶解产物的DPPH自由基清除率
图2 为120 min时酪蛋白经各种酶水解产物测得的DPPH清除率。由图2可知虽然碱性蛋白酶酶解产物的水解度最高,但其产物抗氧化活性却低于胰蛋白酶酶解产物。因为不同的酶对酪蛋白中所含的各种蛋白的底物特异性以及作用位点有区别,获得的酶解产物的肽链结构和长度有差异,并导致其活性大小也有可能有差别。通常人们预期得到的生物活性肽是分子量较小的短肽。沈浥[12]在酶解乳清蛋白制备抗氧化肽的研究中也得到相似结论,即水解度与抗氧化活性并不总是呈现正比关系。
毛学英等[14]和纪银莉等[15]以牦牛乳酪蛋白为原料,利用胃蛋白酶、胰蛋白酶、碱性蛋白酶,木瓜蛋白酶和风味蛋白酶制备酪蛋白酶解产物,并分别测定其DPPH自由基清除活性,发现碱性蛋白酶酶解产物的清除活性显著高于其他酶解产物(P<0.05)。刘志东等[13]证明木瓜蛋白酶和胃蛋白酶水解酪蛋白产物比胰凝乳蛋白酶和胰蛋白酶酶解物具有更强的DPPH、超氧阴离子自由基、羟基自由基的清除活性;然而比较其还原能力,则胰凝乳蛋白酶和胰蛋白酶酶解物比木瓜蛋白酶和胃蛋白酶酶解物强。而在本文中胰蛋白酶水解产物具有最强的抗氧化活性。因此,底物蛋白种类不同,即使都是酪蛋白,来源不同(牦牛和奶牛),其制备抗氧化肽最适的酶不同。
2.2 酶解工艺优化
2.2.1 底物浓度对水解度和DPPH自由基清除率的影响
选用胰蛋白酶,当条件为pH 8.0,T为50℃,加酶量[E]/[S]为3%时水解120 min,探究底物浓度[S]对酪蛋白水解度以及抗氧化能力的影响,结果见图3。由图可知,在[S]为50 mg/mL以内,水解度和抗氧化活性随底物浓度的升高而不断增强,当[S]为50 mg/mL时,酶已由于底物而达到饱和,酶分子与底物作用,之间碰撞的可能性很大,产生剧烈反应,水解度(Degree of hydrolysis,DH)和DPPH自由基清除率达到最高,分别为26%和60.2%。随着增加底物的浓度,体系中水的流动性被高浓度的蛋白所束缚,导致酶分子与底物之间的碰撞机会逐步减少,致使降低酶解的反应速率,另外,蛋白浓度太高,会使得蛋白能够占据酶分子的部分活性位点,从而使中间产物形成,这些没有活性的中间产物,抑制了酶解反应,逐步降低了水解度[12]。

图3 底物浓度对酪蛋白水解度和DPPH自由基清除率的影响
2.2.2 加酶量对水解度和DPPH自由基清除率的影响
选用胰蛋白酶,当条件为p H 8.0,T为50℃,[S]为50 mg/mL时,水解120 min,探究加酶量[E]/[S]对酪蛋白水解度和抗氧化活性的影响,结果见图4。由图可知,随着加酶量的增加,水解度和DPPH自由基清除率也显著提高(P<0.05),当[E]/[S]为4%时,底物被饱和,水解度和DPPH自由基清除率均不再显著提高(P>0.05)。酶的数量超过一定限度而多余,单位时间内一部分酶分子不能与底物相结合,就会使得水解程度的增加过程变慢。
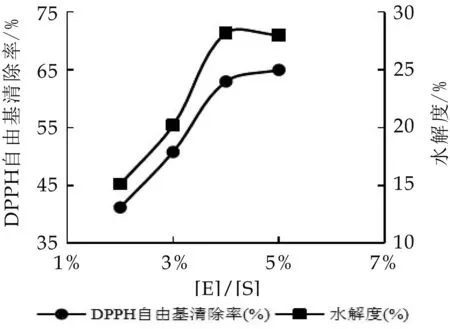
图4 加酶量对酪蛋白水解度和DPPH自由基清除率的影响
2.2.3 温度对水解度和DPPH自由基清除率的影响
选用胰蛋白酶,当条件为[E]为50 mg/mL,[E]/[S]为4%,pH 8.0时,水解120 min,研究温度对水解度和抗氧化能力的影响,结果见图5。由图5可知,随着酶解温度的不断升高,水解度会逐步增加(P<0.05),在温度为50℃的时候酶解产物的水解度以及DPPH自由基清除率达到最高,当温度达到55℃时,水解度和抗氧化活性均呈现出下降趋势。温度过高或过低时,都会发生抑制作用导致酶的活性降低,其中也可看出水解度和DPPH自由基清除率之间呈线性关系,二者出现了相同变化趋势,同时温度过高时会破坏蛋白酶的空间结构,导致其失去活性,使抗氧化活性下降。此研究与侯楚楚[19]研究的酪蛋白水解肽制备条件优化的结果一致,50℃为最佳酶解温度。

图5 温度对酪蛋白水解度和DPPH自由基清除率的影响
2.2.4 pH值对水解度和DPPH自由基清除率的影响
选用胰蛋白酶,当条件为[S]为50 mg/mL,[E]/[S]为4%,T为50℃时水解120 min,研究pH值对抗氧化活性以及水解度的影响,结果见图6。由图可知,在pH 7.0~8.5之间,水解度和DPPH清除率均呈现先增加后降低的趋势,在pH 7.5的时候达到峰值。与侯楚楚[19]研究结果一致,在p H小于7.5时,酶解速率非常快,水解度随p H的增大而减小;当p H大于7.5时,水解度随着pH的增大而减小。
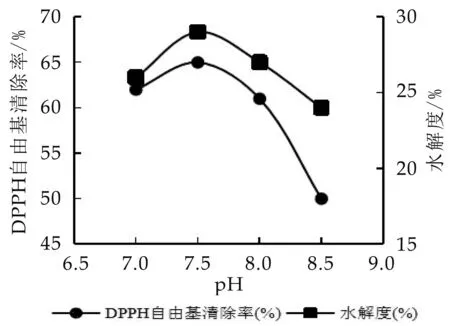
图6 pH对酪蛋白水解度和DPPH自由基清除率的影响
2.2.5 时间对水解度和DPPH自由基清除率的影响
选用胰蛋白酶,当条件为[S]为50 mg/mL,[E]/[S]为4%,T为50℃,pH为7.5时,研究水解时间对抗氧化活性及水解度的影响,结果见图7。由图可知,随着水解时间的不断延长,水解度会持续增加,在150 min时趋于稳定,水解度达到34.5%,这是由于随着时间的延长,反应位点不断被酶分子饱和,导致可以同酶分子作用的肽键数目逐步减少;同时产物浓度不断增加,形成了较强的竞争性抑制作用。在水解时间为120 min条件下,DPPH自由基清除率达到最高,为68.1%。侯楚楚[19]也得到相似结论,研究表明随着酶解反应的进行,酪蛋白分子逐渐水解成多肽和氨基酸的混合物,在0~30 min内,酶解速率较快,之后慢慢的趋于平缓状态。这是因为随着酶解反应的进行,胰蛋白酶酶切作用位点减少,从而反应趋缓。
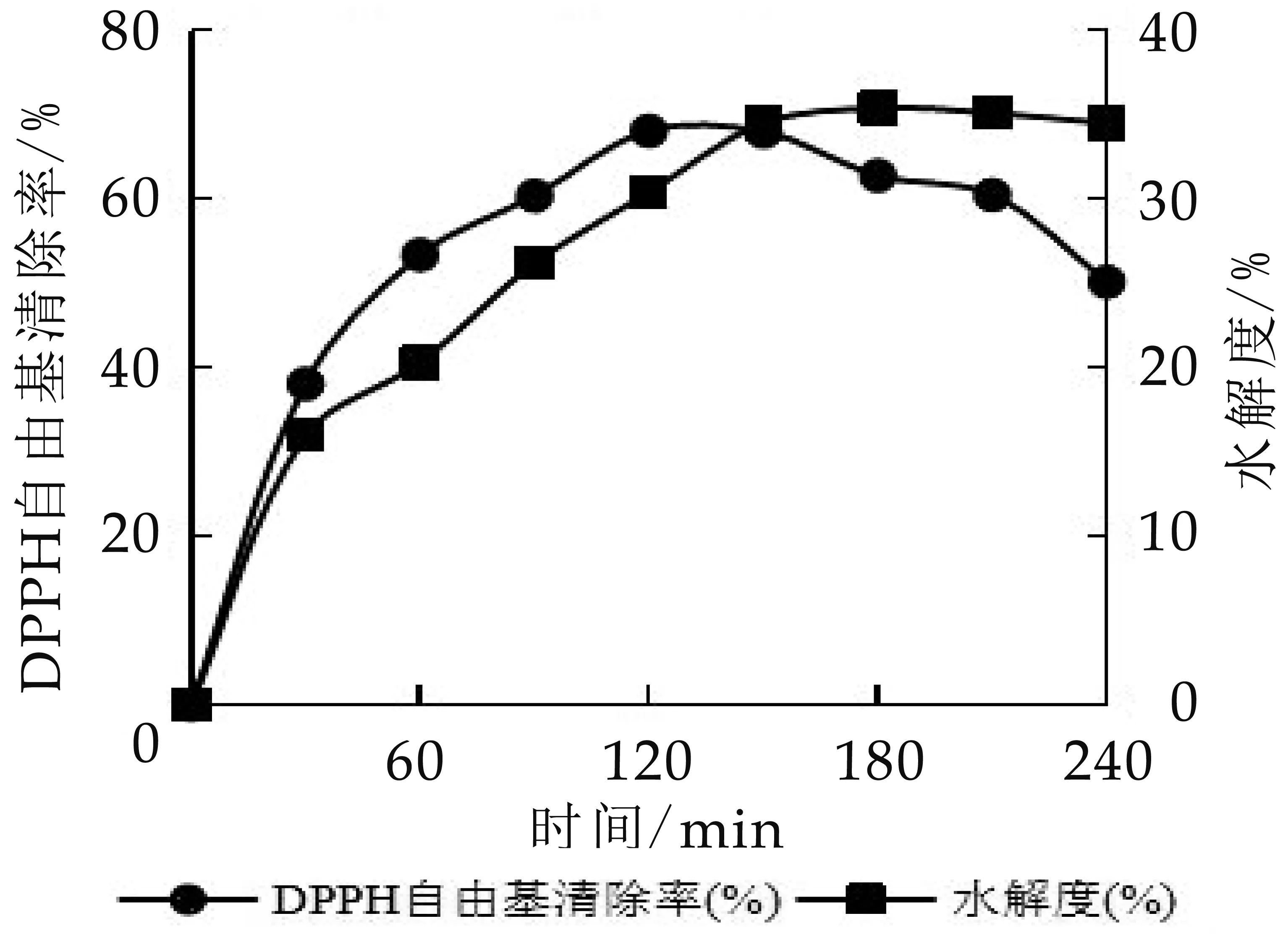
图7 水解时间对酪蛋白水解度和DPPH自由基清除率的影响
2.3 酪蛋白胰酶水解物的体外抗氧化活性
由表2可知,酪蛋白胰酶水解物的还原能力随浓度的增加而增大,说明其具有较强的还原能力,因而具有较高的抗氧化活性,与刘志东[13]的研究结果一致,但本试验高于其研究的酪蛋白胰酶水解物的还原能力。此酪蛋白酶解物不仅具有可以很好地清除DPPH自由基的能力,对·OH和NO·自由基的清除也有着很好的作用,并且具有浓度相关性,当多肽浓度为10 mg/mL时,对二者的清除率分别可以达到45.2%和61.5%,当浓度升高到30 mg/mL时,其清除率分别达到62.4%和79.5%;另外,其对O2-·及Fe2+诱发的卵黄脂蛋白脂质过氧化都具有一定的清除和抑制能力。Pritchard等[20]从商业切达干酪中分离纯化出一种DPPH清除能力很强的抗氧化活性肽,且肽的浓度越高,清除能力越强。Kong等[21]证明利用碱性蛋白酶水解乳清蛋白5小时后得到的水解物FRAP的清除能力最强,并最终证实分子量为0.1~2.8 ku的低分子量肽最具有抗氧化潜力。这些活性肽的具体抗氧化机制还不清楚,但研究显示肽的抗氧化活性与其分子组成、结构、疏水性和氨基酸的残基位点有关。今后,我们需要对抗氧化活性肽的构效关系作进一步研究。

表2 酪蛋白胰酶水解物体外抗氧化活性
2.4 酪蛋白胰酶水解物的体内抗氧化活性
机体受到氧化破坏会导致一些老年疾病和神经性器质病变,比如糖尿病、动脉粥样硬化、癌症、冠心病等,抗氧化肽可以阻止脂质过氧化物的产生,降低氧化压力对机体造成的损伤。食品来源的抗氧化肽具有安全、活性强、易吸收、成本低的特点,并且不会引起机体免疫反应风险的优点。
表3,表4和表5显示了酪蛋白胰酶水解物对小鼠血清、肝、脑组织MDA含量、SOD和GSH-Px活性的影响。结果表明对于小鼠血清、肝脏和脑组织中的MDA含量,模型组相比于正常对照组显著增加(P<0.05)。而CTH组小鼠血清、肝和脑组织中的MDA含量显著低于模型组(P<0.05),说明酪蛋白胰酶水解物(CTH)对肝、脑组织和血清脂质过氧化反应有明显降低的作用,并且,相比于对照组,酪蛋白胰酶水解物(CTH)组的小鼠血清、脏和脑组织中的SOD和GSH-Px活性也显著升(P<0.05)。
Martha等[22]发现酪蛋白中性蛋白酶水解物可以影响人体Jurkat T细胞中CAT和GSH的活性。齐微微等[23]利用碱性蛋白酶水解制得的乳清蛋白肽对小鼠进行灌胃实验,灌胃乳清蛋白肽自然衰老小鼠的SOD和GSH-Px活性显著增加,MDA和蛋白质羰基浓度显著降低,同时乙酰胆碱脂酶的活性也有所降低。包怡红等[24]观察了乳清蛋白肽对衰老小鼠体内抗氧化能力的影响,发现衰老小鼠血浆、肝脏、脑组织匀浆中CAT、SOD、GSH-Px含量均显著降低,MDA含量显著升高,与正常小鼠比较差异显著,200、400 mg/(kgbw·d)乳清蛋白肽可以提高衰老小鼠血浆、肝脏、脑组织中CAT、SOD、GSH-Px含量,降低MDA含量,与衰老模型组比较差异有显著性,乳清蛋白肽能显著提高亚急性衰老小鼠的抗氧化能力,具有量效关系。今后,我们需要对抗氧化活性肽的构效关系及体内抗氧化机制作进一步研究。

表3 酪蛋白胰酶水解物对小鼠血清、肝、脑组织MDA含量的影响

表4 酪蛋白胰酶水解物对小鼠血清、肝、脑组织SOD活性的影响

表5 酪蛋白胰酶水解物对小鼠血清、肝、脑组织GSH-Px活性的影响
2.5 酪蛋白胰酶水解物的稳定性研究
2.5.1 酪蛋白胰酶水解物的耐消化稳定性
肽类产品的功能性必须考虑其添加在产品中后经消化道后的稳定性。本文通过体外模拟胃肠道消化过程,采取消化酶[E]/[S]=2%,37℃消化4 h来测定CTH的耐消化稳定性。如图8所示,CTH在胃蛋白酶作用之后,DPPH自由基清除率降低,其原因为部分蛋白肽段因胃蛋白酶的水解作用而被打断,致使小幅度降低了抗氧化能力。而胰蛋白酶的作用对活性无显著影响(P>0.05),表明消化道酶对产物进行作用后,仍然可以耐受胃肠道蛋白酶作用,以较高的活性参与体内的抗氧化过程。试验结果较纪银莉[15]的研究结果相比有所差异,其研究表明水解产物经过胃蛋白酶和胰蛋白酶处理后,清除DPPH的能力会下降,胰蛋白酶处理对水解产物的抗氧化活性影响最大。而刘珊珊等[25]则研究表明酪蛋白抗氧化肽经胃蛋白酶消化后其抗氧化活性显著下降,在随后的模拟肠消化中抗氧化活性逐渐回升,甚至完全恢复到消化前的水平。

图8 酪蛋白胰酶水解物耐消化稳定性
2.5.2 酪蛋白胰酶水解物的耐热、耐酸碱稳定性
分析CTH对热、酸、碱等常用加工、生产、储藏和应用处理方式的耐受性,对确保生物活性及保存期限特别重要。采用在不同p H缓冲液中,沸水浴处理不同时间后比较其DPPH自由基清除率(见表6)。在不同的pH缓冲液中,抗氧化肽的离子状态会因pH的不同而有所差异,进而对其抗氧化活性造成影响,CTH在p H为5~7时能保持较高的抗氧化活性,在p H为3和pH为9~11时未经热处理时活性明显降低,这可能是发生了分解、降解、聚合等反应,导致产物失活。经过热处理后活性显著降低,这是因为产物在加热的过程中会经历某种程度上的水解,并且抗氧化肽由于高温而失活。
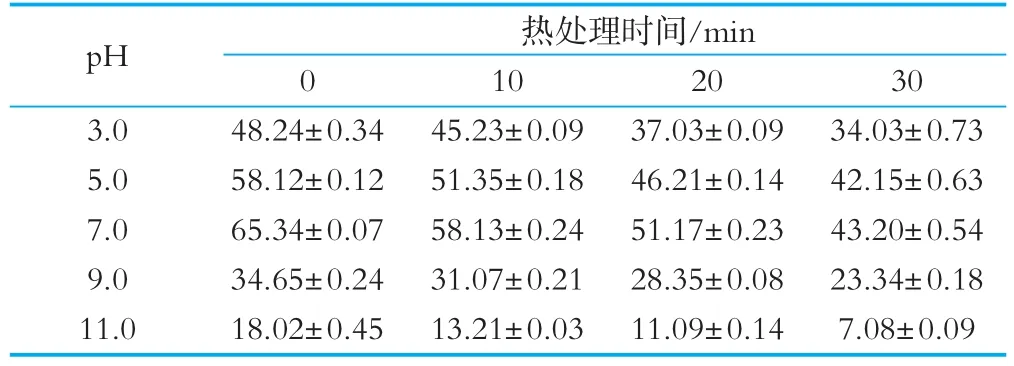
表6 酪蛋白胰酶水解物的耐热、耐酸碱稳定(DPPH清除率/%)
2.5.3 酪蛋白胰酶水解物的储藏稳定性
明确酪蛋白胰酶水解物的储藏稳定性,确保其在储存期内的生理功能活性稳定性非常重要。由表7可知,伴随着储存时间的持续增加,产物的DPPH自由基清除活性均显著低于新鲜制备产(P<0.05),产物在低温条件下储藏相较于常温具有显著的稳定性(P<0.05)。储藏于-18℃下3个月,活性降低约6%,6个月降低约17%。在4℃下储藏稳定性相较于冷冻保藏低,6个月后活性降低21%,贮藏稳定性较好。
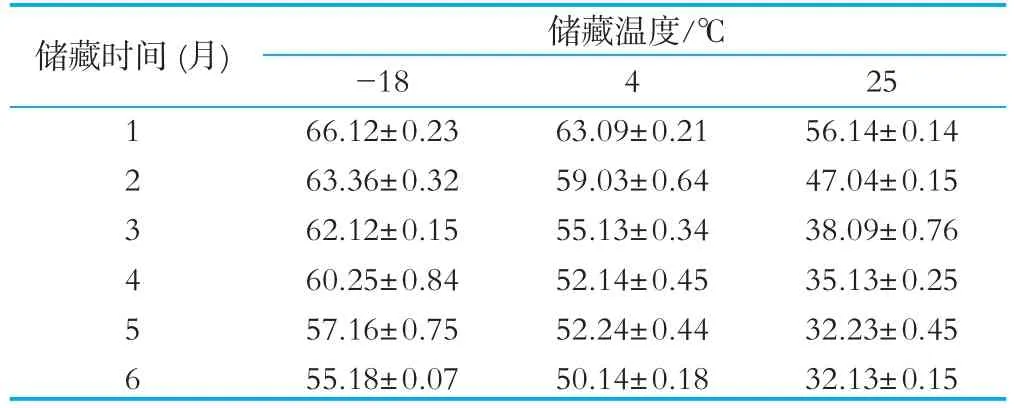
表7 酪蛋白胰酶水解物的耐储藏稳定性(DPPH清除率/%)
3 结 论
本文对酪蛋白酶解制备抗氧化肽的工艺进行了优化,并研究了酪蛋白胰酶水解物的抗氧化活性及稳定性。最优酶解条件下,水解度为30.1%,DPPH自由基清除率为68.1%。此酪蛋白胰蛋白酶水解物对羟自由基(·OH)和一氧化氮自由基(NO·)也有着较好的清除效果,并且其对超氧阴离子自由基(O2-·)及亚铁离子(Fe2+)诱发的卵黄脂蛋白脂质过氧化都具有一定的清除和抑制能力。小鼠实验表明,酪蛋白胰蛋白酶水解物体现出较好的体内抗氧化作用。稳定性试验证明酪蛋白酶解产物具有良好的耐消化、耐热、耐酸碱和耐储藏稳定性,体现了其作为抗氧化功能原料的良好应用潜力。

