超声波处理对黑加仑果实多糖性质与生物活性的影响
徐雅琴,杜明阳,杨 露,刘育松,魏 红,郑彬浩,郭莹莹,杨 昱*
(东北农业大学理学院,黑龙江 哈尔滨 150030)
黑加仑别名黑穗醋栗,其果实富含多种维生素、糖类、有机酸和花青素等。研究发现,黑加仑果实不仅是一种营养丰富的水果,而且具有多种保健功效,如具有改善视功能、降血脂和降血压等功效[1-2]。多糖是黑加仑果实主要活性物质之一,具有抗肿瘤、抗炎、抗氧化和抗糖化等作用[3-4]。研究表明,天然多糖的生物活性受到其分子质量和结构特征的影响[5-6]。本课题组前期制备得到的黑加仑果实多糖大多具有较大的分子质量,水溶性差,一定程度上影响了多糖的生物活性[7-8]。因此,选择适宜的方法对黑加仑果实多糖进行降解,制备不同低分子质量多糖,可为筛选高活性黑加仑果实多糖提供依据。
超声波作为一种绿色高效的降解方法,具有操作简单、可控性好的特点,其在食品和医药工业中用于多糖的降解引起了广泛的关注[9-10]。超声波引发的多糖降解是由超声空化(机械效应)引起的。超声波处理诱导液体介质内部空化气泡的快速形成和坍塌,产生强烈的压力使多糖分子中共价键断裂,进而导致多糖的降解[8]。与化学降解和热降解不同,超声波降解是一个非随机过程,其引起的压力一般发生在分子的中心,并从内向外辐射[10-11]。研究表明超声不仅可以改变多糖的理化性质(分子质量、黏度、溶解度和流变性等),还可以提高多糖的生物活性,如抗氧化活性、抗肿瘤活性、抗炎活性[5-6,9-10]等。例如,Yan Jingkun等发现高强度超声波处理能够在短时间内降低桑黄菌丝多糖特性黏度和分子质量,而一级结构基本没有变化,同时降解多糖具有更高的羟自由基清除能力和总抗氧化能力[5]。Du Bin等利用超声波降解Schizophyllum commune菌丝胞外多糖,结果表明,与原多糖相比,降解多糖分子质量和黏度降低,抗炎活性显著提高[6]。目前,关于超声降解对黑加仑果实多糖的性质和生物活性影响的报道较少。因此,本实验利用超声波处理黑加仑果实多糖,制备两种不同分子质量多糖,对其理化性质、结构初步特征和体外生物活性进行研究,以期为探究黑加仑果实多糖构效关系提供参考。
1 材料与方法
1.1 材料与试剂
黑加仑(Ribes nigrum L.)为‘布劳德’成熟果实,由黑龙江省东北农业大学园艺站提供,-20 ℃冰箱真空密封冷藏备用。
木瓜蛋白酶 北京奥博星生物科技有限公司;果胶酶 上海蓝季生物科技有限公司;D4006型大孔吸附树脂 南开大学化工厂;大豆卵磷脂 天津市光复精细化工研究所;所用试剂均为分析纯。
1.2 仪器与设备
JY92-2D超声波细胞粉碎机 宁波新芝生物科技股份有限公司;WFJ-7200型可见分光光度计 上海尤尼柯仪器有限公司;UV-2700双光束紫外-可见分光光度计北京普析通用仪器有限责任公司;振动黏度计 日本Sekonic公司;FTS135型傅里叶变换红外光谱仪 美国Bio-Rad公司。
1.3 方法
1.3.1 黑加仑果实多糖的制备
根据课题组已探究的复合酶法制备多糖:黑加仑果实匀浆加入去离子水中,料液比为1∶20,加入木瓜蛋白酶0.3%(质量分数,下同)、果胶酶0.15%,50 ℃下水浴振荡50 min,然后沸水浴10 min后抽滤、浓缩,用3 倍体积的无水乙醇醇沉,4 ℃冰箱静置过夜,粉红色沉淀即为粗多糖。参考文献[8]的方法,使用D4006型大孔树脂对粗多糖溶液进行纯化。所得多糖溶液流水透析(截留分子质量为3 500 Da)48 h。将透析后的多糖溶液进行离心、浓缩、冷冻干燥,得到初步纯化的多糖样品,命名为原多糖(BFPs)。
1.3.2 黑加仑果实降解多糖的制备
利用超声波细胞粉碎机对BFPs溶液(5.0 mg/mL)进行降解。脉冲模式(开1 s、关1 s),超声温度不高于50 ℃,超声功率固定为700 W,降解时间分别为15 min和30 min。降解后多糖溶液经透析(截留分子质量为3 500 Da,48 h)、浓缩、冷冻干燥,得到两种降解多糖UM-15和UM-30。
1.3.3 超声降解对黑加仑果实多糖理化性质的影响
1.3.3.1 黏均分子质量
分别配制质量浓度为5.0 mg/mL的原多糖和降解多糖溶液,利用乌氏黏度法[5]测定其特性黏度[η],代入Mark-Houwink方程:lg[η]=0.314 6 lg Mv-0.190 7,即可得到降解前后黑加仑多糖的黏均分子质量(Mv)。
本实验Mark-Houwink方程确定方法如下:根据适合测定多糖Mv的Mark-Houwink非线性方程[η]=KMvα,得到公式lg[η]=lg K+αlg Mv,式中:[η]为特性黏度,Mv为黏均分子质量,K为比例常数,α为经验参数。
通过测定葡聚糖标准品(T-40、T-110、T-500、T-2000)特性黏度[η],以lg[η]-lg Mv作图,所得曲线斜率即为α值,截距即为lg K。
1.3.3.2 振动黏度
分别配制质量浓度为5.0 mg/mL的原多糖和降解多糖溶液,使用振动黏度计测量其振动黏度。
1.3.3.3 溶解度
参考Chen Jialun等的方法[12],并稍加修改。取多糖样品200 mg溶于5 mL的去离子水中,在室温下振荡搅拌24 h。混合物3 000 r/min离心30 min,然后将上清液除去。将剩余不溶物烘干,称质量。以上步骤每个样品重复3 次。溶解度按公式(1)计算。

1.3.3.4 组分分析
采用苯酚-硫酸法[13]测定总糖质量分数;利用二硝基水杨酸法[14]测定还原糖的质量分数;以葡萄糖醛酸为标准,采用咔唑-硫酸法[15]测定糖醛酸的质量分数;利用考马斯亮蓝法[16]测定蛋白质量分数;利用福林-酚法[17]测定多酚质量分数。
1.3.4 超声降解对黑加仑果实多糖结构的影响
1.3.4.1 傅里叶变换红外光谱分析
采用溴化钾压片法,对多糖BFPs,UM-15和UM-30在4 000~500 cm-1范围内进行傅里叶变换红外光谱扫描。
1.3.4.2 刚果红实验
参考Xu Yaqin等的方法[18],将BFPs、UM-15和UM-30与刚果红试剂分别配制成一系列不同NaOH浓度的反应体系,在400~700 nm波长范围内,利用紫外-可见分光光度计进行扫描,测定溶液的最大吸收波长。用去离子水代替多糖溶液作为空白对照组。
1.3.4.3 碘-碘化钾实验
向试管中加入2.0 mL多糖溶液(2.0 mg/mL),加入2 mL H2O,再加入1.2 mL碘-碘化钾试剂(含0.02%(体积分数,后同)I2的0.2% KI溶液),振荡混匀后,室温下在300~700 nm波长范围内扫描。
1.3.5 超声降解对黑加仑果实多糖生物活性的影响
参照文献[1 9]的方法,配制质量浓度分别为0.2、0.4、0.6、0.8、1.0、1.2 mg/mL的多糖溶液,测定多糖的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和·清除率。以VC作为阳性对照。
1.3.5.2 抗脂质过氧化实验
试液的配制:300 mg大豆卵磷脂超声辅助溶解于30 mL磷酸盐缓冲液(phosphate buffered saline,PBS)(10 mmol/L、pH 7.4)中,得到脂质体PBS分散系(lecithin liposome system,LLS)。将15.00 g三氯乙酸(trichloroacetic acid,TCA)、0.37 g硫代巴比妥酸(thiobarbituric acid,TBA)、2.10 mL浓盐酸依次加入100.0 mL水中,得到TCA-TBA-HCl混合液。
抗脂质过氧化能力的测定方法参照Yang Dong等的方法[20]并作稍许改动,分别于试管中加入1.0 mL LLS、1.0 mL 0.4 mmol/L硫酸亚铁、1.0 mL不同质量浓度的多糖样品并混合均匀。在避光条件下37 ℃水浴60 min,之后加入2.0 mL TCA-TBA-HCl混合液,并于100 ℃水浴15 min,立即冷却,以3 000 r/min离心10 min,取上清液在535 nm波长处测吸光度As。空白以1.0 mL去离子水代替1.0 mL样品,操作方法同上,可测得空白的吸光度Ac,以VC为阳性对照。按公式(2)计算抑制率。

式中:Ac为不加多糖样品溶液的脂质氧化体系的吸光度;As为加多糖样品溶液的脂质氧化体系的吸光度。

式中:A0为不加多糖样品溶液的吸光度;Aa为加入多糖样品溶液的吸光度;Ab为多糖溶液本身的吸光度。
1.4 数据处理与分析
所有实验数据均以3 次实验结果的平均值±标准差表示。采用Origin 8.0软件作图,并用SPSS 20.0软件进行差异显著性分析(单因素方差分析法),P<0.05表示差异显著。
2 结果与分析
2.1 黑加仑多糖的理化性质
由表1可知,随着降解时间延长,多糖的Mv显著降低(P<0.05),降解15 min时,Mv减少56.97%,降解时间延长到30 min时,Mv减少65.94%。同样地,在超声降解时间分别为15 min和30 min时,其振动黏度分别降低了11.86%和16.49%。显然,在一定范围内,延长超声作用时间,会提高多糖的降解程度。此结果与Hu Jielun等的研究结果[22]一致。该研究发现,超声波处理可以显著降低车前子种子多糖的分子质量和黏度等。溶解度测定结果表明,利用超声波处理黑加仑多糖可以显著增加样品的溶解度(P<0.05)。超声处理15 min后,多糖的溶解度增加了27.97%。当处理时间延长至30 min时,UM-30的溶解度增加了61.53%。这可能是由于大分子质量多糖的解聚并伴随着较短聚合链比例的增加,导致降解多糖的水合趋势增强和链间氢键数量减少[12]。

表1 多糖BFPs、UM-15和UM-30的理化性质Table 1 Physicochemical properties of BFPs, UM-15 and UM-30
此外,由表1可知,经过初步纯化后的多糖BFPs已经不含蛋白质和多酚。降解多糖UM-15和UM-30与BFPs的总糖质量分数不存在显著差异。但是,还原糖和糖醛酸质量分数显著增加(P<0.05),且呈时间-效应关系。还原糖质量分数增加说明超声波处理使多糖糖链发生断裂,多糖分子质量降低。而超声波处理后多糖中糖醛酸质量分数增加可能是超声波处理使位于多糖内部更多的糖醛酸暴露出来所致[23]。
2.2 黑加仑多糖的结构初步表征
2.2.1 傅里叶变换红外光谱分析结果

图1 BFPs、UM-15和UM-30的傅里叶变换红外光谱图Fig. 1 Fourier transform infrared spectra of BFPs, UM-15 and UM-30
由图1可以看出,BFPs及UM-15、UM-30均具有多糖的特征吸收且特征吸收峰位置基本相同,说明降解前后多糖分子的主要官能团没有变化。在3 400 cm-1处的峰为羟基O—H的伸缩振动吸收峰,2 907 cm-1附近的峰为C—H的伸缩振动吸收峰,1 730 cm-1附近的峰为酯化羰基C=O伸缩振动,1 603 cm-1附近的峰为羧基C=O的伸缩振动峰,此外1 430 cm-1处的吸收峰说明BFPs、UM-15和UM-30中均含有糖醛酸,在1 200~1 000 cm-1处存在的吸收峰说明降解前后多糖均为吡喃糖结构[4]。综上可知,超声波作用于黑加仑果实多糖后并没有改变基本结构。
2.2.2 刚果红实验分析结果
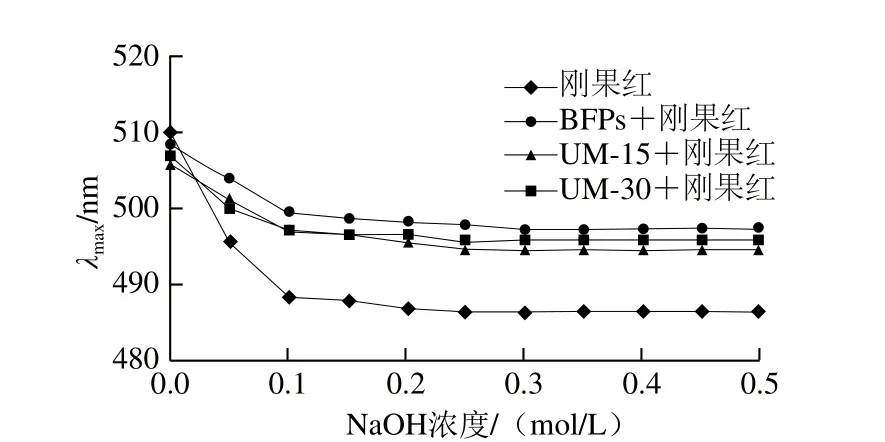
图2 不同NaOH浓度下多糖与刚果红络合物的最大吸收波长λmaxFig. 2 Maximum absorption wavelength of Congo red and Congo red-polysaccharides at various concentrations of NaOH
由图2可以看出,随着NaOH溶液浓度从0增大到0.5 mol/L,多糖BFPs及UM-15、UM-30与刚果红试剂作用产生络合物的最大吸收波长均呈现逐渐减小的趋势。最大吸收波长的连续下降可能是因为多糖在水溶液中为无规卷曲构象,且越来越多的氢键被碱性溶液破坏[24]。3 种多糖在水溶液中具有无规卷曲构象,可能归因于这些多糖较大的分子质量和复杂的单糖组成[25]。Mao等指出杂多糖不能形成三螺旋结构[26]。因此UM-15、UM-30和BFPs都不具有三股螺旋结构。
2.2.3 碘-碘化钾实验分析结果

图3 多糖BFPs及UM-15、UM-30的碘-碘化钾实验紫外-可见光谱图Fig. 3 Ultra violet-visible absorption spectra of BFPs, UM-15 and UM-30 reaction with iodine-potassium iodide
如图3所示,多糖BFPs及UM-15、UM-30与碘-碘化钾试剂的反应液在350 nm波长处均有强吸收峰,在565 nm波长处没有吸收峰,这说明多糖BFPs、UM-15和UM-30均具有复杂的链状结构,其侧链较长、支链较多[27]。综上可知,超声波并未改变黑加仑果实多糖的复杂分支结构。
2.3 黑加仑多糖的体外生物活性
2.3.1 清除DPPH自由基和O2-·能力
由图4、5可知,多糖BFPs、UM-15和UM-30在质量浓度0.2~1.2 mg/mL范围内,随着多糖质量浓度的增加,其对DPPH自由基和O2-·的清除作用增强,呈现明显的浓度依赖关系,且不同多糖清除自由基能力呈现显著差异(P<0.05)。在最大实验质量浓度(1.2 mg/mL)时,BFPs、UM-15和UM-30的DPPH自由基清除率达到最大值,分别为(85.02±2.32)%、(87.26±1.68)%、(9 0.1 8±0.6 6)%,低于V C的最大清除率(96.97±2.51)%,BFPs、UM-15、UM-30和VC的半抑制浓度(half maximal inhibitory concentration,IC50)分别为0.269、0.228、0.207 mg/mL和0.031 mg/mL。同时,BFPs、UM-15、UM-30和VC的最大·清除率和IC50分别为(52.87±2.08)%和1.193 mg/mL、(66.83±1.56)%和0.676 mg/mL、(71.43±0.25)%和0.269 mg/mL、(76.68±0.62)%和0.003 mg/mL。由此可见,清除DPPH自由基和·能力顺序为VC>UM-30>UM-15>BFPs。
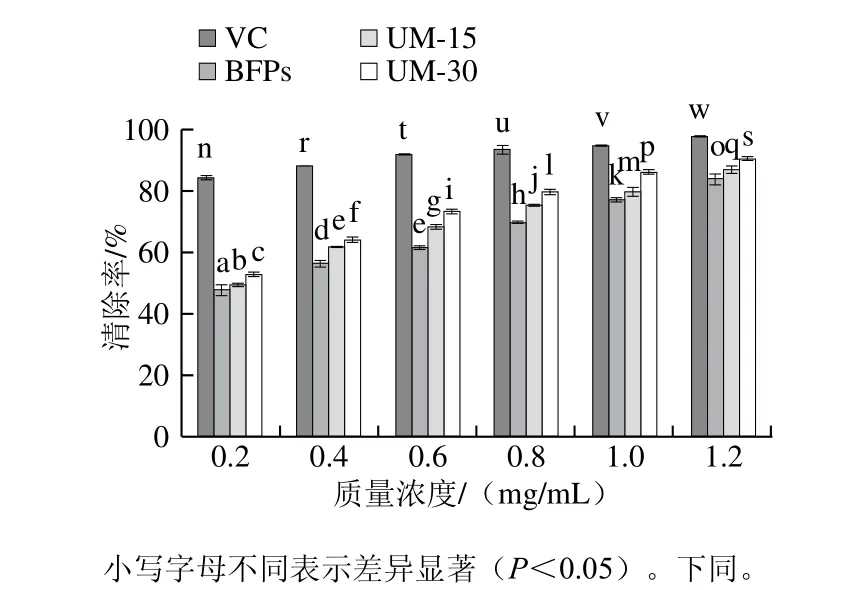
图4 BFPs、UM-15和UM-30对DPPH自由基的清除能力Fig. 4 DPPH radical scavenging capacity of BFPs, UM-15 and UM-30
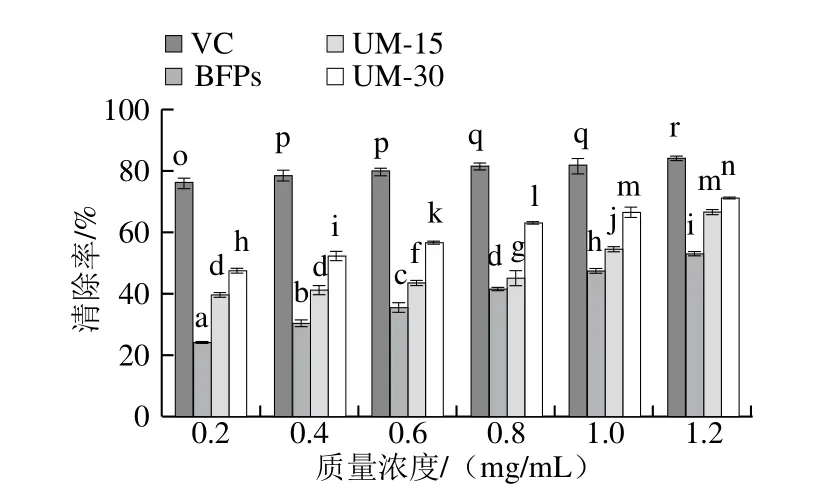
图5 BFPs、UM-15和UM-30对·的清除能力Fig. 5 Superoxide anion radical scavenging capacity of BFPs, UM-15 and UM-30
2.3.2 抗脂质过氧化能力
由图6可知,在质量浓度为0.2~1.2 mg/mL范围内,多糖BFPs、UM-15及UM-30对脂质过氧化的抑制作用均高于VC。随着多糖质量浓度的增加,3 种多糖对脂质过氧化的抑制作用均逐渐增强,且存在显著差异(P<0.05)。当质量浓度为1.2 mg/mL时,多糖对脂质过氧化的抑制效果达到最佳水平。此时,多糖BFPs、UM-15和UM-30的脂质过氧化抑制率分别为(44.44±0.22)%、(55.35±0.16)%、(65.83±0.67)%,分别是VC最大抑制率的1.60、1.99、2.36 倍。BFPs、UM-15、UM-30和VC的IC50分别为1.971、1.035、0.771 mg/mL和3.394 mg/mL。

图6 BFPs、UM-15和UM-30对脂质过氧化的抑制能力Fig. 6 Lipid peroxidation-inhibitory capacity of BFPs, UM-15 and UM-30
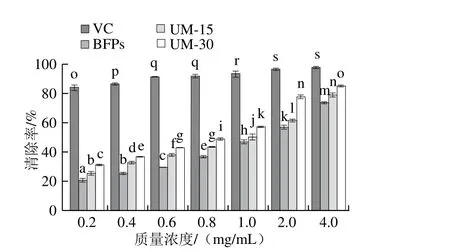
图7 BFPs、UM-15和UM-30对的清除能力Fig. 7 Nitrite ion scavenging capacity of BFPs, UM-15 and UM-30
由图7可以看出,在0.2~4.0 mg/mL范围内,BFPs、UM-15及UM-30对的清除率随着质量浓度增大而增强,且不同多糖对的清除能力存在显著差异(P<0.05)。质量浓度达4.0 mg/mL时,BFPs((73.08±1.25)%,IC50=1.384 mg/mL)、UM-15((78.65±0.58)%,IC50=0.990 mg/mL)及UM-30((84.46±1.43)%,IC50=0.697 mg/mL)的清除率达到最大,但仍低于VC的最大清除率((97.12±2.34)%,IC50=0.017 mg/mL)。
综上所述,超声波处理能够导致黑加仑果实多糖抗氧化活性显著提高。通常,活性物质的抗氧化作用归因于其供氢能力。Wang Junlong等研究发现,多糖中糖醛酸基团的存在可以触发异头碳的氢原子,发生抗氧化反应[28]。本实验结果表明超声波处理能够使黑加仑多糖中糖醛酸含量增加,提高多糖供给氢原子的能力,进而增加多糖的抗氧化活性,这与You Qinghong等研究结果一致[29]。另一方面,超声波处理能够使多糖分子质量降低,使位于多糖内核中的活性基团暴露,提供更多的活性位点与自由基反应,进而抑制氧化反应[23]。此外,本研究发现原多糖与降解多糖对DPPH自由基、O2-·的清除能力及抗脂质过氧化能力存在差异,这可能是由于多糖发挥不同抗氧化活性时作用机制是不同的。Sun Liqin[30]、Shi Meijia[31]等在研究原多糖与降解多糖抗氧化活性时得到与本实验一样的结论。关于天然多糖抗氧化活性作用机制及多糖在不同实验方法中抗氧化活性存在差异的原因有待进一步深入探讨。
3 结 论
本实验利用超声波降解黑加仑果实多糖,制备了两种不同分子质量多糖。研究结果表明,超声时间越长对多糖的理化性质(黏均分子质量、振动黏度、溶解度、还原糖含量和糖醛酸含量)的影响越显著;与原多糖相比,超声波处理并没有改变多糖的基本结构;此外,降解多糖对DPPH自由基、O2-·和NO2-的清除能力及对脂质过氧化的抑制作用均强于原多糖,且降解时间越长效果越好。因此,超声波是一种在不破坏多糖初级结构的条件下,有效地改善多糖的理化性质,并提高其生物活性的手段,而超声波处理的黑加仑果实多糖可能成为保障人类健康的天然抗氧化剂潜在来源。

