植物乳杆菌YW11杀菌型发酵乳调节肠道菌群结构
郝晓娜,罗天淇,张 健,赵 笑,余志坚,曹永强,杨贞耐,*
(1.北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京 100048;2.东君乳业(禹城)有限公司,山东 德州 253000)
人体胃肠道内寄居着种类繁多的微生物,肠道菌群能帮助宿主消化吸收食物中的营养物质,并代谢宿主肠道中产生的有毒废物,同时产生人体必需的氨基酸、维生素、短链脂肪酸等功能物质为宿主所用。肠道菌群被认为是调节宿主新陈代谢和免疫系统的“器官”[1]。越来越多的研究证明肠道菌群对人体的健康和生活起着复杂且至关重要的作用。许多研究表明肠道菌群与代谢综合征、炎症性肠病(inflammatory bowel disease,IBD)和结直肠癌等疾病有着密不可分的关系[2-3]。IBD是一种慢性易复发的肠道疾病,主要包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD)。
世界卫生组织和联合国粮食及农业组织专家组认为,摄入足量的益生菌有益于人体的健康,关注最多的是益生性乳酸菌,如乳杆菌和双歧杆菌[4]。乳酸菌的肠道调节作用被认为归因于有益肠道细菌的增加和有害细菌的减少[5],并且由有害细菌的增殖引起的腹泻可通过摄入含有乳酸菌的酸乳来缓解[6]。发酵乳被认为是益生菌的良好载体。Granata等[7]发现摄入含有鼠李糖乳杆菌的发酵制品能显著增加老年人肠道中乳杆菌的数量。Özcan等[8]研究发现发酵乳能显著増加人体肠道乳杆菌和双歧杆菌的数量,提高健康人群总厌氧菌中双歧杆菌的比例,显著降低有害产气荚膜梭菌的数量。孙建华等[9]研究表明双歧杆菌BB12活菌型发酵乳能促进双歧杆菌和乳杆菌的增殖,降低肠杆菌和肠球菌的数量。发酵乳不仅可以增加肠道内乳杆菌的数量,而且可以在一定程度上促进小鼠排便[10]。发酵乳能提高便秘小鼠的肠道推进率,有效地改善便秘问题[11]。
关于活菌型发酵乳对肠道菌群的作用研究比较多,但是对巴氏杀菌发酵乳的研究相对较少。作为具有良好益生特性的植物乳杆菌菌株,当被用于发酵牛乳饮料生产时,它不仅显示出在产品中的高存活率,而且摄入后具有对胃酸和胆汁酸的良好耐受性,能抑制肠道有害细菌的增殖,有助于肠道菌群的平衡[12]。本实验研究具有耐酸性、耐胆盐、降低胆固醇作用[13]的益生性植物乳杆菌YW11发酵液对常见病原菌的抑制作用,并将该菌株作为发酵剂应用于巴氏杀菌发酵乳的制备,通过体外模拟人体消化模型,与人体粪便共培养,考察巴氏杀菌发酵乳对人体肠道菌群结构的影响,旨在为益生性巴氏杀菌发酵乳的研发提供理论依据。
1 材料与方法
1.1 材料与试剂
植物乳杆菌YW11分离于西藏灵菇样品,乳双歧杆菌由北京工商大学乳制品实验室保藏。沙门氏菌22956、福氏志贺氏菌21534、阪崎肠杆菌21544、动物双歧杆菌21709 中国工业微生物菌种保藏管理中心;李斯特氏菌ATCC19115、金黄色葡萄球菌CMCC26071、大肠杆菌CMCC44825 广东微生物菌种保藏中心。
MRS培养基、LB培养基、肉汤培养基、BHI培养基、PTYG培养基、BCM培养基 北京奥博星生物技术有限责任公司;DNA提取试剂盒 美国Omega公司。
1.2 仪器与设备
705型-80 ℃超低温冰箱 美国Thermo Electron公司;MLS-3750高压蒸汽灭菌锅 日本Sanyo公司;BCN-1360B超净工作台 北京东联哈尔仪器制造有限公司;HZQ-Q恒温培养箱 上海一恒实验设备有限公司;U-3900紫外-可见分光光度计 日本Hitachi公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪美国Bio-Rad公司。
1.3 方法
1.3.1 植物乳杆菌YW11抑菌作用的测定
指示菌的活化:将沙门氏菌22956、福氏志贺氏菌21534、阪崎肠杆菌21544、大肠杆菌CMCC44825以体积分数3%接种在LB培养基中,37 ℃培养24 h。将李斯特氏菌ATCC19115、金黄色葡萄球菌CMCC26071以体积分数3%分别接种在BHI培养基、肉汤培养基中,37 ℃培养24 h。将动物双歧杆菌21709以体积分数3%的接种在PTYG培养基中,37 ℃厌氧培养18 h。活化两代后备用。
植物乳杆菌YW11上清液制备:植物乳杆菌YW11在MRS液体培养基中活化两代后,5 000 r/min离心10 min,取上清液过0.22 μm无菌滤膜备用。
植物乳杆菌抑菌活性的测定:根据Dasari等[14]的方法稍作修改。向96 孔板中加入100 μL的LB、BHI、PTYG、肉汤培养基,取活化的指示菌,以体积分数3%接种在相应的培养基中。取100 μL菌株YW11上清液加入到96 孔板中,对照组加入100 μL MRS培养基。37 ℃培养24 h,在600 nm下测定吸光度。抑菌率的计算见公式(1)。

式中:A0为对照组的吸光度;A1为样品组的吸光度。
1.3.2 巴氏杀菌发酵乳对肠道菌群的影响
1.3.2.1 实验分组
实验分组如表1所示。

表1 巴氏杀菌发酵乳对肠道菌群影响的实验分组Table 1 Experimental grouping and sampling schemes
1.3.2.2 巴氏杀菌发酵乳的制备
植物乳杆菌YW11按照体积分数3%接种于MRS培养基中,37 ℃培养18 h活化两代后备用。
全脂乳预热至60~75 ℃,40 MPa下均质,95 ℃杀菌5 min,冷却至42 ℃并按体积分数5%将活化两代后的植物乳杆菌YW11接入全脂乳中,于42 ℃下发酵至pH 4.5,迅速置于68~70 ℃水浴锅中,并保持此温度30 min后急速冷却到4 ℃,制成巴氏杀菌发酵乳,样品于4 ℃冷藏备用。
1.3.2.3 巴氏杀菌发酵乳的体外模型消化处理
采用Jin Yan等[15]的方法并稍作修改,10 mL的巴氏杀菌发酵乳与等体积的35 mmol/L NaCl溶液混合,用HCl调至pH 2.0,以胃蛋白酶与底物质量比1∶100加入胃蛋白酶,37 ℃水解1 h。然后用NaOH溶液调至水解液pH 7.0,以胰蛋白酶与底物质量比1∶100加入胰蛋白酶,37 ℃消化1 h制得消化后的样品。
1.3.2.4 粪悬液的制备
于实验当天采集健康成人(2男1女,年龄20~28 岁)粪便,志愿者能够提供14 d内的体检报告,无肠道和慢性代谢疾病,90 d内未服用抗生素,正常饮食,无饮酒、中药。往50 mL离心管中预先加入20 mL PBS,称质量并记录。迅速挖采足够的中段粪便样品(至少15 g)放入离心管中,漩涡振荡混匀后称质量,用质量差法计算需要再添加的PBS质量,粪悬液终体积分数为20%。在厌氧工作站中添加PBS,用两层纱布滤去大颗粒残渣,用小烧杯收集滤液,于2 h内完成粪悬液的处理[16]。
1.3.2.5 巴氏杀菌发酵乳与健康人体粪便共培养
取消化后的样品1 mL与0.5 mL的粪悬液混合,加入3.5 mL BCM培养基形成培养体系,将所有体系置于厌氧工作站,37 ℃恒温,站内气体组成为体积分数80% CO2、10% N2和10% H2,相对湿度75%,分别培养4、12 h取样。空白组加入和样品等体积的PBS。
1.3.2.6 16S rRNA测定菌群组成多样性
选用QIAamp DNA Stool Mini Kit试剂盒提取培养物中的总DNA,并通过质量分数0.8%琼脂糖凝胶电泳检测DNA提取质量,同时采用紫外分光光度计对DNA进行定量。以稀释后的基因组DNA为模板,使用Q5高保真DNA聚合酶进行PCR扩增,PCR扩增产物通过质量分数2%琼脂糖凝胶电泳进行检测,并采用AXYGEN凝胶回收试剂盒对目标片段进行切胶回收。参照电泳初步定量结果,将PCR扩增回收产物进行荧光定量,根据荧光定量结果,按照每个样本的测序量需求,对各样本按相应比例进行混合。使用Illumina MiSeq系统进行上机测序,采用TruSeq Nano DNA LT Library Prep Kit制备测序文库,以97%的序列相似度作为运算分类单元(operational taxonomic units,OTU)划分阈值,和NCBI进行BLAST比较。
通过QIIME软件分别对每个样本计算Chao1指数、ACE指数、Shannon指数和Simpson指数。Chao1指数(SChao1)通过计算群落中只检测到1 次和2 次的OTU数目,估计群落中实际存在的物种数,如式(2)所示计算。ACE指数(Sace)用来估计群落中含有OTU数,由Chao[17]提出,是生态学中估计物种总数的常用指数之一,如式(3)所示计算。Shannon指数(HShannon)包含物种和各种间个体分配的均匀性两个部分,如式(4)所示计算。Simpson指数(DSimpson)为随机抽取的两个个体属于不同种的概率,如式(5)所示计算。
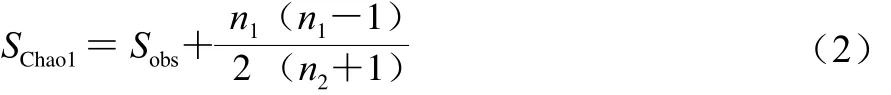
式中:Sobs为实际测量出的OTU数;n1为只含有一条序列的OTU数;n2为只含有两条序列的OTU数。
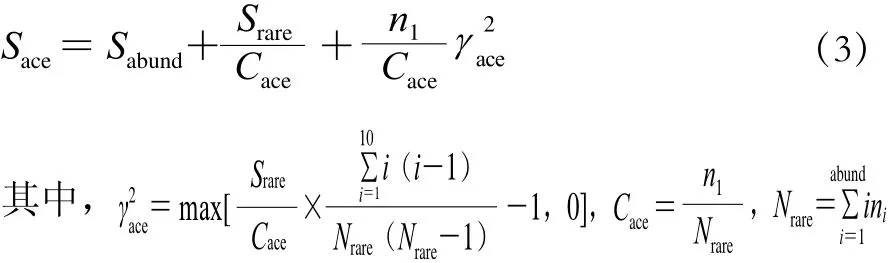
式中:ni为含有i条序列的OTU数;Srare为含有不超过“abund”条序列的OTU数;Sabund为多于“abund”条序列的OTU数;abund为“优势”OTU的阈值,默认为10。

式中:Sobs为实际测量出的OTU数;ni为含有i条序列的OTU数;N为所有的序列数。

式中:Sobs为实际测量出的OTU数;ni为含有i条序列的OTU数;N为所有的序列数。
1.4 数据统计与分析
2 结果与分析
2.1 植物乳杆菌YW11发酵液的抑菌作用
益生菌对常见疾病的疗效作用是微生物群落研究中最具有前景的领域之一。植物乳杆菌YW11发酵液对常见病原菌如沙门氏菌22956、福氏志贺氏菌21534、阪崎肠杆菌21544、李斯特氏菌ATCC19115、金黄色葡萄球菌CMCC26071、大肠杆菌CMCC44825和益生菌双歧杆菌的抑菌率分别为23.94%、10.81%、6.07%、34.18%、13.25%、3.33%、2.35%(图1)。其中李斯特氏菌和金黄色葡萄球菌属厚壁菌门,大肠杆菌和沙门氏菌属变形菌门。
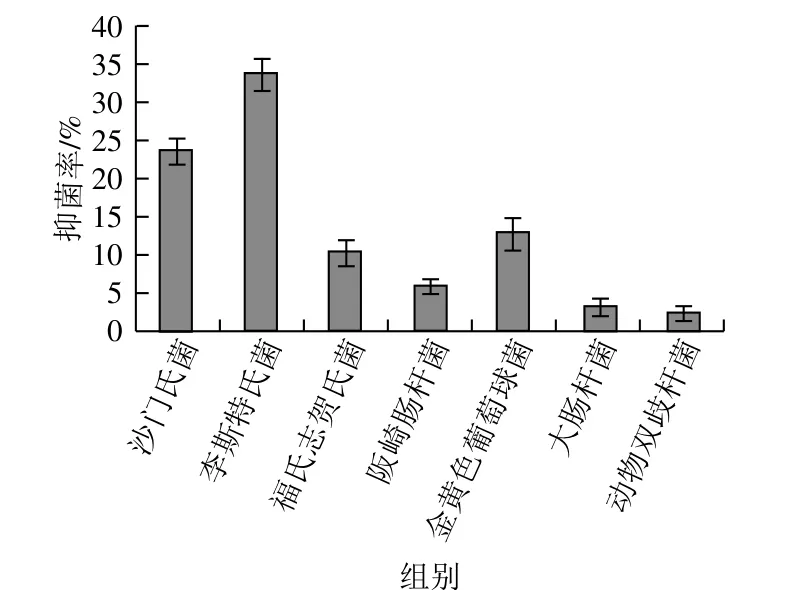
图1 植物乳杆菌YW11发酵液对常见病原菌和双歧杆菌的抑菌作用Fig. 1 Inhibition rates of common pathogenic bacteria and Bifidobacteria by the fermenteation supernatant of L. plantarum YW11
据报道,沙门氏菌可引起慢性肠炎,多发生在幼儿和老年人群中。阪崎肠杆菌感染可引起小肠结肠炎,感染的大多数为婴儿,特别是早产儿、出生体质量偏低等身体状况较差的新生儿。一旦感染李斯特氏菌,患者会出现发烧、肌肉疼痛、恶心、腹泻等症状,但这种疾病不会迅速发病,具有一定的潜伏期。福氏志贺氏菌的菌毛能黏附于结肠黏膜的上皮细胞表面,继而在侵袭蛋白作用下穿入上皮细胞内;其产生的内毒素能作用于肠壁,破坏黏膜,形成炎症、溃疡,出现典型的脓血黏液便。金黄色葡萄球菌能够产生数种引起急性肠炎的蛋白质和肠毒素,分为A、B、C1、C2、C3、D、E及F 8 种血清型,对肠道破坏性大。大肠杆菌在不致病的情况下与人体互利共生,它寄生在人体大肠和小肠里,不但不会给人们的身体健康带来任何危害,反而可以帮助人体合成VK2,但在机体免疫降低、肠道缺乏刺激等特殊情况下会造成感染。某些大肠杆菌能侵入大肠、小肠黏膜,引起溃疡甚至出血,血清型大肠杆菌可引起人类腹泻。本研究植物乳杆菌YW11发酵液对上述病原菌均有不同程度的抑制作用,表明植物乳杆菌YW11发酵液对肠道菌群可能存在潜在的调节作用。YW11发酵液对动物双歧杆菌也表现出抑制作用,可能的原因是动物双歧杆菌为产酸性益生菌,植物乳杆菌发酵降低了培养体系中的pH值,对动物双歧杆菌的生长有抑制作用。
2.2 巴氏杀菌发酵乳对肠道菌群的影响
2.2.1 菌群α多样性分析

图2 巴氏杀菌发酵乳对肠道菌群OTU数的影响Fig. 2 Rarefaction curves of operational taxonomic unit (OTU) number
通过对肠道菌群微生物进行OTU划分,并绘制稀释曲线(图2)。一方面,稀释曲线越来越平缓,说明当前测序的深度足以反映该样品中所包含的物种的多样性;另一方面,稀释曲线可以反应同一测序深度下不同样品中物种的多样性。由图2可知,YW11组和对照组分别进行体外粪便共培养4 h和12 h的稀释曲线均高于空白组,说明相同的测序深度下,YW11组和对照组样品中OTU数多于空白组,共培养12 h后市售巴氏杀菌发酵乳对肠道菌群多样性的改善作用略优于YW11巴氏杀菌发酵乳。
评定肠道菌群α多样性的指数有Chao1指数、ACE指数、Shannon指数和Simpson指数。Chao1指数和ACE指数侧重于表示群落的丰富度,其值越大,群落的丰富度越高。Shannon指数和Simpson指数综合考虑群落的丰富度和均匀度,其值越大,群落的多样性越高。从图3可知,经消化的植物乳杆菌巴氏杀菌发酵乳和市售巴氏杀菌发酵乳与人体粪便共培养4、12 h之后,样品组Chao1指数和ACE指数高于空白组,说明植物乳杆菌巴氏杀菌发酵乳和市售巴氏杀菌发酵乳能够增加肠道菌群的丰富度。Shannon指数和Simpson指数组间无显著性差异(P>0.05)。许多研究发现,肠道菌群多样性的下降与IBD炎症的产生密切相关[18]。因此,在一定程度上,巴氏杀菌发酵乳能通过增加肠道菌群的多样性缓解IBD炎症的症状。

图3 巴氏杀菌发酵乳对肠道菌群多样性指数的影响Fig. 3 Effect of the pasteurized fermented milk on species diversity index of the intestinal flora
2.2.2 菌群的结构分析

图4 巴氏杀菌发酵乳对肠道菌群门水平结构的影响Fig. 4 Classification and composition of bacterial populations at the phylum level
人类肠道中能够检测并明确的菌群很少,主要包括拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)四大类[19]。本实验对OTU在每个门的数量进行了统计,结果如图4所示。厚壁菌门、放线菌门、拟杆菌门和变形菌门占总细菌数量的99.95%以上。每个样品中厚壁菌门和拟杆菌门的总丰度无差异(P>0.05),放线菌门和变形菌门的总丰度无差异(P>0.05),说明巴氏杀菌发酵乳通过调节厚壁菌门和拟杆菌门、放线菌门和变形菌门内部的结构调节肠道菌群。对照组和YW11组的发酵乳与粪便共培养4、12 h后,厚壁菌门的相对丰度增加,其中YW11组的增加率分别为24.94%、4.86%;变形菌门的相对丰度降低,其中YW11组的减少率分别为2.11%、7.32%。Frank等[20]研究结果显示,在IBD患者的肠道中厚壁菌门的丰度减少,变形菌门的丰度增加。对照组和YW11组的发酵乳与粪便共培养4、12 h后,拟杆菌门的相对丰度减少,其中YW11组的减少率分别为18.27%、13.51%;放线菌门的相对丰度增加,其中YW11组的增加率分别为7.36%、3.03%。放线菌门中含有双歧杆菌益生菌,其丰度增加有可能对人体的健康有益。厚壁菌门包括产短链脂肪酸的菌属和李斯特氏菌等致病菌,短链脂肪酸有利于抑制肠道中病原菌的生长,但李斯特氏菌是致病菌,所以,厚壁菌门丰度的增加并不能说明巴氏杀菌发酵乳对肠道菌群存在有益的作用,只能说明巴氏杀菌发酵乳在门水平上调节了肠道菌群的结构。
2.2.3 YW11巴氏杀菌发酵乳对肠道菌群组成的影响
为了研究巴氏杀菌发酵乳对肠道菌群在属水平上的调节作用,本研究对聚类到每个属的菌群进行了统计分析。从图5可以看到,对照组和YW11组主要增加了高丰度菌落的丰度,但是这种影响的利弊无法解释,因此对每个门中含有的高丰度菌属及常见菌属进行统计分析。
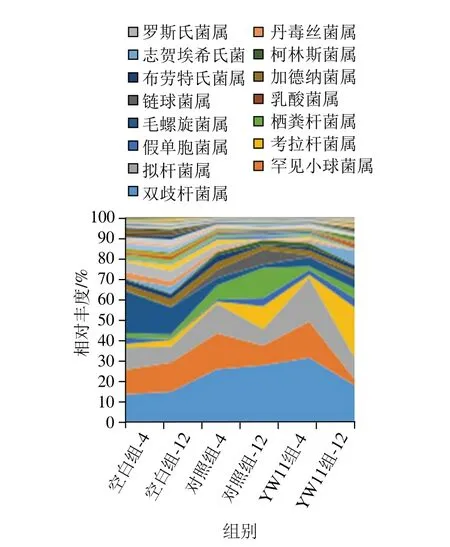
图5 巴氏杀菌发酵乳对肠道菌群属水平结构的影响Fig. 5 Classification and composition of bacterial populations at the genus level
2.2.3.1 厚壁菌门中菌群的组成
厚壁菌门中毛螺旋菌属(Lachnospira)、罕见小球菌属(Subdoligranulum)、罗斯氏菌属(Roseburia)、栖粪杆菌属(Faecalibacterium)、考拉杆菌属(Phascolarctobacterium)、瘤胃球菌属(Ruminococcus)和布劳特氏菌属(Blautia)可以产生短链脂肪酸。其中,毛螺旋菌、罗斯氏菌属和瘤胃球菌属可产生丁酸[21],丁酸盐是结肠上皮最好的氧化底物,占结肠细胞氧耗量的80%[22];丁酸盐还能通过降低环氧合酶、过氧化物酶的表达,减轻炎症反应,抑制组蛋白去乙酰化及核因子κB活化,保护肠黏膜屏障[23]。丁酸水平降低参与了IBD炎症的起始和加重过程[24]。Rehman等[25]研究发现CD患者肠道中毛螺旋菌属、罗斯氏菌属、瘤胃球菌属和布劳特氏菌属的含量减少。从图6可知,YW11组相比空白组,在与粪便共培养4 h后,毛螺旋菌属、罗斯氏菌属和瘤胃球菌属的相对丰度增加率分别为3.00%、0.55%、0.33%;在与粪便共培养12 h后,毛螺旋菌属、罗斯氏菌属和瘤胃球菌属的相对丰度增加率分别为3.14%、0.54%、0.47%。说明巴氏杀菌发酵乳YW11能够提高肠道中产丁酸菌属的丰度,对人体的健康有益。

图6 巴氏杀菌发酵乳对厚壁菌门中菌群在属水平结构的影响Fig. 6 Composition of Firmicutes at the genus level
Christopher等[26]研究结果显示CD患者肠道微生物中栖粪杆菌属(Faecalibacterium)的含量减少。本实验中YW11组相比空白组,在分别与粪便共培养4 h和12 h后,栖粪杆菌属相对丰度分别增加了0.41%、2.65%。Morgan等[27]研究结果显示CD患者肠道微生物中考拉杆菌属(Phascolarctobacterium)的含量减少。本实验中YW11组相比空白组,在分别与粪便共培养4 h和12 h后,考拉杆菌属相对丰度分别增加了0.06%、1.76%。Rajilić-Stojanović等[28]研究发现UC患者肠道微生物中链球菌属(Streptococcus)含量增加。本实验中YW11组相比空白组,在与粪便共培养4 h和12 h后,链球菌属相对丰度分别减少了0.06%、0.14%。人感染丹毒丝菌属(Erysipelotrichaceae)会引发一种“类丹毒”病,本实验中YW11组相比空白组,在与粪便共培养4 h和12 h后,丹毒丝菌属相对丰度分别减少了1.96%、2.10%。但是,Gevers等[29]研究了447 例新发CD的儿童患者和221 例健康人群粪便菌群,发现CD的儿童患者粪便菌群丹毒丝菌丰度降低。大部分菌属丰度的变化趋于缓解IBD症状的方向,因此可说明巴氏杀菌发酵乳对调节人体肠道菌群有益。
肠道菌群中乳杆菌(Lactobacillus)可保持肠黏膜结构完整性,阻止致病菌及毒素等物质通过,保证肠壁屏障作用不受损害。有大量研究对厚壁菌门中乳酸菌的结果并不一致[30]。文献[31]报道乳杆菌可以通过树突状细胞介导Treg细胞的分化,使Treg细胞分泌较高水平的白细胞介素(interleukin,IL)-10来发挥其对IBD的治疗效应。IL-10可通过抑制IL-1、IL-6、IL-12、肿瘤坏死因子(tumor necrosis factor,TNF)等促炎因子的释放来保持肠道黏膜完整性,防止IBD的发生与恶化。因此,调节肠道菌群结构、维持肠道微生态的平衡、增强肠黏膜免疫功能在IBD的治疗中就显得尤为重要。肠道菌群中的Lactobacillus reuterii可将色氨酸转变成3-吲哚甲酸,这种物质能够刺激芳香族化合物受体的表达,进而减轻炎症反应[32]。本实验中YW11组与空白组相比,在与粪便共培养4 h和12 h后,乳杆菌属相对丰度分别增加了0.13%、0.31%。
2.2.3.2 拟杆菌门中菌群的组成
与厚壁菌门不同,研究者对拟杆菌门丰度在IBD患者中丰度的变化得出不一致的结果,文献[33]提示拟杆菌门在IBD患者的肠道菌群中丰度有所增加,但其多样性减少;也有研究发现IBD患者肠道菌中拟杆菌属(Bacteroides)丰度减少[34];多数研究表明,拟杆菌属是保护性细菌,可以通过下调炎性因子、刺激抑炎因子以及调节黏膜屏障功能和通透性等一系列机制保护宿主,避免其发生炎症反应[35]。如图7所示,相比空白组,在与粪便共培养4 h和12 h后,YW11组拟杆菌属丰度分别增加了7.78%、4.10%。

图7 巴氏杀菌发酵乳对拟杆菌属丰度的影响Fig. 7 Effect of the pasteurized fermented milk on abundance of Bacteroidetes
2.2.3.3 放线菌门中菌群的组成
肠道菌群中的双歧杆菌(Bifidobacterium)可保持肠黏膜结构完整性,阻止致病菌及毒素等物质通过,保证肠壁屏障作用不受损害[36]。双歧杆菌有助于脂肪的消化吸收,一旦肠道内双歧杆菌比例降低,则容易诱发炎症反应,发生免疫缺陷性脂泻病。Zhuang Xiaojun等[37]发现,中国肠易激综合征患者肠道中双歧杆菌丰度显著减少[38]。在动物模型中,给予双歧杆菌治疗可减轻机体的炎症水平,取得理想疗效。如图8所示,YW11组相比对照组,在与粪便共培养4 h和12 h后,双歧杆菌属丰度分别增加了18.09%、7.48%。有研究发现柯林斯菌属(Collinsella)在CD患者回肠中的含量减少[39]。YW11组相比对照组,在与粪便共培养4 h和12 h后,柯林斯菌属相对丰度分别增加了0.72%、0.80%。Wang Wei等[40]发现肠杆菌(Enterorhabdus)16S rRNA基因拷贝数的升高与硫酸葡聚糖诱导小鼠的IBD疾病活动性有关。Chassaing等[41]也得出一致的结论。YW11组相比对照组,在与粪便共培养4 h和12 h后,肠杆菌属的相对丰度分别减少了0.01%、0.01%。
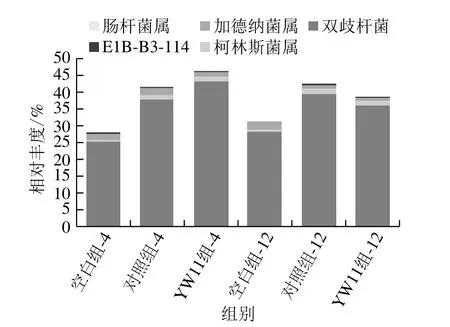
图8 巴氏杀菌发酵乳对放线菌门中菌群在属水平结构的影响Fig. 8 Composition of Actinobacteria at the genus level
2.2.3.4 变形菌门中菌群的组成
关于变形菌门中菌群与IBD关系报道的较少。Eun等[42]研究发现CD患者的肠道微生物中假单胞菌属(Pseudomonas)的含量增加。在UC复发之前,正常厌氧菌埃希菌属数量下降,同时,肠道微生物的多样性减少[43]。如图9所示,YW11组相比对照组,在分别与粪便共培养4 h和12 h后,假单胞菌属的相对丰度减少,减少量分别为1.05%、1.05%;志贺埃希氏菌(Escherichia-Shigella)的丰度分别减少了0.14%、0.10%。
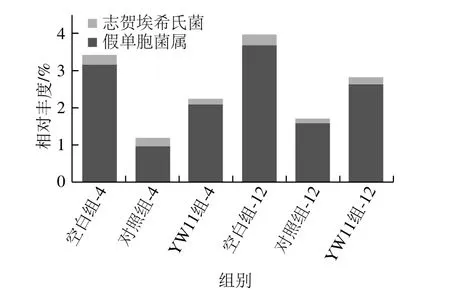
图9 巴氏杀菌发酵乳对变形菌门中菌群在属水平结构的影响Fig. 9 Composition of Proteobacteria at the genus level
2.2.4 物种β多样性分析
为了研究消化后的巴氏杀菌发酵乳在肠道中的停留时间及巴氏杀菌乳样品对肠道菌群组成的影响,对肠道菌群进行冗余分析。图10所示,第1、2主成分对菌群的影响所能解释的比例分别为43.7%、20.7%。培养时间、巴氏杀菌发酵乳环境因子和第1主成分的相关系数分别为0.659 7、0.801 9,其方向代表该因素对菌群影响的取向,长短代表对菌群影响的大小。培养4 h的样品和培养12 h的样品在培养时间影响因素的投影上长度一致,说明模型合理。菌群与培养时间、巴氏杀菌发酵乳环境因子射线的夹角及投影分别反应了培养时间因素、巴氏杀菌发酵乳环境因子对该菌群影响的相关性和大小。经过分析得出,71.43%的菌群与培养时间呈正相关关系,即随着培养时间的延长,菌群的丰度增大;28.57%的菌群与培养时间呈负相关关系。45.71%的菌群与巴氏杀菌发酵乳环境因子呈正相关关系,即巴氏杀菌发酵乳能增加其丰度;54.29%的菌群与巴氏杀菌发酵乳环境因子呈负相关关系。
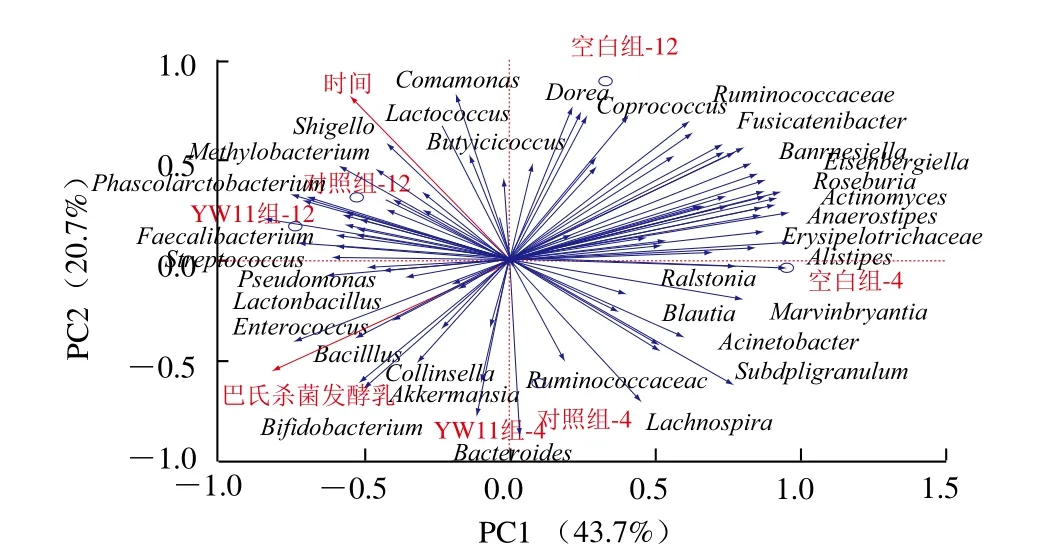
图10 肠道菌群的冗余分析Fig. 10 Redundancy analysis of the intestinal flora
3 结 论
植物乳杆菌YW11发酵液对沙门氏菌、阪崎肠杆菌、李斯特氏菌、金黄色葡萄球菌、大肠杆菌、志贺氏菌有不同程度的抑制作用。将益生性植物乳杆菌YW11应用于巴氏杀菌发酵乳中能增加肠道微生态中菌群的丰富度和多样性。在门水平,巴氏杀菌乳能增加厚壁菌门的丰度,减少变形菌门的丰度。在属水平,整体看来,巴氏杀菌发酵乳能增加肠道中45.71%菌群的丰度,主要调节高丰度菌群;具体来看,巴氏杀菌发酵乳提高了产丁酸的毛螺旋菌属、罗斯氏菌、瘤胃球菌属及乳酸菌属和双歧杆菌的丰度,对人体的健康有益。同时,巴氏杀菌发酵乳增加了与缓解IBD炎症相关的拟杆菌属、粪栖杆菌、考拉菌属、柯林斯菌属的丰度,减少了与诱发IBD炎症相关的丹毒丝菌属、假单胞菌属、志贺埃希氏菌的丰度。因此,巴氏杀菌发酵乳对肠道菌群结构有调节作用。本实验结果可为益生性乳酸菌发酵乳的研发提供依据。

