植物甾醇酯对非酒精性脂肪肝大鼠肝脏部分代谢物的影响
欧阳鹏凌,管 玘,曲 丹,丁信文,宋立华,3,*
(1.上海交通大学农业与生物学院,上海 200240;2.上海市第七人民医院营养科,上海 200137;3.上海交通大学陆伯勋食品安全研究中心,上海 200240)
非酒精性脂肪肝病(nonalcoholic fatty liver,NAFLD)是代谢综合征在肝脏中的表现[1]。随着肥胖及其相关代谢综合征的全球化流行趋势,NAFLD现已成为欧美等发达国家和我国富裕地区慢性肝病的重要病因。流行病学调查结果显示,在世界范围内NAFLD的患病率为6%~33%,在我国其发病率约为15%[2]。NAFLD发生初期,通过调整饮食和加强运动,肝脏的脂肪变性会逆转,但若任其发展,其中有10%~20%会逐渐发展为非酒精性脂肪性肝炎,其10 年内肝硬化发生率高达25%[3];此外,NAFLD还与2型糖尿病、心血管疾病的发生密切相关,因此,NAFLD已成为21世纪世界范围内的一个重要的公共健康问题。
肝脏是人体最大的代谢器官,参与糖、脂类、蛋白质等的代谢过程,在物质代谢过程中发挥枢纽作用[4]。当肝脏出现脂肪病变时,必然会导致相关代谢通路发生变化[5]。由于各物质代谢通路的复杂性,只有利用代谢组学方法分析才能反映病理状态下机体代谢产物的整体性变化[6]。蒋华军[7]研究发现与正常对照相比,NAFLD大鼠肝脏组织代谢物中脂类、氨基酸类以及糖类的含量均出现明显变化;另有研究对NAFLD患者血液进行代谢组学检测,发现糖类、脂类、氨基酸类及胺类化合物等11 种差异代谢物[8]。黄海军[5]对肝病患者粪便做代谢组学检测,结果显示胆汁酸类、胆素原类以及胆碱类等与正常组相比有明显变化。这些差异代谢物的检出为NAFLD的预防、诊治及其相关机制的研究提供了新思路。
植物甾醇(phytosterols,PS)是一类存在于食物中的天然化合物[9],其酯化产物即植物甾醇酯(phytosterol esters,PSE)具有较好的溶解特性。前期研究发现PSE可显著减轻NAFLD大鼠肝脏的脂肪变性程度[10]。为进一步研究PSE干预后如何影响肝脏代谢物的变化,本实验拟在前期研究基础上,利用高脂饮食诱导建立NAFLD大鼠模型,同时通过灌胃不同剂量PSE连续干预12 周后,检测肝脏总脂肪含量,利用超高效液相色谱-四极杆串联飞行时间质谱(ultraperformance liquid chromatography tandem time-of-fight mass spectrometry,UPLC-Q-TOF-MS)技术检测PSE对NAFLD大鼠肝脏小分子代谢物的影响,从代谢组学的角度进一步阐明PSE有效预防NAFLD的机制。
1 材料与方法
1.1 动物、材料与试剂
6 周龄雄性清洁级SD大鼠,体质量(170±10)g,购自上海斯莱克实验动物有限公司(生产许可证号:SCXK(沪)2012-0002)。大鼠饲料由福贝世亨生物医药(上海)有限公司提供,基础饲料组成:粗蛋白≥20%(质量分数,下同)、水分≤10%、灰分≤8%、粗纤维≤5%、粗脂肪≥4%、钙1%~1.8%、赖氨酸1.32%、磷0.6%~1.2%、蛋氨酸+胱氨酸0.78%;高脂饲料组成:繁殖鼠饲料52.65%、猪油21%、蔗糖10%、酪蛋白10%、麦芽糊精2.7%、预混料1.9%、胆固醇1.25%、胆盐0.5%。
植物甾醇酯(植物甾醇和植物甾醇酯≥97%,其中游离植物甾醇≤6%、总植物甾醇≥59%、植物甾醇酯≥91%;甾醇的组成:β-谷甾醇42.0%~55.0%、菜油甾醇20.0%~29.0%、豆甾醇12.0%~23.0%、菜籽甾醇≤6%、D5-燕麦甾醇≤4%、胆甾醇≤2%、D7-燕麦甾醇≤2%、D7-豆甾烯醇≤2%、其他≤5%)由巴斯夫中国有限公司提供。
分析纯氯仿、甲醇均购于国药集团化学试剂有限公司。
1.2 仪器与设备
Acquity UPLC I-Class系统(由二元泵、真空脱气机、自动进样器和柱温箱组成)、VION IMS Q-TOF-MS仪美国Waters公司。
1.3 方法
1.3.1 灌胃用PSE强化牛奶的制备
将PSE产品于65 ℃水浴中液化,与纯牛奶混合并通过高压均质乳化,得到PSE质量浓度分别为0.05、0.10 g/mL的PSE强化牛奶。
1.3.2 实验动物分组与样本收集
大鼠适应性喂养1 周后随机分为4 组:正常对照组(NC,n=4)、高脂模型组(HF,n=9)、低剂量PSE组(PSE-L,n=9)和高剂量PSE组(PSE-H,n=9)。NC组大鼠进食基础饲料,其余各组进食高脂饲料。NC和HF组灌胃给予等体积普通脱脂牛奶,低(0.05 g/(100 g·d mb))、高剂量(0.1 g/(100 g·d mb))PSE干预组分别灌胃给予上述PSE强化牛奶(相当于成人3 g/d和6 g/d的摄入量),连续灌胃12 周。饲养环境条件:室温为(25±1)℃,相对湿度为45%~65%,12 h明暗轮换采光,大鼠可自由进食及饮水。期间每天记录各组大鼠摄食量,每周称量记录其体质量。实验结束后,腹腔注射2%戊巴比妥钠,按剂量40 mg/kg麻醉大鼠后取出大鼠肝脏,用生理盐水漂洗干净,分装并迅速于液氮中冷冻,然后转移至-80 ℃低温冰箱中贮存备用,本实验检测选取肝右叶同一部位。
1.3.3 肝脏总脂肪含量测定
称取1 g肝脏组织样品,加入8 mL氯仿-甲醇溶液(体积比2∶1,下同)研磨至匀浆状,移入15 mL离心管,残留物用2 mL氯仿-甲醇溶液均冲洗至离心管,超声处理(400 W,20 min)后2 000 r/min离心5 min,取上清液,加入2.5 mL KCl溶液,静置1 h分层,2 000 r/min离心5 min后吸去上层液,取下层液于70 ℃水浴锅蒸干后,烘箱烘干至恒质量,称质量即可得到1 g肝脏中脂肪的总质量[6]。
1.3.4 肝组织样品前处理
取50 mg大鼠肝脏组织于研磨管中,分别加入250、500、750 μL的溶剂(乙腈、甲醇、水体积比为2∶2∶1)后匀浆(60 Hz、20 s),静置1 h(每15 min漩涡混合一次)后离心(12 000 r/min、10 min、4℃),吸取上清液,进样检测。
1.3.5 UPLC -Q-TOF-MS分析方法
1.3.5.1 色谱条件
色谱柱:Acquity UPLC BEH C18(100 mm×2.1 mm,1.7 μm),柱温:45 ℃,进样量:1 μL。流动相A为体积分数0.1%甲酸的水溶液,流动相B为体积分数0.1%甲酸的乙腈溶液。洗脱程序:0~1 min,95%~80% A;1~2.5 min,80%~60% A;2.5~9min,60%~0%A;9~12 min,0% A;12~12.5 min,0%~95% A;12.5~14.5 min,95% A;流速0.4 mL/min。
1.3.5.2 质谱条件
离子源以正和负电喷雾电离模式运行。全信息串联质谱扫描模式:在运行期间使用低能量(碰撞能量4 eV)和高能量(碰撞能量20~45 eV)两种全信息串联质谱模式交替采集,氩气(纯度99.999%)作为碰撞诱导解离气体,氮气(纯度>99.5%)作为去溶剂化和锥形气体。扫描范围50~1 000 amu;扫描速率:一次扫描用0.2 s;毛细管电压2 kV(正离子模式)、1 kV(负离子模式);锥形电压40 V;源偏置60 V;源温度115 ℃;去溶剂化气体温度450 ℃;去溶剂化气体流量900 L/h;锥形气体流量50 L/h。锁定质量校正:乙腈-水-甲酸(体积比50∶49.9∶0.1)中的250 ng/mL亮氨酸脑啡肽标准校正溶液通过参比探针连续输注(5 μL/min),每30 s扫描一次。
1.4 数据统计分析
肝组织脂肪含量采用单因素方差分析进行组间比较,P<0.05为差异有统计学意义(SPSS 20.0软件)。UNIFI 1.8.1软件用于肝脏代谢组学数据采集,原始数据导入Progenesis QI v2.3进行峰采集、比对和归一化,以得到保留时间和质荷比(m/z)数据的峰强度等。将筛选编辑后的结果组织为二维数据矩阵,在SIMCA-P软件中进行主成分分析(principal component analysis,PCA)和偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA),根据模型得到的变量权重值(VIP>1)、Student-t检验的P值(P<0.05)以及最小变异系数(CV<30%)等来寻找差异性表达代谢物。基于精确质量以及高能质谱中的碎片,在HMDB和L v2.3ipid数据库中进一步鉴定化合物。运用EZinfor v3.0.3软件对产生的归一化峰强度做进一步的统计分析。通过在线数据库HMDB(http://www.hmdb.ca/)、lipidmaps(http://www.lipidmaps.org/tools/)、LipidBank(http://www.lipidbank.jp/)、KEGG(http://www.kegg.jp/)、Metabo Analyst(http://www.metaboanalyst.ca/faces/upload/PathUploadView.xhtml)等检索差异性代谢物及其所参与的代谢通路。采用GraphPad Prism 6软件作图,结果以平均值±标准差表示。数据采用SPSS Statistics 20软件进行单因素方差显著性分析,并用Tukey HSD法两两比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 PSE干预对NAFLD大鼠摄食量的影响

表1 PSE干预对NAFLD大鼠摄食量的影响Table 1 Effect of PSE on daily diet consumption of NAFLD rats
由表1可知,1~9 周内,随着大鼠周龄的增加,各组大鼠的摄食量均有所增加,其中实验至第9周后,NC组及PSE-H组大鼠摄食量较接近,与之前相比无明显变化,而HF组及PSE-L组摄食量较之前略有下降。这可能是由于高脂饲料热量较高,引起大鼠食欲下降,而高剂量PSE可更好地调节脂代谢,因此使大鼠保持正常食量。事实上后期代谢检测结果也发现,PSE-H组大鼠的代谢情况与NC组更接近,提示高剂量PSE(相当于人每天摄入6 g)可能会更好地发挥调节脂代谢作用。
2.2 PSE干预对NAFLD大鼠体质量的影响
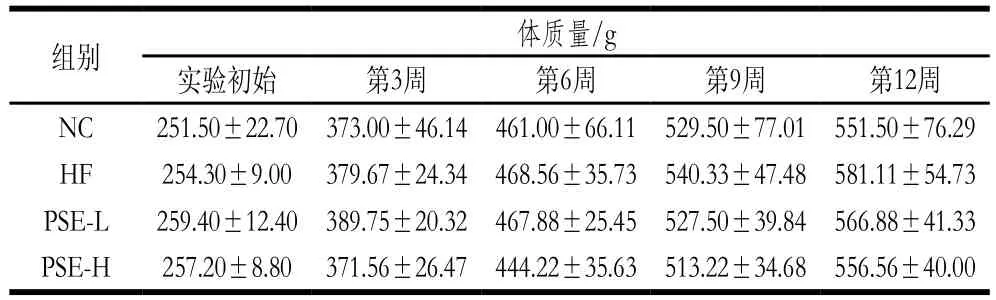
表2 PSE干预对NAFLD大鼠体质量的影响Table 2 Effect of PSE on body mass of NAFLD rats
表2中数据为起始至实验结束各组大鼠体质量的变化情况。实验初始时间各组大鼠体质量无显著差异;从第6周开始至实验结束HF组大鼠体质量一直高于其他组,到第12周时HF组大鼠体质量最高,PSE-L组次之。表明高脂饮食会导致体质量增加,有肥胖的趋势,而本实验中高剂量PSE干预可减缓体质量的增长。
2.3 PSE干预对肝组织总脂肪含量的影响
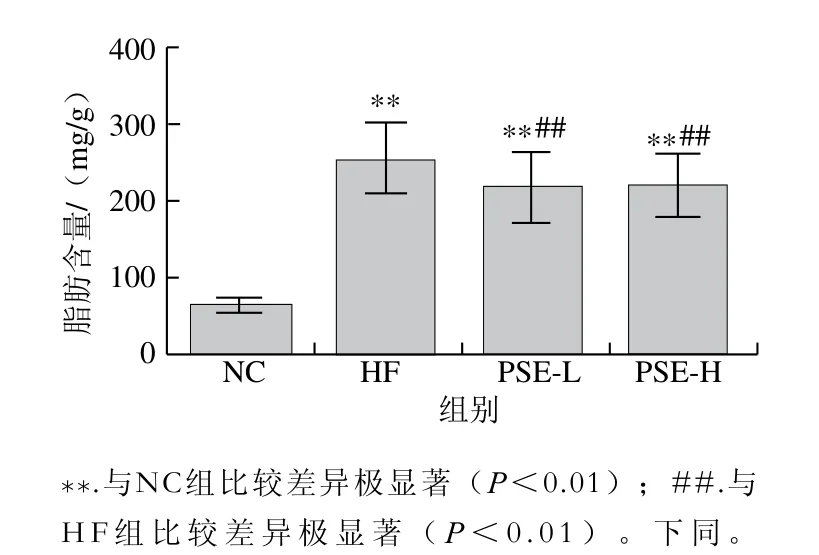
图1 PSE对NAFLD大鼠肝脏总脂肪含量的影响Fig. 1 Effect of PSE on total fat content in liver of NAFLD rats
由图1可知,HF组较NC组肝脏脂肪含量极显著升高(P<0.01),而PSE-L和PSE-H干预组大鼠肝脏中总脂肪含量均较HF组极显著下降(P<0.01),PSE-L和PSE-H两组肝组织脂肪含量接近。
2.4 肝组织代谢物检测不同前处理方法比较
实验分别采用250、500、750 μL的溶剂(乙腈-甲醇-水体积比2∶2∶1)处理样品后,从图2a~f可以看出:在正、负离子模式下,500、750 μL溶剂量较250 μL溶剂量在8~10 min内,出峰数目更多,且峰形更好,而负离子模式的图2f可以看出,750 μL溶剂量下其响应较低。为了增强代谢物的提取效果,最终选择在50 mg肝脏组织中加入500 μL的溶剂(乙腈、甲醇、水体积比2∶2∶1)作为提取条件。


图2 3 种不同前处理方法在UPLC-Q-TOF-MS正、负离子模式下的基峰离子流图谱比较Fig. 2 Comparison of base peak ion current patterns in positive and negative modes of UPLC-Q-TOF-MS under different pretreatment conditions
2.5 PSE干预对肝组织部分小分子代谢物的影响
2.5.1 多维统计分析

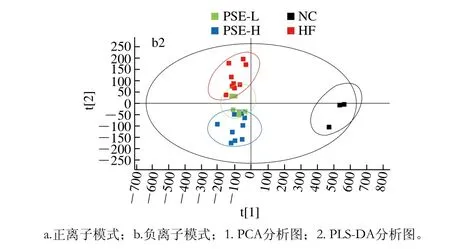
图3 各组肝组织小分子代谢物PCA和PLS-DA分析图Fig. 3 PCA and PLS-DA scores of small-molecule metabolites in livers of different groups
对各组大鼠肝组织小分子代谢物进行PCA分析,一般来说当模型概括X矩阵解释率(R2X)>0.4时表明该模型可靠,R2Y越接近于1说明模型的稳定性越好。本实验样品在正离子模式下R2X=0.74,负离子模式下R2X=0.68,因此本实验所建立的模型可用于各组之间代谢谱差异的可视化观察。为了更好地区分组间差异,提高模型的有效性,过滤与模型分类不相关的正交信号,采用PLS-DA方法对样品进行进一步分析,得到在正离子模式下R2Y=0.54,负离子模式下R2Y=0.77。由图3中PLS-DA图可知,HF组与PSE-L组分布差异较小,而PSE-H组与HF组区分明显。
2.5.2 差异代谢物的确认

图4 正离子模式下磷脂酰胆碱(18∶1(6Z)/0∶0)的低(a)、高(b)能量谱图Fig. 4 Low-(a) and high-(b) energy spectra of PC (18:1(6Z)/0:0) in positive ion mode
TOF-MS可以在低碰撞能扫描和高碰撞能扫描之间快速切换,从而同时完成两个扫描功能的数据采集。低能量扫描可以得到分子离子峰以及加合峰的信息,结合Mass FragmentTM确定化合物的可能分子式。通过高能量扫描产生的碎片离子信息,了解化合物可能的结构片段,再利用保留时间将低、高能量得到的信息进行关联,并与输入电脑中的MOL文件进行比对,从而对物质进行初步的定性。以磷脂酰胆碱(18∶1(6Z)/0∶0)为例,根据图4中低能量图谱可以看到,准分子离子峰为m/z522.3545[M+H]+,磷脂酰胆碱(18∶1(6Z)/0∶0)的精确相对分子质量为521.348 14。该物质的高能量质谱图中部分碎片离子如图5所示,通过比对UNIFI软件中给出的磷脂酰胆碱(18∶1(6Z)/0∶0)结构并结合其裂解规律,推断出该物质是磷脂酰胆碱(18∶1(6Z)/0∶0)。按照此方式,采集分析正负离子模式下得到的差异代谢物后,筛选出20 种差异代谢物如表3所示,其中19 种为脂类,1 种差异代谢物为胆汁酸类。用HMDB(http://www.hmdb.ca/)、lipidmaps(http://www.lipidmaps.org/tools/)、Pubchem(https://www.ncbi.nlm.nih.gov/pccompound)、KEGG(http://www.kegg.jp/)等数据库以及文献对差异代谢物进行搜索,了解其作用和所参与的代谢通路。
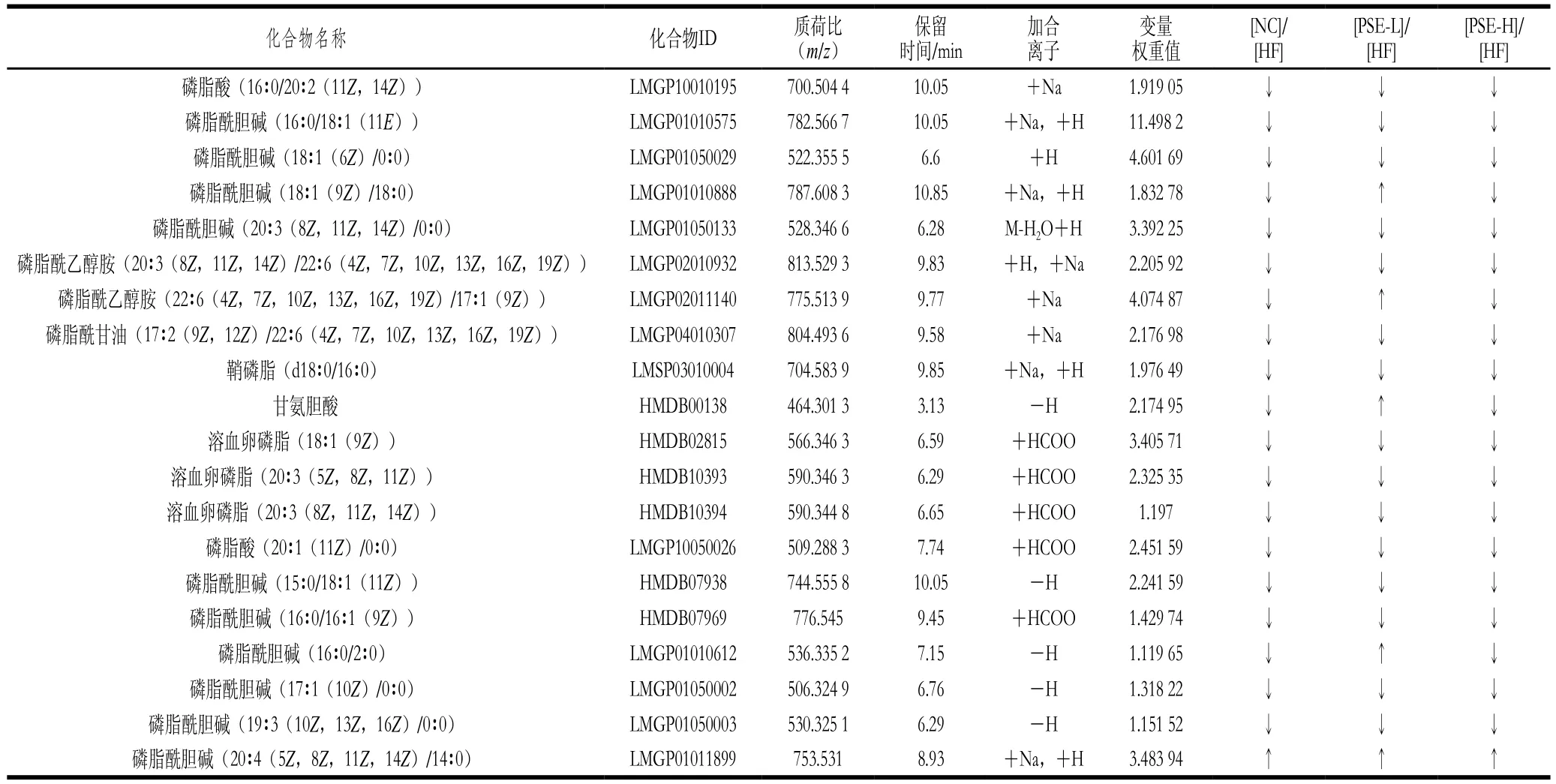
表3 PSE干预对NAFLD大鼠肝组织中差异代谢物的影响Table 3 Effect of PSE intervention on differential metabolites in liver of NAFLD rats

图5 磷脂酰胆碱(18∶1(6Z)/0∶0)高能量谱图中部分碎片离子Fig. 5 Selected fragment ions off PC(18:1(6Z)/0:0) in high-energy spectra
表3为20 种变量权重值(VIP)大于1的差异代谢物的质荷比、保留时间及其在Lipidmaps中的编号。从表3中数据可以看出,与HF组同一代谢物响应值相比较,NC组中代谢物离子强度水平低于或者高于HF组时,PSE-H组中也表现出相同的趋势,进一步提示高脂饮食条件下,高剂量PSE干预可有效减轻脂代谢紊乱,大鼠代谢状况与正常对照组更接近。
图6为20 种差异代谢物在各组大鼠肝脏中离子强度的比较。HF组与NC组比较,20 种差异代谢物均有极显著性差异(P<0.01)。总体来看,PSE-H组差异代谢物强度变化趋势与NC组更接近,其中PSE-H组中的磷脂酰乙醇胺(20∶3(8Z,11Z,14Z)/22∶6(4Z,7Z,10Z,13Z,16Z,19Z)、22∶6(4Z,7Z,10Z,13Z,16Z,19Z)/17∶1(9Z))、磷脂酰甘油(17∶2(9Z,12Z)/22∶6(4Z,7Z,10Z,13Z,16Z,19Z))、磷脂酸(20∶1(11Z)/0∶0)、磷脂酰胆碱(16∶0/16∶1(9Z))离子强度较HF组显著下降(P<0.05);磷脂酸(16∶0/20∶2(11Z,14Z))、磷脂酰胆碱(16∶0/18∶1(11E)、18∶1(6Z)/0∶0)、18∶1(9Z)/18∶0、20∶3(8Z,11Z,14Z)/0∶0)、鞘磷脂(d18∶0/16∶0)、甘氨胆酸、溶血卵磷脂(18∶1(9Z)、20∶3(5Z,8Z,11Z)、20∶3(8Z,11Z,14Z))、磷脂酰胆碱(15∶0/18∶1(11Z)、16∶0/2∶0)、17∶1(10Z)/0∶0)、19∶3(10Z,13Z,16Z)/0∶0)的离子强度较HF组极显著降低(P<0.01);而磷脂酰胆碱(20∶4(5Z,8Z,11Z,14Z)/14∶0)则有明显上升(P<0.05)。
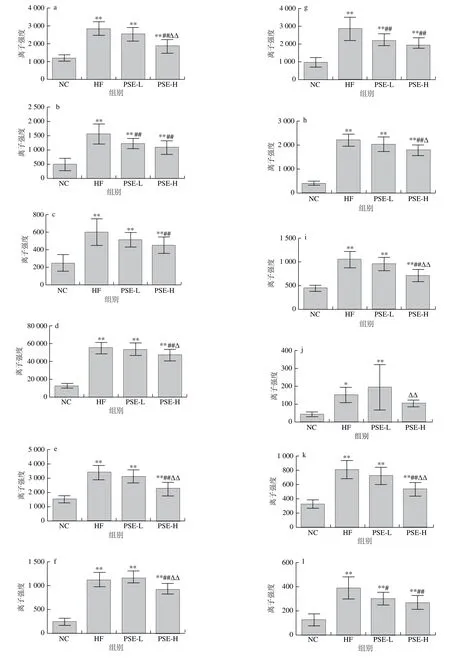
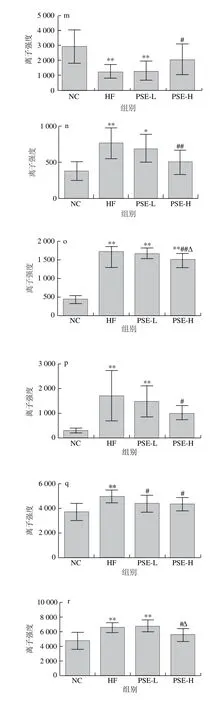
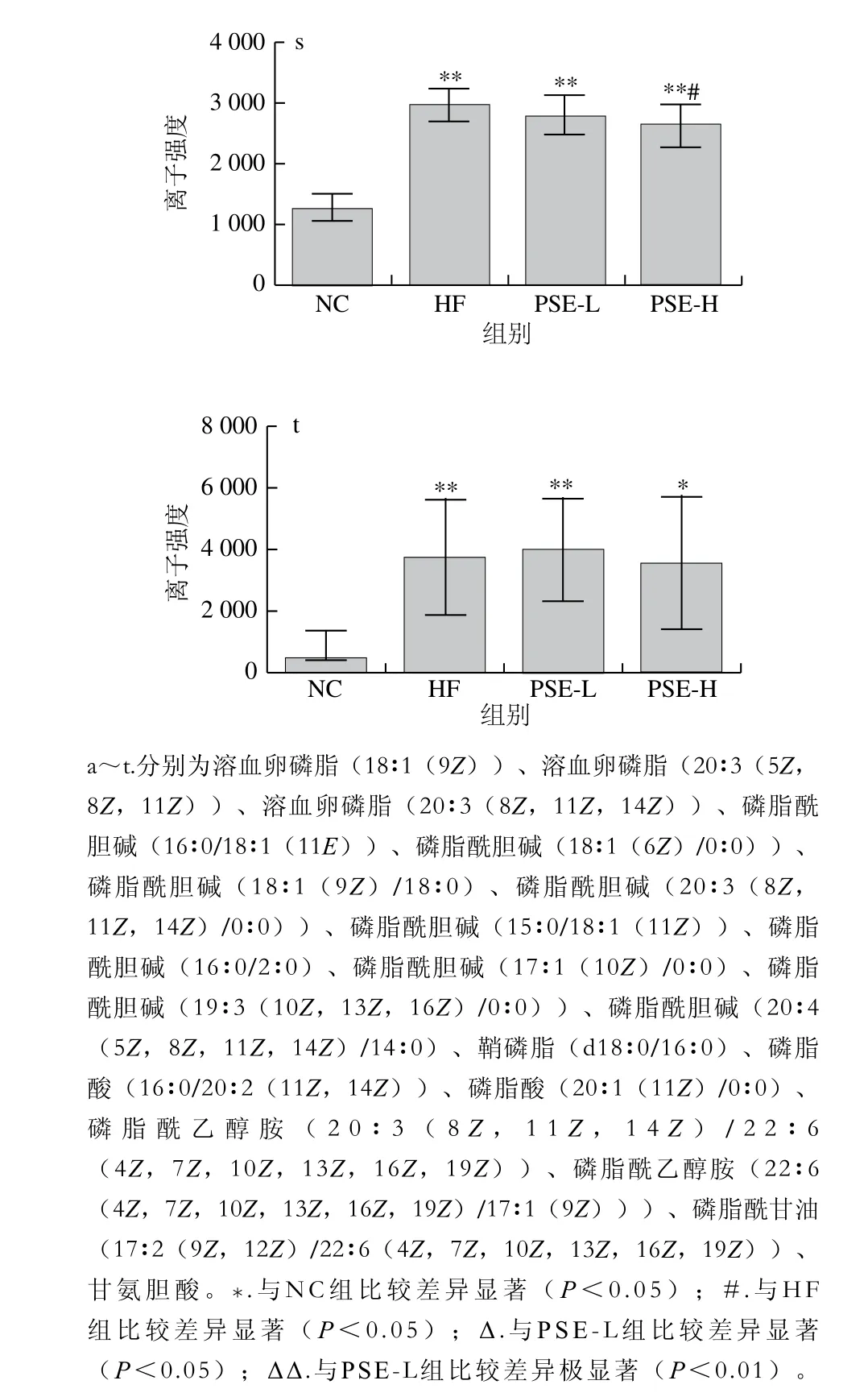
图6 各组大鼠肝组织中主要的差异代谢物离子强度比较Fig. 6 Comparison of ionic strengths of major differential metabolites in rat liver from each group
2.5.3 代谢通路分析
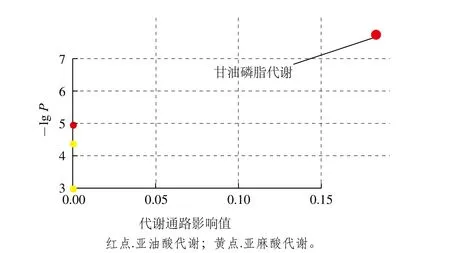
图7 通过Metabo Analyst得到的通路分析概要图Fig. 7 Pathway analysis profile obtained by Metabo Analyst
将表3中的差异代谢物输入Metabo Analyst( http://www.metaboanalyst.ca/faces/upload/PathUploadView.xhtml)数据库中,进行代谢通路浓缩与拓扑分析,对可能的生物扰动途径进行分析评估,选择代谢通路影响值大于0.10的作为潜在的靶向途径,构建代谢通路如图7所示。由图8和表4可以看到,通过筛选影响值,得到由溶血卵磷脂以及磷脂酰胆碱参与的甘油磷脂代谢通路,该通路的影响值为0.183 33。图8红色部分为本实验检测出在甘油磷脂代谢通路中的差异代谢物:磷脂酰胆碱(15∶0/18∶1(11Z),16∶0/16∶1(9Z)),以及溶血卵磷脂(18∶1(9Z),20∶3(5Z,8Z,11Z),20∶3(8Z,11Z,14Z)。表4为这5 种VIP>1的差异代谢物在HMDB、PubChem以及KEGG数据库中的编号。由代谢通路分析提示PSE可通过对纠正高脂饮食诱导的甘油磷脂代谢紊乱,发挥其对NAFLD的预防作用。
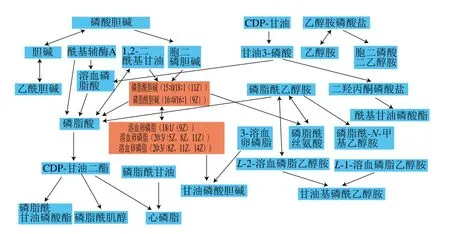
图8 通过Metabo Analyst得到的甘油磷脂代谢通路Fig. 8 Glycerophospholipid metabolism pathway obtained by Metabo Analyst
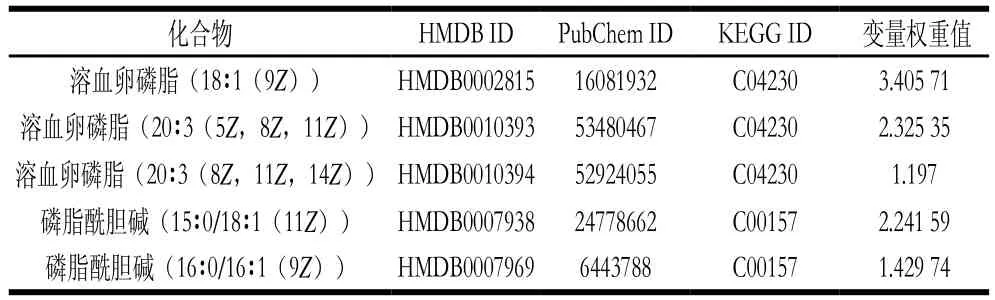
表4 参与甘油磷脂代谢通路的差异代谢物Table 4 Differential metabolites involved in glycerophospholipid metabolism
3 讨 论
van Ginneken等[12]研究了NAFLD小鼠饥饿导致的肝脏代谢组学变化,利用氯仿、甲醇、水提取肝脏组织样品,LC-MS检测结果发现甘油三酯、溶血卵磷脂以及磷脂酰胆碱在NAFLD小鼠肝脏中含量明显增加。另有相似研究运用氯仿、甲醇、水对肝脏组织进行前处理,研究NAFLD发生发展过程中肝脏代谢物的变化,与正常组相较有显著差异的物质为溶血卵磷脂、甘油磷酸乙醇胺以及游离脂肪酸(主要是花生四烯酸)[13]。在对NAFLD大鼠肝脏代谢组学研究中,Hall等[14]运用氯仿、甲醇、丙二醇以及水混合提取剂,LC-MS法检测出磷脂酰胆碱、甘油三酯以及高级脂肪酸等差异代谢物。另有研究利用甲醇水溶液匀浆处理肝脏组织后,通过LC-MS研究NAFLD的肝脏代谢组学,结果发现差异代谢物主要为磷脂酰胆碱、磷酸乙醇胺、溶血磷脂酰胆碱、溶血磷脂酰乙醇胺、鞘磷脂、二酰基甘油、甘油三酯[15]。此外,Qi Suwen等[16]用甲醇对肝脏组织进行研磨,进一步通过LC-MS研究NAFLD的肝脏小分子代谢物变化,得到的差异代谢物有硬脂酸、棕榈酸等高级脂肪酸,以及L-色氨酸、L-蛋氨基酸、谷氨酸以及L-谷氨酰胺等氨基酸,考虑到前期已对PSE干预后NAFLD大鼠肝组织脂肪酸代谢谱进行了研究(数据未发表),且由于NAFLD的发病机制主要与脂代谢紊乱相关,因此本研究以乙腈-甲醇-水(体积比2∶2∶1)为提取剂进行差异代谢物的提取和筛选。实验筛选出20 种差异代谢物主要为磷脂类(溶血卵磷脂、磷脂酰胆碱、鞘磷脂、磷脂酸、磷脂酰乙醇胺、磷脂酰甘油)以及胆汁酸类(甘氨胆酸),其中溶血卵磷脂和磷脂酰胆碱参与了甘油磷脂代谢通路。
溶血卵磷脂是低密度脂蛋白的主要成分,可以诱导细胞膜脂质过氧化,进一步导致炎症的出现,在细胞膜与介导信号转导过程中发挥重要作用[17]。近年来大量研究表明溶血卵磷脂在多种肝脏疾病和肝毒性的发生发展过程中有明显的变化。一般而言,溶血卵磷脂在细胞或组织中的量很少,如果浓度过高则会对细胞的膜系统造成伤害[18]。有研究显示在肝细胞中磷脂酶活性物质的积累可以导致溶血卵磷脂的生成,致使肝细胞损伤甚至死亡,而细胞死亡会激活炎症通道,促进炎症细胞的增多,最终引起脂质代谢紊乱[19]。另有研究显示,肝损伤会导致磷脂酰胆碱的合成增加,从而代偿性地对肝组织起到一定的保护作用[20]。本实验发现高脂饮食可诱导肝组织中溶血卵磷脂和磷脂酰胆碱含量上升,而高剂量PSE干预后溶血卵磷脂和磷脂酰胆碱的含量显著降低,有向正常水平调节的趋势,表明PSE通过调节甘油磷脂代谢通路减轻NAFLD的发生及发展。
此外,本实验结果显示,HF组中鞘磷脂的离子强度较对照组显著上升,高剂量PSE干预后,鞘磷脂含量较HF组显著下降。已有文献指出在炎症、代谢紊乱等病变过程中鞘磷脂的含量有所上升[21],大量研究提示,神经酰胺参与了NAFLD的发生发展过程[22],而鞘磷脂可以通过鞘磷脂酶水解生成神经酰胺[23]。神经酰胺能促进胰岛素抵抗,增加运送到肝脏内的游离脂肪酸含量,引起脂质蓄积,进一步导致肝脏脂质代谢紊乱[24]。其次,神经酰胺刺激机体,使得体内活性氧增多,加剧脂质过氧化,最终使肝细胞出现炎症、坏死甚至肝纤维化[25]。
磷脂酸可以通过Akt-mTOR信号通路刺激巨噬细胞,引发炎症因子:肿瘤坏死因子、白介素-1β和白介素-6分泌增多[26]。本实验中,HF组的磷脂酸离子强度较正常对照组显著增加,表明高脂饮食会激发机体内的炎症反应,而高剂量PSE组较单纯高脂饮食组可显著降低肝组织中磷脂酸的含量。磷脂酰乙醇胺N-甲基转移酶(phosphatidylethanolamine N-methyltransferase,PEMT)可以催化磷脂酰乙醇胺。当PEMT的活性被抑制时,磷脂酰乙醇胺的含量会增加,诱导内质网出现应激反应,小脂滴发生融合现象,形成较大的脂滴聚积,最终打破脂质代谢的平衡[27];另一方面,磷脂酰乙醇胺的上调可能会导致细胞通透性加强,促进巨噬细胞和中性粒细胞的浸润,造成肝损伤程度更加严重[28]。本研究中高剂量PSE组肝组织中磷脂酰乙醇胺离子强度较模型组明显降低,提示PSE可通过降低磷脂酰乙醇胺含量,调节脂代谢平衡,减少肝脏中的脂滴积聚,减轻炎症反应。
磷脂酰甘油是细胞膜的主要组成成分[29],对细胞膜的通透性和生理功能有直接影响。炎症的发生、发展以及消退过程均有磷脂酰甘油的参与,其含量变化可以很好的反映机体内脂类代谢是否紊乱,所以磷脂酰甘油含量是一个重要的生物学指标[30]。实验结果中高剂量PSE干预后肝组织中的磷脂酰甘油含量较HF组显著下降,进一步说明高剂量的PSE在一定程度上减轻高脂饮食导致的脂质代谢紊乱及炎症反应。
动物胆汁中主要是结合型胆汁酸,其中就包括甘氨胆酸。肝脏是胆固醇分解的主要代谢场所,可通过7α-羟化酶将胆固醇转化生成胆汁酸[31]。PSE在体内可以被水解为植物甾醇,植物甾醇与胆固醇的结构相似,可以竞争性地附着于肠上皮受体,限制胆固醇的吸收,最终降低胆固醇水平[32]。由实验结果可以看出HF组肝脏中胆汁酸含量较正常对照组显著升高,这可能是由于高脂饮食造成肝组织中胆固醇较高,PSE干预可降低NAFLD大鼠肝脏中的胆固醇含量降低[11],进一步导致转化生成的胆汁酸含量下降,提示PSE通过降低胆固醇水平调节胆汁酸合成与分泌。
4 结 论
本实验运用UPLC-Q-TOF-MS技术研究PSE干预对NAFLD大鼠肝组织小分子代谢物的影响,筛选出20 种差异代谢物,分别为参与甘油磷脂代谢通路的磷脂类和胆汁酸类,研究结果发现PSE干预后可降低肝组织中溶血卵磷脂、磷脂酰胆碱、鞘磷脂、磷脂酸、磷脂酰乙醇胺、磷脂酰甘油的含量,提示其可通过甘油磷脂代谢通路调节脂类代谢紊乱,减轻高脂饮食诱导的肝脏脂质积累,从而抑制NAFLD的发生发展。

