免疫磁分离技术在食源性致病菌快速检测中的研究进展
曹 潇,赵力超,陈 洵,谢 会,张竟丰,刘卓坤,王 丽,*
(1.华南农业大学食品学院,广东 广州 510642;2.暨南大学食品安全与营养研究院,广东 广州 510632;3.广州双螺旋基因技术有限公司,广东 广州 510006)
食源性细菌感染和疾病一直以来被认为是全球公共卫生的主要威胁,在全世界范围内造成了严重的健康威胁和社会经济损失,始终是研究人员亟需解决的首要问题[1]。有效预防和控制食源细菌的污染关键在于病原微生物的快速筛查,通常包括样品采集、样品前处理和微生物检测等步骤[2]。样品采集通常可采用国家标准方法,微生物快速检测可采用聚合酶链式反应(polymerase chain reaction,PCR)、酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)、生物传感器等传统或新型方法。然而,由于动物和食品样品均比较复杂,通常需要进行有效的样品前处理才能得到准确可靠的检测结果,现有的膜过滤和离心等传统方法分别是基于分子大小和质量,均没有特异性,存在较大的局限性。因此,迫切需要开发食品样品前处理新技术,以提供自动化、简单、准确和快速的系统,从样品中分离和浓缩低浓度的目标致病菌。
免疫磁分离技术(immunomagnetic separation,IMS)作为食物样品有效的预浓缩技术,能够快速地从复杂的食品基质中选择性分离和浓缩靶细菌[3-4]。同时还因其具有靶向特异性强、操作方便、分离效率高等特点,而且能有效减轻过程交叉污染,已被证明是最具潜力的食品样品前处理技术[5]。IMS常结合下游检测方法,如显色培养基[6]、PCR及衍生技术[7]、免疫学方法[8]、生物传感器[9]、微流体[10]等实现多种不同食品基质中致病性大肠杆菌O157:H7[11]、副溶血性弧菌[12]、沙门氏菌[13]、单增李斯特菌[14]、金黄色葡萄球[15]等常见致病菌的快速或在线分析检测。本文归纳总结IMS在食源性致病菌快速检测中应用的最新进展,以期为其进一步创新、IMS快速检测试剂盒的研发应用以及与其他检测技术的深度融合提供新思路,使其更好地服务于食源性致病菌的快速筛查。
1 IMS富集食源性致病菌的原理
IMS通过磁珠的磁响应性和免疫学反应富集食源性致病菌,其作用原理如图1[16]所示,超顺磁性颗粒其表面经化学修饰后,与靶细菌特异性的活性蛋白质结合制成免疫磁珠(immunomagnetic beads,IMBs),然后IMBs上的抗体将会特异性识别与捕获待检样品中的目标菌,形成IMBs-目标菌复合物。最后依靠磁场的作用力快速地使复合物与样品中其他杂质分离,从而达到高效、精准浓缩目标微生物的目的。

图1 IMS原理图[16]Fig. 1 Schematic illustration of IMS[16]
2 影响磁分离效果的主要因素
磁分离效果是检验IMS从复杂样品基质中分离浓缩目标微生物能力的标准,而IMS的有效性和稳定性依赖于IMBs和富集条件,如何让磁分离效果达到最佳的状态,需考虑到以下影响因素。
2.1 磁珠

表1 磁珠的制备方法及特点Table 1 Synthetic methods of magnetic beads and its characteristics
磁珠是IMS应用的物质基础。目前磁珠的合成手段如表1所示,也可直接购买成熟的商品化磁珠,进口的有Invitrogen Dynabeads磁珠、Bangs微球、Polysciences等,国内有上海奥润微纳公司和厦门鑫海公司等生产磁珠。磁珠的粒径和数量是影响磁分离效果的重要因素。Shan Shan等[17]研究不同粒径(180、350、1 150 nm)磁珠对磁分离效果的影响,结果表明随着磁珠尺寸的减小,靶细菌捕获率增加。这可能是由于磁珠粒径越小,其比表面积就越大,从而能够捕获到更多的靶细菌。Brandao[18]、牛牧[19]等也证实了这一点,磁珠粒径的确对捕获效率存在较大的影响。但Chen Jing等[20]研究表明,IMBs粒径不仅能影响目标菌的捕获效率,还对样品基质中非特异性结合率产生显著影响。另外,IMS的回收效率也会随着IMBs剂量的增加而增加至饱和状态[21]。
2.2 表面功能基团修饰
直接使用未修饰的磁性微粒偶联抗体等物质时,不仅偶联效率低,而且易被外界空气氧化,不利于保存。因此,研究人员常对合成的磁性微粒进行表面修饰,使其带有所需的活性基团。钟子清等[27]比较了抗体直接偶联和链霉亲和素-生物素介导偶联的IMBs对单增李斯特菌富集效果的影响。结果表明,链霉亲和素-生物素介导偶联IMBs的捕获效率约是直接偶联法的3 倍。Li Fulai等[28]研究表明,经生物素修饰后的IMBs不仅对单增李斯特菌表现出超强的捕获能力,当细菌浓度低于104CFU/mL时,有超过90%的单增李斯特菌被捕获。更重要的是,相比以前直接使用抗体共轭磁性纳米粒子,抗体剂量减少了10 倍。此外,IMBs修饰不同的功能基团,其富集效果不同。苏晨曦等[29]应用羧基和甲苯磺酰氨基偶联的IMBs与环介导基因恒温扩增技术联用检测水产品中的副溶血性弧菌,结果表明,羧基偶联的磁珠捕获菌体的能力显著优于甲苯磺酰胺基(P<0.05),两种羧基磁珠富集效率分别达到79%和94%。
2.3 抗体的选择
抗体是IMS中识别、捕获和集中来自食物样品中靶病原体的分子,对免疫磁分离效果具有至关重要的影响。为了使富集效果最佳,使用的抗体应具备特异性好、排他性强与效价高等特点,即抗体与食源性致病菌需具备高亲和度,且不与其他细菌进行交叉反应,抗原抗体结合反应灵敏度高[30]。抗体有单克隆抗体和多克隆抗体之分,在IMS分离食源性致病菌中均有应用。单克隆抗体具有较高的稳定性与特异性,其效果优于多克隆抗体,但制备周期长、价格昂贵且敏感度不及多克隆抗体。抗体的选择至关重要,目前市面上专门针对食源性致病菌的抗体相关产品(抗血清、纯抗体等)并不多见,特别是不常见食源病原微生物(表2)。国内外食源性致病菌抗体品牌以美国Thermo Fisher公司、Meridian Life Science公司、KPL公司为代表,但价格昂贵且量少。也有研究人员选择实验室自制抗体或将抗原灭活后交抗体公司免疫,但耗时长(至少需要2 个月时间),且抗体特异性和有效性较前者低。另外,在进行大容量IMS的实际应用研究时,活性抗体与磁珠和靶细菌结合的先后顺序也会影响磁分离效果。这是由于固定在磁珠的抗体运动性能较游离抗体弱而导致真正捕获在IMBs上目标细菌的量少,特别是在大体积的体系中。为了确保免疫磁珠对靶细菌的高捕获效率,Luo Dan等[31]采用新型IMS方法,即首先将生物素化单增李斯特菌单克隆抗体与10 mL单增李斯特菌特异性结合,然后与链霉亲和素磁珠偶联。结果表明巴氏杀菌乳中单增李斯特菌捕获效率大于90%,而生物素化抗体的使用量仅约为常规IMS的7%,大幅节约了检测成本。

表2 IMS中常用食源性致病菌抗体信息Table 2 Antibody information of common foodborne pathogenic bacteria captured by IMS
2.4 富集条件
食品中目标菌的初始浓度,即食品基质中病原微生物污染程度会对磁分离效果产生明显影响作用。低浓度的样本相比高浓度更易分离浓缩,李超辉等[39]证明了这点,加标量为0.25~2.00 ng/g时回收率大于80%,而当加标量为5 ng/g时回收率降至61.2%。另外,富集时间也是影响分离效果的关键因素,将磁性微粒置于磁场上时,时间不能太短或太长,时间太长导致部分磁性微粒聚集而不易分散,形成大颗粒;时间太短会使部分磁性微粒随废弃液而弃去,最终降低结果的精确度。Escalante-Maldonado等[40]研究结果表明,持续振动孵育30 min有利于增强IMBs与靶标的关联性,提高富集效率。同样,在磁分离前3 min内细菌回收率显著增加,3 min后无显著差异。外界加持的高梯度和强度磁场有助于提高细菌的分离效率,Lin Jianhan等[41]研究证明高梯度磁分离(high gradient magnetic separation,HGMS)是一种有效的方法。然而在HGMS作用下吸附柱易吸收非目标磁性材料并造成复杂样品中非磁性残余物的阻塞,其研究仍存在一些挑战。
3 IMS结合其他下游检测技术在食源性致病菌检测中的应用
IMS主要解决样品前处理中微生物分离富集这一难题,后续还需要结合其他下游检测技术。目前已将IMS结合显色培养基、PCR及衍生技术、免疫学方法、生物传感器、微流体等应用于食品安全分子检测领域研究中。
3.1 结合显色培养基的检测
显色培养基是一种基于细菌代谢特异性酶与相应显色底物反应显色的原理来鉴定细菌的检测方法,结果直观易获取,其灵敏度和特异性均优于传统培养基。闻一鸣[42]、Wadud[43]、Bauwens[44]等的实验证明了联合使用IMS与显色培养基能够准确检出目标病原微生物,较国家标准检测法用时短,且具有同等灵敏度。然而,显色培养基法仍无法有效克服平板检测的操作繁琐、易漏检和错检等缺陷,已不能满足现代食源性致病菌快速检测的要求,逐渐被其他检测技术替代。
3.2 结合PCR及衍生技术的检测
PCR是一种针对目标细菌特异性基因进行核酸扩增的分子生物学技术,包括普通PCR、可同时检测多种细菌的多重PCR(multiplex PCR,mPCR)、基于核酸染料叠氮溴化丙锭(propidium monoazide,PMA)和叠氮溴化乙锭用于区分死活细胞的PCR、环介导恒温核酸扩增(loop-mediated isothermal amplification,LAMP)技术等。因PCR技术特异性强、灵敏度高和检测时间短,已成为目前联合IMS来快速检测食源性致病菌中应用最广泛、最成熟的技术之一(表3)。然而,近年来新兴发展的数字PCR作为一种强有力的能够实现对食品样品中残留的微量目标物进行绝对精准定量的工具,其同IMS联用的应用研究却鲜见报道,这有待于科研人员深入挖掘探讨。
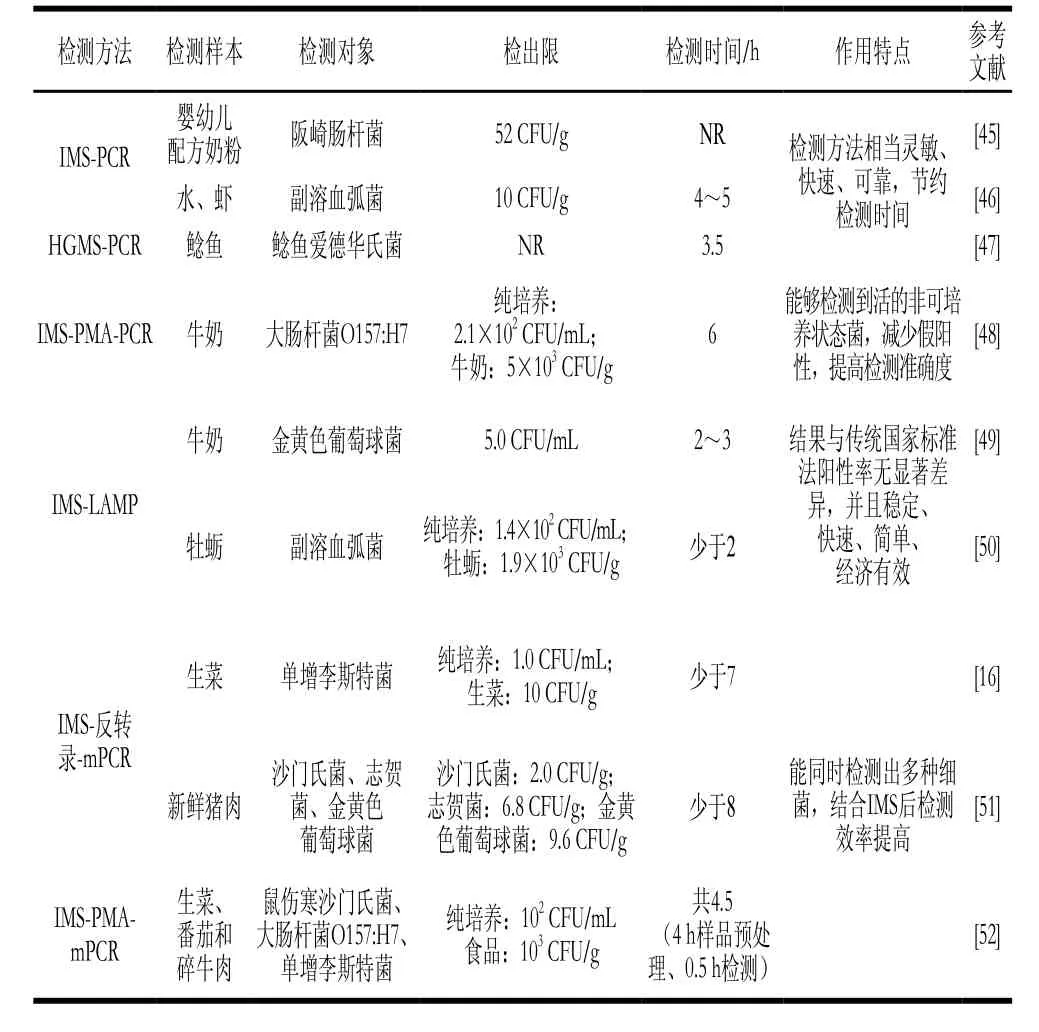
表3 IMS联合PCR及衍生技术在食源性致病菌快速检测中的应用Table 3 Applications of IMS combined with PCR and its derivative technologies in rapid detection of foodborne pathogenic bacteria
3.3 结合免疫学方法的检测
免疫学方法依赖于目标病原体上存在抗原的高度特异性和敏感性,该特异性允许抗体与靶病原体中抗原产生强烈反应性。IMS-免疫学法利用磁珠的高比表面积和超顺性的特性大幅增加了抗原抗体反应的接触面积,从而降低检出限和缩短检测时间。ELISA是最早出现且最常见的基于抗原-抗体特异性结合原理实现靶标定量的检测技术,也是最先结合IMS来检测食源性致病菌的免疫学方法。Wang Zhouli等[53]建立的IMS-ELISA在3 h内检测到可疑阳性样品,同时显著减少检测脂环酸芽孢杆菌属所需的材料和劳动力,并且与标准培养方法相比,IMS-ELISA对102 份自然污染苹果汁样品的灵敏度、特异性、准确度分别达到91.3%、96.02%和95.09%。
尽管ELISA因其高灵敏度和准确性被誉为免疫检测的金标准,但其对检测仪器、环境条件和检测人员的操作要求高,并不适用于对突发食品安全和公共卫生事件即时有效的检测。免疫层析试纸条技术(immunochromatography assay,ICA)将ELISA整合至层层叠加的试纸条,具有操作简便、结果可视化、无需精密仪器和设备等优势,更适用于现场便携式快速检测。为了使检测更易于进行,ICA常用不同标记物(如胶体金、酶、荧光素、金磁双功能纳米珠等)标记抗体,其中胶体金标记应用广泛。Zhang Xuan等[54]研究表明免疫磁性分离后胶体金标记的免疫层析试纸条可以检测到102CFU/mL的阴沟肠杆菌,比直接使用免疫色谱试纸条检测灵敏度提高10 倍。Li Qianru等[55]通过荧光标记抗体结合IMS联用技术能够以较少的步骤快速富集香肠、猪肉和牛奶样品中的单增李斯特菌,具有高度特异性,并且与单独的荧光免疫层析相比,检测限约提高40 倍。Huang Zhen等[56]首次将IMS与荧光纳米珠横向流动结合用于生乳中大肠杆菌O157:H7的检测。IMS的荧光纳米珠横向流动测试条的信号值比没有IMS时的信号值强,表明IMS可以富集大肠杆菌O157:H7并消除食品杂质干扰。在免疫层析检测方面,金磁双功能纳米珠是一种新型抗体标记物,Xia Shiqi等[57]首次将其同免疫色谱试纸结合成功应用于全脂牛奶中霍乱沙门氏菌的快速检测,与胶体金-ICA相比,金磁双功能纳米珠-ICA更敏感,捕获率为82.4%。
免疫脂质体是指单克隆抗体或其片段修饰的脂质体,兼有脂质体和靶向抗体的优点。其广泛应用于临床药物治疗,但在食源性致病菌的检测应用上却鲜见报道。Song Xinjie[58]、Shukla[59]等开发的基于免疫脂质体的免疫磁性富集和分离测定法能够快速、灵敏、特异性检测到婴幼儿配方奶粉中的阪崎肠杆菌,且能够排除复杂的背景干扰,在食品安全检测上显示出巨大的潜力。
3.4 结合生物传感器的检测
生物传感器是食品安全检测领域的前沿技术之一,具有操作简单、检测成本低、选择性好、灵敏度高、分析速度快,且能在复杂的体系中进行在线连续监测等特点。生物传感器逐渐成为常规检测方法的潜在替代物[60],被研究人员广泛关注。Huang Fengchun等[61]经IMS特异性捕获靶细菌形成免疫转化酶-纳米簇复合物,复合物上的转化酶将注入毛细管中的蔗糖转化为葡萄糖,使用葡萄糖计检测葡萄糖以获得葡萄糖浓度,从而测定样品中目标菌的浓度。结果表明对大肠杆菌O157:H7检测下限为79 CFU/mL。Cheng Ping等[62]所研究的用于检测大肠杆菌O157:H7的安培计免疫传感器,其具有新颖、快速且成本低的特点,不仅可通过简单地关闭电源来再生,还适用于检测其他病原体。其利用电极表面上的免疫复合物阻碍电子转移来降低响应电流信号,而越大的ΔI表明越多的靶细菌被捕获。声学传感器是电化学装置有力的替代品,Papadakis等[63]就提出了一种微纳米生物声学系统,该系统利用磁性免疫珠捕获来自牛奶的细菌,然后通过LAMP平台和表面声波传感器检测。结果显示,仅在4 h内就能够成功地检测出25 mL牛奶中的1 个沙门氏菌细胞。
3.5 结合微流体的检测
IMS能有效地将样品中的目标分析物分离出来,然而在分离过程中涉及许多步骤(如孵育、洗涤、外加磁力收集和分散在缓冲溶液中),并且在这些步骤之间可能会丢失分析物。而结合微流体后将所有反应步骤集成到生物芯片上,可最大程度减少目标分析物的损失,并快速有效地从少量复杂流体中获得测量结果。Malic等[64]研究了一种使用抗体特异性二氧化硅-壳-铁-氧化物核纳米颗粒捕集和释放细菌的基于聚合物的微流体装置。其独特之处在于能够控制室内的磁场分布而不会造成剩磁,从而允许样品捕获和释放。研究表明,15 min内便可实现对单核细胞增生李斯特菌的检测,最低检出限为10 CFU/mL。郭建江等[65]构建了基于微流控芯片的磁控分离实验平台,用于检测水产养殖环境中大肠杆菌O157:H7,结果表明磁控分离法捕获率可达到92%以上,与被动分离捕获方式相比,不仅捕获率提高30%,而且分离操作灵活可控,自动化水平较高,实现了水产病原菌的高效分离。
3.6 结合表面增强拉曼光谱技术的检测
表面增强拉曼光谱(surface-enhanced Raman spectroscopy,SERS)是一种高灵敏度的光谱技术。IMS将特异性抗体偶联在贵金属(Au、Ag)涂层的磁纳米珠上富集浓缩样品靶细胞,然后通过SERS强烈增加待检分子的拉曼信号,可实现食品中痕量微生物的检测[66]。Najafi等[24]开发IMS-SERS的组合捕获和检测方法检测苹果汁中的大肠杆菌O157,结果显示,该技术在1 h内对致病菌的捕获效率约为84%~94%,最低检测限为102CFU/mL,无任何交叉反应。Kusic等[67]同样基于IMS和SERS在生物膜基质中建立了不依赖培养物、无需标记和快速检测军团菌的方法。在100 min内,该技术能够良好地区别军团菌与非军团菌,准确度为98.6%。
3.7 结合流式细胞技术的检测
流式细胞术(flow cytometry,FCM)是一种对流动的单细胞或微小颗粒分子进行快速检测的技术。IMS采用荧光素标记的抗体制备IMBs纯化和浓缩细菌,然后结合FCM检测荧光强度来确定样品中细菌的浓度。IMS-FCM具有快速、精准、高通量的特点,适用于低浓度的致病菌检测。Ryumae等[68]将HGMS和FCM结合,其检测灵敏度比未经IMS后的FCM测定高3 个数量级。通过FCM确定的细胞数量与使用菌落计数法获得的细胞数量在约10~105CFU/mL范围内相关。一次FCM检测可在60 s内完成,总检测时间(包括样品制备)不到2.5 h。Li Fulai等[69]开发了一种聚乙二胺树状大分子介导的生物素扩增磁性分离方法,结合FCM检测单增李斯特菌。该方法在细菌浓度低于104CFU/mL的磷酸盐缓冲液和人工污染生菜样品中富集率超过(89.15±1.75)%。在磷酸盐缓冲液中具有低至35 CFU/mL的检测限,人工污染样品中的最低检测限为3.5×102CFU/g。
4 结 语
食源性致病菌的污染和传播对食品工业和公共健康造成严重威胁,因此建立食源性致病菌在线或现场快速灵敏检的检测方法是保障食品安全和防控食源性病原菌感染的重要技术支撑。而样品前处理是食品分析检测中的关键限速环节,现有步骤复杂而耗时。IMS提供了一种快速且经济高效的样品前处理技术,其方便有效性主要在于代替了常规的选择性前增菌培养过程,与其他检测技术联用,可以达到缩短检测周期、提高灵敏度、增强特异性等目的,尤其适合在基层食品微生物检测实验室的推广和应用。但目前仍存在一些需要改进的地方:1)磁分离效率:需通过不断优化反应体系,最大程度提高实际样品中痕量病原体磁分离效率;2)应用性:尽管IMS与生物传感器、微流控装置等新型检测技术联用已被研究,但大多数仍停留在实验室阶段,还应结合实际情况进一步融合,实现现场或在线检测;3)多重病原体检测:磁性颗粒虽已成功整合到市售试剂盒中,以便快速、简单和可靠地检测单一病原菌,但由于IMS应用于高通量多重分析复杂食品样品的多病原体富集机理仍然难以厘清,目前只有少数商业试剂盒可用于同时检测多重病原体,用于细菌多重检测磁性颗粒的整合仍处于初级阶段,需要进一步研究。未来研究IMS的关键点在于IMBs稳定性的改进、磁分离后磁珠的回收利用以及实现可人为调节磁场操纵磁珠等,这些问题的解决对推进这项新技术至关重要。IMS未来发展方向应迎合食品安全检测的要求实现高精度、高效率、低成本方式在线监测病原体,使检测越来越微型化、便携化、智能化,更适用于现场快速检测。

