丝裂霉素C抑制FOXO1磷酸化调控结直肠癌细胞增殖和活力研究
龙道国,徐细明
(武汉大学人民医院/湖北省人民医院肿瘤科,湖北武汉 431900)
结直肠癌是许多国家发病率和病死率的主要原因,尽管近年来其发病率在世界发展中国家增加,但在较发达国家更严重[1]。目前,丝裂霉素C是最常用于加热腹腔内化疗的化学治疗剂[2],是一种具有抗肿瘤活性的天然抗菌药物,已被用于多种实体肿瘤,包括乳腺癌、结直肠癌、非小细胞癌和膀胱癌[3]。WU等[4]研究发现,FOXO1的表达水平和磷酸化水平与结直肠癌细胞的增殖密切相关。SHEN等[5]研究发现,丝裂霉素C能调控肿瘤细胞中蛋白的磷酸化水平。本研究旨在探讨丝裂霉素C、FOXO1磷酸化与结直肠癌细胞增殖和活力的关系。
1 材料与方法
1.1材料 丝裂霉素C购自北京百奥莱博科技有限公司(货号:BP1618-KWB)。HA-Foxo1-WT和HA-Foxo1-MT的质粒购自北京中原公司(ADDGNE货号:#10693、#9025)。HA、FOXO1A(phospho S256)、FOXO1A、TUBULIN抗体购自Abcam公司(货号:ab18181、ab131339、ab39670、ab32124)。结直肠癌细胞HCT116购自上海子实生物科技有限公司(货号:Qs101092)。RPMI培养基购自上海优予生物科技有限公司(货号:lffs1847),胎牛血清购自赛默飞世尔科技公司(货号:10099-133)。蛋白酶抑制剂Cocktail (不含EDTA,mini片剂) 购自Bbimake公司(货号:B14011)。PBS购自生工生物工程(上海)股份有限公司(货号:E607008)。青链霉素混合液(100×)购自北京索莱宝科技有限公司(货号:P1400)。2×十二烷基硫酸钠(SDS)蛋白电泳上样缓冲液购自北京鼎国昌盛生物技术有限责任公司(货号:WB-0081)。蛋白裂解液购自碧云天生物技术有限公司(货号:P0013)。NanoFect转染试剂购自南通柯侎克生物科技有限公司(货号:NF100)。
1.2方法
1.2.1细胞培养、药物处理和转染 结直肠癌细胞HCT116维持在补充有2 mmol/L谷氨酰胺、100 U/mL青霉素、100μg/mL链霉素和10%热灭胎牛血清的RPMI-1640培养基中,并在潮湿气氛(37 ℃,5%CO2)中培养。丝裂霉素C以终浓度0.5 μg/mL处理结直肠癌细胞HCT116。通过NanoFect转染HCT116细胞。将含HA-Foxo1-WT和HA-Foxo1-MT质粒分别与脂质体混合,静止大约20 min后,缓缓滴入HCT116细胞。选用结直肠癌细胞系HCT116,PBS处理的HCT116为对照组,丝裂霉素C处理的HCT116为丝裂霉素C处理组,HA-Foxo1-WT转染的HCT116为FOXO1-WT组,HA-Foxo1-MT转染的HCT116为FOXO1-MT组,每组3例。
1.2.2免疫印迹 行10%或12%SDS-聚丙烯酰胺凝胶电泳(PAGE),然后转移到PVDF膜。将PVDF膜在室温下用5%脱脂奶粉的Tris缓冲液封闭1 h,然后在4 ℃下与HA、FOXO1A (phospho S256)、FOXO1A、TUBULIN抗体温育过夜。然后将膜在室温下与缀合有HRP的相应二抗孵育1 h。观察特定蛋白质使用ECL Plus 免疫印迹检测系统。
1.2.3MTT试验 第1天使用胰蛋白酶消化HCT116细胞,将HCT116细胞稀释至每毫升75 000个细胞,使用完全培养基稀释细胞。根据MTT试剂盒的说明书进行操作。
1.2.4CCK-8试验 在96孔板中分配100 μL HCT116细胞悬浮液(每孔5 000个细胞)。将板在潮湿的培养箱中预孵育24 h。根据CCK-8试剂盒的说明书进行操作。
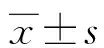
2 结 果
2.1丝裂霉素C抑制HCT116细胞的增殖和活力 用丝裂霉素C处理细胞后,与对照相比,MTT试验结果显示,在第2天和第3天结直肠癌细胞HCT116的增殖受到明显的抑制(t=8.023,P=0.016;t=6.814,P=0.021);同时,CCK-8试验结果显示,第2天、第3天和第4天的细胞活力受到明显的抑制(t=8.472,P=0.014;t=13.887,P=0.007;t=2.943,P=0.042)。见图1、2。

注:与对照组比较,*P<0.05
图1丝裂霉素C抑制HCT116细胞增殖
2.2丝裂霉素C抑制FOXO1磷酸化 用丝裂霉素C处理细胞后,与对照相比,免疫印迹试验发现细胞中FOXO1的总量无明显差异,但是S256位点的磷酸化FOXO1的蛋白量明显减少(t=4.801,P=0.039),见图3。

注:与对照组比较,*P<0.05
图2丝裂霉素C抑制HCT116细胞活力

图3 丝裂霉素C抑制FOXO1磷酸化

图4 FOXO1-WT和FOXO1-MT的表达
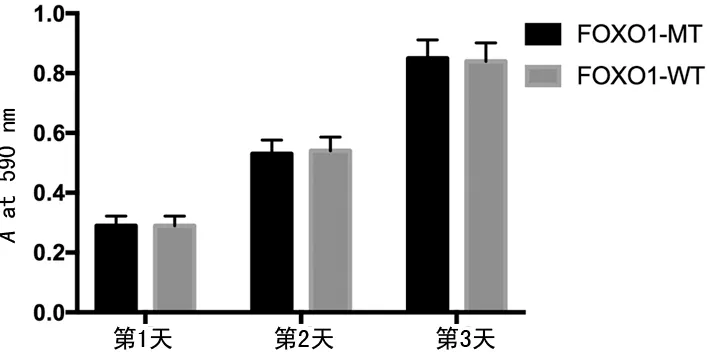
图5 转染FOXO1-WT和FOXO1-MT后HCT116细胞的增殖情况

注:2组比较,*P<0.05
图6丝裂霉素C通过抑制FOBO1磷酸化抑制HCT116细胞的增殖
2.3丝裂霉素C通过抑制FOBO1磷酸化抑制HCT116细胞的增殖和活力 分别转染HA-FOXO1-WT和HA-FOXO1-MT,HCT116细胞的增殖差异无统计学意义(t=0.079,P=0.77)。同时用丝裂霉素C处理,发现FOXO1-WT组的细胞增殖在第2天和第3天均明显小于FOXO1-MT组(t=4.926,P=0.031;t=7.037,P=0.019);FOXO1-WT组的HCT116的细胞活力在第3天和第4天均明显小于FOXO1-MT组(t=14.089,P=0.005;t=13.741,P=0.008)。见图4~7。
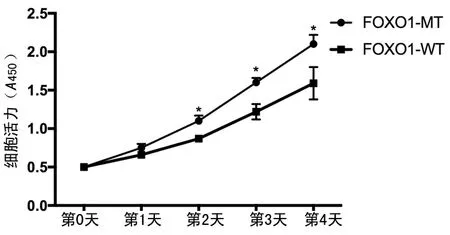
注:与FOXO1-WT组比较,*P<0.05
图7丝裂霉素C通过抑制FOBO1磷酸化抑制HCT116细胞的活力
3 讨 论
据报道,结直肠癌是全球第3大常见癌症,2012年诊断出136万人[6]。结直肠癌的预后与诊断有关,早期诊断时的5年生存率为90%,结直肠癌远处转移诊断时的生存率低于10%[7]。目前的治疗药物选择包括丝裂霉素C、5-氟尿嘧啶、伊立替康、奥沙利铂、替加氟-尿嘧啶/亚叶酸钙和5-氟尿嘧啶前药卡培他滨[8]。此外,最近将贝伐单抗、西妥昔单抗和帕尼单抗纳入治疗组合方案中[9]。然而,新的治疗方案以增加毒性为代价改善了预后,并且患有转移性疾病的患者最终将对可用药物产生耐药性,且其分子机制并未明确。因此,阐明分子机制和开发新的、有效的、毒性较小的药物已成为当务之急。
FOXO1是FOX转录因子O亚家族的成员[10]。FOXO1与FOXO3、FOXO4等其他成员一起参与细胞周期退出和G1停滞,诱导细胞凋亡、氧化和细胞应答的细胞功能调节[11]。在本研究中,当细胞被丝裂霉素C处理后,发现磷酸化的FOXO1的表达被下调(P<0.05)。细胞中的FOXO1蛋白呈现磷酸化的无活性形式和未受磷酸化的活性形式[12]。因此,磷酸化的FOXO1的表达被下调,且未受磷酸化的FOXO1的活性形式被上调,HCT116的细胞增殖和活力明显下降(P<0.05)。FOXO1-MT的突变体是在FOXO1磷酸化位点上进行的磷酸化模拟型突变,即FOXO1-MT持续磷酸化且无法被去磷酸化。分别转染HA-FOXO1-WT和HA-FOXO1-MT,同时用丝裂霉素C处理,发现FOXO1-WT组的HCT116的细胞增殖和活力均明显小于FOXO1-MT组(P<0.05)。本研究所用的FOXO1-MT的突变为T24A、S256A和S319A,提示丝裂霉素C调控的FOXO1磷酸化位点至少有T24、S256、S319中的一个。FOXO1的磷酸化酶和去磷酸化酶有PKB/AKT1、PKB/AKT2、SGK1、STK4/MST1、CDK1[13],提示丝裂霉素C可能影响这些磷酸化酶的转录水平、蛋白水平或酶活性来抑制其功能。而仅分别转染HA-FOXO1-WT和HA-FOXO1-MT,HCT116的细胞增殖差异无统计学意义(P>0.05),提示在HCT116细胞中FOXO1处于高度磷酸化的无活性形式。而用丝裂霉素C处理后,野生型的FOXO1发生去磷酸化。因此,相比于持续磷酸化且无法被去磷酸化的FOXO1突变型,表达野生型的FOXO1的HCT116细胞的增殖和细胞活力明显降低。随着未磷酸化的FOXO1增加,蛋白质FOXO1易于进入细胞核[14]。因此,丝裂霉素C处理HCT116细胞后,入核的转录因子FOXO1对各种基因的转录调节活性,包括p27Kip1、p130-Rb2和细胞周期蛋白D1/2(细胞周期调节),肿瘤坏死因子相关的凋亡诱导配体(TRAIL),进而抑制HCT116的增殖和细胞活力[15-17]。
综上所述,丝裂霉素C通过抑制FOXO1磷酸化来降低结直肠癌细胞的增殖和活力。

