菜青虫胰凝乳蛋白酶基因PrCT1的克隆及表达分析
张 娴,李超林,郑乔木,严子成,廖 海,周嘉裕
(西南交通大学 生命科学与工程学院,四川 成都 610031)
胰凝乳蛋白酶(Chymotrypsin)属于丝氨酸肽链内切酶的S1家族成员,在动物、植物、微生物、病毒中均有发现,其活性部位常含有Ser-His-Asp组成的催化三联体,专一性切割苯丙氨酸、酪氨酸与色氨酸的羧基端肽键[1-4]。在斜纹夜蛾(Spodopteralitura)、烟草天蛾(Manducasexta)与小菜蛾(Plutellaxylostella)等鳞翅目昆虫中,胰凝乳蛋白酶是中肠的重要蛋白质水解酶,能够水解食物蛋白质,为昆虫提供必需氨基酸等营养物质[5]。此外,胰凝乳蛋白酶还参与多种生理过程,如免疫应答[6]、几丁质合成[7]、蜕皮[8]、发育[9]及苏云金芽孢杆菌(Bacillusthuringiensis)毒蛋白的激活[10]等。
菜青虫(Pierisrapae)属鳞翅目粉蝶科菜粉蝶属,是菜粉蝶的幼虫,已知的寄主植物有9科35种之多,嗜食十字花科植物,特别偏食厚叶片的甘蓝、花椰菜、白菜、萝卜等,每年给十字花科蔬菜造成极其严重的损失。目前,预防和控制菜青虫主要通过施用化学农药,但由于菜青虫耐药性不断增加,必须频繁用药才能防止菜青虫再度猖獗,而频繁用药导致的食品安全和环境污染问题,一直备受争议和重视[11]。BROADWAY[12]研究发现,菜青虫主要依赖胰蛋白酶和胰凝乳蛋白酶行使消化功能,由此认为胰凝乳蛋白酶可能是抗虫因子作用的重要靶点。目前,国内有关菜青虫中肠丝氨酸蛋白酶研究的报道较少,仅朱洋铿[13]从菜青虫蛹期脂肪体和血细胞中克隆出4个胰蛋白酶基因,证明其参与菜粉蝶的先天免疫反应。
XIANG等[14]前期对菜青虫中肠开展了比较转录组学研究,发现菜青虫中肠中有多个胰凝乳蛋白酶候选基因,其中,部分基因的表达受到了抗虫因子——蛋白酶抑制剂的影响。本研究选取在转录组3个样本间(正常、饥饿、喂食抑制剂)表达显著差异的1个胰凝乳蛋白酶候选基因 (编号:c31814.graph_c0)进行克隆、序列分析及原核表达,并利用qRT-PCR分析其在菜青虫不同组织部位及受到饥饿和决明胰蛋白酶抑制剂(Cassiaobtusifoliatrypsin inhibitor,COTI)胁迫后的表达变化,为进一步研究该基因的功能及筛选抗虫新靶点奠定基础。
1 材料和方法
1.1 供试虫源
菜青虫购自神农生物科技有限公司。将菜青虫置于(25±1)℃、相对湿度75%、光周期L∶D=14∶10条件下,用新鲜未施用农药的白菜叶片饲养。
1.2 主要试剂
RNA提取TRIzol®-Reagent 购自Invitrogen公司;DNA 纯化试剂盒购自天根生化科技有限公司;质粒提取试剂盒购自Omega公司;反转录酶M-MLV Reverse Transcriptase、SYBR®Premix Ex TaqTMⅡ、DL2000 DNA Marker、高保真酶PrimesSTAR HS DNA Polymerase、限制性内切酶BamHⅠ和XhoⅠ、pMD19-T克隆载体购自TaKaRa公司;蛋白质Marker购自赛默飞世尔科技有限公司;镍离子亲和层析柱购自GE公司;大肠杆菌DH5α、大肠杆菌Rosetta(DE3)、质粒pET28a由本实验室(药用植物资源与分子生物学实验室)保存;COTI由本实验室前期构建的重组菌表达纯化所得[15];其余试剂为进口或国产分析纯。
1.3 基因克隆及序列分析
选取菜青虫4龄幼虫,解剖得到中肠,采用传统Trizol萃取法提取中肠总RNA,每只菜青虫中肠用液氮研磨之后加入1 mL TRIzol®-Reagent。提取的总RNA用酶标仪和1%琼脂糖凝胶电泳鉴定其纯度和完整性,放入-80 ℃冰箱中备用。按照反转录酶M-MLV Reverse Transcriptase说明书方法,以Oligo(dT)18为引物(表1)合成cDNA,保存于-20 ℃。以菜青虫中肠cDNA为模板,用引物PrCT1F和PrCT1R进行PCR扩增,扩增条件:94 ℃ 4 min;94 ℃ 30 s,56 ℃ 15 s,72 ℃ 60 s,30个循环;72 ℃ 7 min。PCR产物经1.0%琼脂糖凝胶电泳分离、切胶回收纯化后,克隆到pMD19-T载体中,转化大肠杆菌DH5α菌株感受态细胞,PCR筛选菌液阳性克隆,并测序验证。
对PrCT1的分子质量(http://web.expasy.org/compute_pi/)、信号肽(http://www.cbs.dtu.dk/services/SignalP/)、功能域(http://smart.emblheidelberg.de/)等进行在线预测;利用MEGA 7软件对PrCT1与其同源丝氨酸蛋白酶进行多序列比对,并用ESPript着色[16],再用邻接法(Neighbor-joining)构建系统发生树(去除空位,采用1 000次重复进行自举检验)。

表1 研究所用引物及其用途
注:_表示限制性酶切位点。
Note:_indicates restriction enzyme sites.
1.4 原核表达
根据克隆的PrCT1基因编码区序列,设计带酶切位点引物PrCT1YF和PrCT1YR(表1)。以克隆质粒为模板进行PCR扩增,扩增条件:94 ℃ 4 min;94 ℃ 30 s,56 ℃ 15 s,72 ℃ 60 s,30个循环;72 ℃ 7 min。PCR产物经1.0%琼脂糖凝胶电泳分离、切胶回收纯化后,克隆到pET28a载体中,转入大肠杆菌DH5α菌株感受态细胞,菌液以PCR筛选阳性克隆,并进行双酶切鉴定和测序验证。将获得的pET28a-PrCT1重组表达质粒转化大肠杆菌Rosetta(DE3)表达菌株感受态细胞,用终浓度为 0.5 mmol/L的异丙基-1-硫代-β-D-半乳糖苷(IPTG)于27 ℃过夜诱导表达。收集诱导表达后的菌体,用50 mmol/L Tris-HCl(pH值为8.0)重悬,经超声波破碎和高速离心,分别收集破碎菌体的上清和沉淀,用15% SDS-PAGE进行检测。将重组菌在不同温度(19、23、27、30、33、37 ℃)、不同IPTG浓度(0.1、0.5、0.8、1.0、1.2、2.0 mmol/L)条件下分别进行表达,对PrCT1表达条件进行优化。表达条件优化后大量诱导重组菌表达目的蛋白,按照冯文荣[17]的方法,将包涵体洗涤、变性后,经Ni2+亲和层析纯化,用250 mmol/L咪唑洗脱,再经SDS-PAGE检测纯化蛋白质。
1.5 PrCT1基因在不同组织中和不同胁迫处理条件下表达模式分析
不同组织:取4龄菜青虫,将其解剖为头、尾、脂肪体、中肠4个组织。
饥饿处理:在正常饲养条件下,对4龄菜青虫进行饥饿处理,分别在饥饿处理4、8、16 h后收集菜青虫中肠。
COTI喂食处理:从菜青虫3龄开始喂食含COTI(质量浓度0.8 mg/mL)白菜,4龄时收集菜青虫中肠。
不同处理均以正常喂食4龄菜青虫作为对照(CK),每组样品分别收集6头幼虫。利用所取材料获得的cDNA为模板,以UPF3为内参基因[18],使用UPF3与PrCT1荧光定量PCR引物(表1),按照荧光定量SYBR®Premix Ex TaqTMⅡ说明书方法进行操作。反应总体系为20 μL,扩增程序:94 ℃ 60 s;94 ℃ 30 s,58 ℃ 20 s,72 ℃ 20 s,40个循环。每个样品进行3次重复试验,收集PrCT1基因和UPF3基因的Ct值,采用2-ΔΔCt法计算相对表达量。
2 结果与分析
2.1 菜青虫胰凝乳蛋白酶PrCT1基因的克隆与序列分析
对菜青虫中肠转录组中编号为c31814.graph_c0的序列进行分析,发现其含有1个长度为861 bp的完整ORF,编码286个氨基酸。在ORF的两侧设计引物进行T-A克隆,核酸测序结果显示其与c31814.graph_c0相似度为97.10%,表明已成功克隆得到PrCT1基因,其全长序列及预测氨基酸序列见图1。利用NCBI的BLAST工具,发现PrCT1基因编码的氨基酸序列与菜青虫基因组中预测的chymotrypsin-1-like(GenBank登录号:XP_022112774.1)完全一致,其基因由5个外显子和4个内含子组成。与其他鳞翅目昆虫丝氨酸蛋白酶的同源性为34%~49%,其中,与黑脉金斑蝶(GenBank登录号:OWR53227)胰凝乳蛋白酶的同源性最高,达到49%,亲缘关系最近。PrCT1的1—18位氨基酸残基为信号肽,34—274位氨基酸残基为丝氨酸蛋白酶的特征结构域(Tryp_SPc domain)。去除N-末端信号肽后,预测分子质量为29.71 ku,理论等电点为9.23。

——表示活性相关的保守基序;*表示催化三联体位点(H57、D102、S195)—— indicates activity related conservation motif; * indicates conserved catalytic triad(H57,D102,S195)图1 菜青虫胰凝乳蛋白酶PrCT1基因核苷酸序列和推导的氨基酸序列
PrCT1的氨基酸序列中含有高度保守的催化三联体(H57、D102、S195)和成熟体活化位点RIVGG,且活性位点附近序列TAAHC和GDSGSAL,以及3对二硫键的半胱氨酸残基等相关活性元件都较为保守(图2A)[3-4,19-20]。HEDSTROM[3]与PERONA等[21]对丝氨酸蛋白酶底物特异性口袋分析、多序列比对显示,上述蛋白酶的底物特异性位点均是G189-G216-D226,因此,PrCT1属于胰凝乳蛋白酶,这与NCBI的BLAST搜索结果一致。系统进化树分析(图2B)表明,上述蛋白酶主要聚为2支,一支包括了PrCT1和蛱蝶科、螟蛾科、蚕蛾科、尺蛾科物种的丝氨酸蛋白酶,且PrCT1与黑脉金斑蝶在进化关系上较近;另一支由凤蝶科、天蛾科、菜蛾科、夜蛾科物种的丝氨酸蛋白酶组成。将多序列比对和系统进化树结合分析,发现进化关系越接近的物种其氨基酸序列相似性越高。
2.2 菜青虫胰凝乳蛋白酶PrCT1基因的原核表达及纯化情况
由于大肠杆菌表达体系无法切掉信号肽,因此,在构建pET28a-PrCT1重组载体时去掉了信号肽。重组载体转化Rosetta(DE3)菌株,27 ℃诱导过夜,经SDS-PAGE检测,发现重组菌株超声破碎的沉淀物中有1条分子质量为33.26 ku的诱导蛋白条带(图3A),其分子质量超过了PrCT1重组蛋白的分子质量。出现这种现象的原因是在重组蛋白N末端上游加入了His标签,导致表达蛋白的分子质量偏高。诱导表达的PrCT1重组蛋白出现在沉淀中,表明其以包涵体形式表达,还需后期的蛋白质复性。研究了不同温度及不同IPTG浓度对PrCT1表达的影响,发现温度为27 ℃时,PrCT1的表达量最高。IPTG浓度为0.1 mmol/L时即有大量重组蛋白表达。IPTG浓度的增加对PrCT1表达量没有明显的影响,因此,诱导温度为27 ℃、IPTG浓度为0.5 mmol/L是PrCT1的最佳诱导条件。将重组菌在最佳诱导条件下进行大量表达,收集菌体以超声波破碎,包涵体经洗涤、变性、Ni2+亲和层析获得纯化目的蛋白(图3B)。

黑色长方块表示相同的氨基酸;□表示较保守的氨基酸;★表示保守的催化三联体位点(H57、D102、S195);表示成熟体切割位点;▲表示底物特异性位点(189、216、226);●表示6个保守的半胱氨酸残基;─表示活性相关的保守基序
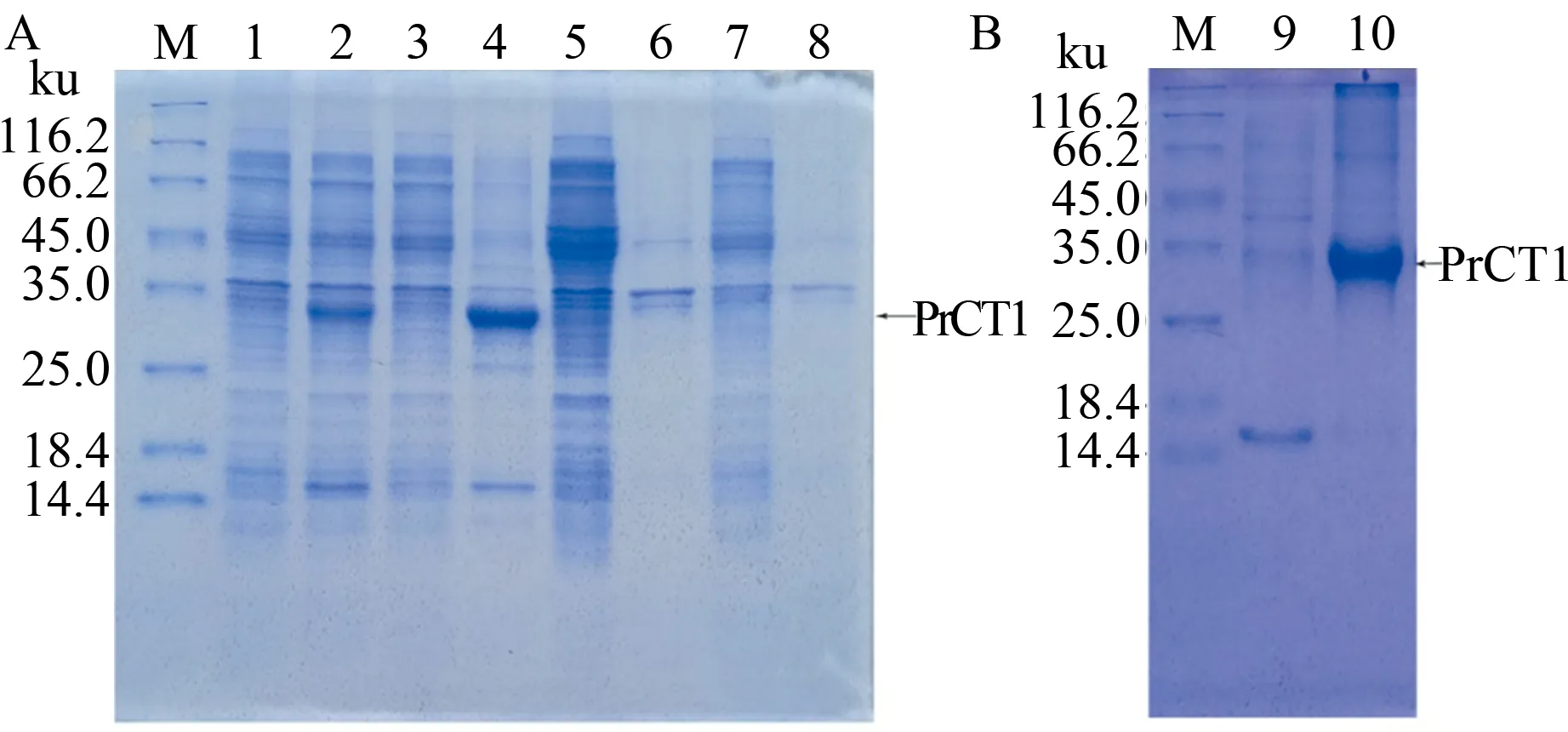
M:蛋白质分子质量标准;1:重组菌诱导前;2:重组菌诱导后;3:重组菌诱导破碎上清液;4:重组菌诱导破碎沉淀;5:重组菌未诱导破碎上清液;6:重组菌未诱导破碎沉淀;7:空载菌诱导破碎上清液;8:空载菌诱导破碎沉淀;9:10 mmol/L咪唑洗脱后的蛋白质;10:250 mmol/L咪唑洗脱后的蛋白质
M:Protein marker(standard);1:Before recombinant bacteria were induced by IPTG;2:After recombinant bacteria were induced by IPTG;3:Supernatant with ultrasonic disruption after the recombinant bacteria were induced by IPTG;4:Deposit with ultrasonic disruption after the recombinant bacteria were induced by IPTG;5:Supernatant with ultrasonic disruption after the recombinant bacteria were not induced by IPTG;6:Deposit with ultrasonic disruption after the recombinant bacteria were not induced by IPTG;7:Supernatant with ultrasonic disruption after the control bacteria were induced by IPTG;8:Deposit with ultrasonic disruption after the control bacteria were not induced by IPTG;9:Expression product eluted by 10 mmol/L imidazole;10:Expression product eluted by 250 mmol/L imidazole
图3 菜青虫胰凝乳蛋白酶PrCT1基因的原核重组表达(A)及纯化(B) 检测
Fig.3 Prokaryotic recombinant expression(A) and purification(B) detection of the chymotrypsinPrCT1gene ofPierisrapae
2.3 菜青虫胰凝乳蛋白酶PrCT1基因在不同组织中和不同胁迫处理条件下表达模式分析
将菜青虫解剖为头、尾、脂肪体和中肠,利用qRT-PCR检测PrCT1mRNA在菜青虫不同组织中表达情况(图4A)。结果显示,PrCT1基因在其4个组织中均有表达,但在不同组织中的表达水平差异显著,表现出组织特异性。其中,在中肠内的转录水平最高,其次是尾,脂肪体中表达量最低。昆虫中肠是食物消化、营养吸收的主要器官,而丝氨酸蛋白酶家族是鳞翅目昆虫幼虫中肠内最主要的蛋白质消化酶,家族成员主要包括胰蛋白酶和胰凝乳蛋白酶,其约占消化酶活性的95%[5],因此,PrCT1基因可能参与食物消化。
对菜青虫进行饥饿、COTI喂食胁迫处理,利用qRT-PCR检测PrCT1mRNA在中肠中的表达情况(图4B、C)。结果发现,菜青虫受到饥饿胁迫后,PrCT1的相对表达量在饥饿4 h后迅速下降,只有对照组的0.63%,8 h后表达水平略有升高,为对照组的11.90%,16 h后表达水平持续下降,仅为对照组的0.29%,表明PrCT1的表达情况与中肠食物量密切相关,推测其可能是菜青虫中肠内发挥食物消化作用的重要蛋白质。其中,饥饿8 h相对表达量略有升高,可能是消化体内储存的物质以供饥饿状态下生理活动需要所致。菜青虫在喂食含有COTI的叶片后,其表达水平也显著降低,仅为对照组的0.24%,表明其表达受到COTI的负调控,而蛋白酶抑制剂被昆虫摄食后,会抑制肠道内蛋白质水解酶活性或负调控其表达水平[5,22],因此,PrCT1基因可能是重要的抗虫靶点。
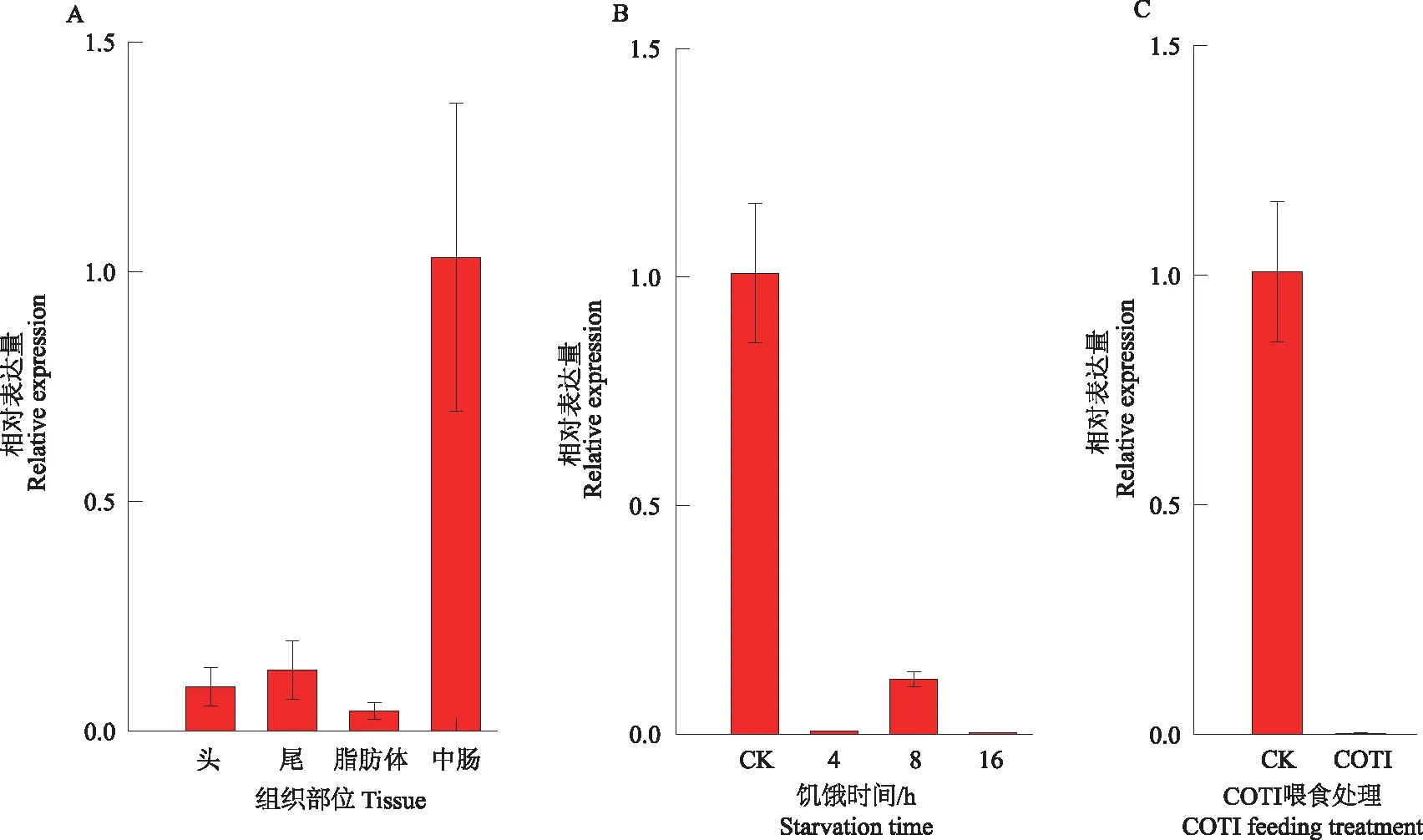
图4 菜青虫胰凝乳蛋白酶基因PrCT1 mRNA在不同组织中(A)和不同胁迫处理条件下(B、C)表达分析Fig.4 Expression analysis of the chymotrypsin PrCT1 mRNA of Pieris rapae in different tissues(A) and different stress treatment conditions(B and C)
3 结论与讨论
鳞翅目昆虫中肠内蛋白质的消化主要依靠胰凝乳蛋白酶等丝氨酸蛋白酶,占消化酶活性的95%[5]。在鳞翅目昆虫体内,胰凝乳蛋白酶的功能呈现多样化,各成员的具体功能及在生理活性中的作用仍不清楚,因此,有必要获取胰凝乳蛋白酶并对其开展功能研究。根据XIANG等[14]前期获得的菜青虫中肠转录组数据,从中筛选出11个胰凝乳蛋白酶基因和7个活性位点不完整的胰凝乳蛋白酶基因同源物。小菜蛾[23]与家蚕[24]中也存在多个胰凝乳蛋白酶活性位点不完整同源物,推测这些同源物可能参与昆虫对植物抗虫因子(尤其是植物蛋白酶抑制剂)的适应过程,有利于昆虫对植源性食物的消化。
经过序列比对,c31814.graph_c0所编码的氨基酸序列具有明显的丝氨酸蛋白酶的典型特征,即催化三联体(H57、D102、S195),这与已克隆得到的其他鳞翅目昆虫丝氨酸蛋白酶氨基酸序列拥有共同的酶活催化中心,但其同源性差异较大。丝氨酸蛋白酶根据底物口袋中3个特异性位点(189、216、226)氨基酸残基的差异,可分为胰蛋白酶、胰凝乳蛋白酶和弹性蛋白酶等不同类型。第189位的氨基酸残基位于底物口袋的底部,是决定酶催化底物特异性的最重要氨基酸;而第216位和第226位氨基酸位于酶底物口袋的入口处,限制了底物大小,若被替换为较大的氨基酸,将只有小分子底物能够进入底物口袋[3,21]。PrCT1的第189位氨基酸残基是甘氨酸,第216位和第226位氨基酸残基分别是甘氨酸与天门冬氨酸,侧链较小,形成了较大的入口,允许拥有较大侧链的芳香族氨基酸进入底物口袋,属于胰凝乳蛋白酶。
将PrCT1导入原核表达系统大肠杆菌中,通过不同IPTG浓度、不同温度诱导,发现27 ℃、0.5 mmol/L IPTG的诱导效果最好。融合蛋白的可溶性分析表明,在各种优化筛选条件下,PrCT1均为包涵体蛋白,这可能是由于目的蛋白合成速度较快,没有足够的时间进行加工,致使中间体大量积累,容易形成包涵体沉淀所致;还可能是由于丝氨酸蛋白酶为真核蛋白质,在原核系统中进行表达的时候,缺乏真核生物中翻译后修饰所需酶类,蛋白质内部的3对二硫键不能正确配对[25]所致。
蛋白酶参与消化过程的一个重要特点是在食物刺激下,其表达量会明显增加。很多研究通过饥饿处理试验来探究中肠丝氨酸蛋白酶与消化之间的关系,如斜纹夜蛾的类胰凝乳蛋白酶(Sfctlp1和Sfctlp2)均在饥饿后下调表达,重新喂食后上调表达[26-27],这表明饥饿处理昆虫幼虫后,中肠内与食物消化相关的蛋白酶表达下调。蛋白酶抑制剂是植物抵抗摄食昆虫的防御物质,其能够抑制昆虫丝氨酸类蛋白酶的活性,影响昆虫的营养吸收,从而抑制昆虫的正常生长发育与生理代谢,甚至导致死亡[28]。昆虫在与植物的长期斗争中产生了对植物源蛋白酶抑制剂的适应性进化,其中一种方式是诱导表达一些对蛋白酶抑制剂不敏感的新蛋白酶;另一种方式是提高蛋白酶的表达水平,以补偿蛋白酶抑制剂引起的蛋白酶活性损失[5]。由此,TELANG等[22]认为蛋白酶抑制剂发挥抗虫作用的靶点可能是那些敏感的蛋白酶,其能够与蛋白酶抑制剂结合,触发酶活性下降,亦或其表达水平会受到蛋白酶抑制剂的负调控。本研究中,PrCT1mRNA主要在菜青虫中肠表达,且经饥饿和喂食决明胰蛋白酶抑制剂COTI后其表达水平均下调,表明PrCT1的表达受中肠食物的诱导,但受COTI的抑制,推测PrCT1可能是菜青虫中肠中发挥食物消化作用的重要蛋白质,且可能是蛋白酶抑制剂重要的作用靶点。后续将进一步对PrCT1开展复性研究,检测COTI对其是否具有抑制作用。

