大鼠体外循环术后认知功能障碍与海马缺氧关联机制的研究
杞春佚,肖应丽,黄 瀚
(四川大学华西妇产儿童医院 麻醉科, 四川 成都 610041)
术后认知功能障碍(Postoperative cognitive dysfunction,POCD)是手术麻醉后的中枢神经系统严重并发症,患者往往伴随精神错乱、人格改变以及记忆受损等神经认知功能障碍的相关症状[1]。据统计,体外循环术后POCD发病率高达60%,因此,体外循环术被认为是与POCD最密切的危险因素之一[2]。研究表明,体外循环过程中会形成大量的微血栓,这些微血栓可通过阻塞脑微血管而影响某些脑区的供血[3]。由于中枢神经系统中的神经元对缺血缺氧的耐受力极差,若阻塞血管的供血区无法建立有效的侧支循环则可能会造成神经元的缺氧性损伤。此外,在缺血缺氧条件下,中枢神经系统会呈现以胶质细胞活化及炎症因子过表达为特征的神经炎症状态,从而导致神经元的凋亡及坏死[4]。众所周知,海马体是掌管学习、记忆等认知功能的责任脑区。动物实验发现,体外循环术后POCD模型大鼠的海马区的缺氧相关标记物的表达明显上调,且与海马神经元的损伤及凋亡密切相关[5]。因此,本研究以体外循环术后海马缺氧性损伤为切入点,研究体外循环术与POCD发生的关联机制。
1 材料与方法
1.1 实验动物及分组 认知功能正常的雄性SD大鼠40只(2~3月龄,250~300 g,购自成都达硕实验动物公司,SCXK(川)2015-030),随机分为两组,即:假手术组和体外循环组,每组20只。体外循环组大鼠接受体外循环术,并维持转机2 h;假手术组大鼠仅做伤口对照,不建立体外循环。
1.2 实验方法
1.2.1 体外循环术 实验大鼠术前8 h禁食禁水,称重后腹腔注射戊巴比妥钠(北京华业寰宇化工有限公司)30 mg/kg,待充分麻醉后置入气管导管,连接呼吸机(美国Datex-Ohmeda公司)进行机械通气。手术区域局部浸润麻醉后,暴露右股动脉,接动脉导管及血压监测装置(北京中西远大科技有限公司)进行有创血压监测。提前向体外循环管道内注入预冲液4 mL [生理盐水(四川科伦药业股份有限公司):羟乙基淀粉注射液(杭州民生药业有限公司):碳酸氢钠注射液(四川科伦药业股份有限公司):甘露醇注射液(四川科伦药业股份有限公司)=11∶7∶1∶1]。开放大鼠尾动脉及右颈外静脉,与体外循环管道相连。从静脉通道加入肝素(江苏万邦生化医药集团有限责任公司)400 IU/kg,待ACT480s后开始转机。体外循环起始流量为35 mL/(kg·min),随后增加至100~120 mL/(kg·min),灌注压维持在60~100 mmHg之间,由氧合器供养,保持氧流量:灌注流量为0.8~1。根据血气分析及ACT结果调控内环境稳态,密切监测生命体征。维持转机2 h,在停止转机前经静脉端注射1 mg鱼精蛋白(上海第一生化药业有限公司),呋塞米(安徽国森药业有限公司)0.4 mg/kg,血流动力学稳定后停机,拔除动静脉导管,缝合伤口。假手术组大鼠仅暴露尾动脉及右颈外静脉,不进行体外循环术,其余操作同体外循环组大鼠。
1.2.2 水迷宫实验 在实验前1 d,将所有大鼠置入 Morris 水迷宫系统(上海欣软科技有限公司)进行预适应,体外循环术后1、3、7 d,进行正式实验。将水迷宫分为IV四个象限,逃逸平台置于第一象限,受试大鼠分别从各个象限的固定点放入水迷宫中,大鼠发现隐匿于第一象限水面之下的逃逸平台所花时间记录为逃逸潜伏期。若在 90 s 内尚未找到隐匿平台,则记录逃逸潜伏期为90 s,并将其引导至平台停留15 s,再进行下一次检测。每只大鼠进行3次检测,取平均值。利用Morris 水迷宫系统记录每只受试大鼠的游泳速度(mm/s)和逃避潜伏期(s),所得结果作为评价认知功能的行为学指标。
1.2.3 海马取材 于术后1、3、7 d行为学检测后,腹腔注射戊巴比妥钠30 mg/kg,暴露心脏, 使用PBS进行心脏灌注,待灌注充分后实施海马取材。
1.2.4 Western blot检测海马组织缺氧探针hypoxyprobe-1及Iba-1的表达 将海马组织剪碎,并加入含有蛋白酶抑制剂的RIPA裂解液,超声破碎仪使其充分裂解。裂解液离心提取上清,采用BCA法检测蛋白浓度。配置好浓缩胶及分离胶后,将样本滴加到SDS-PAGE上样孔中开始进行电泳。电泳结束后取出凝胶,将蛋白质转印到PVDF膜上。5%脱脂奶粉封闭非特异性抗原,TBST洗涤3次后,将膜置入5 mL hypoxyprobe-1(Abcam)、Iba-1(Abcam)、β-actin(碧云天)一抗稀释缓冲液(1∶1 000),4下摇床孵育过夜。次日,取出PVDF膜,TBST洗涤3次后,置入含辣根过氧化酶的二抗稀释液(1∶2 000)室温孵育1 h。最后,滴加ECL显影液,上机曝光,拍照,ImageJ分析相对表达量。
1.2.5 免疫荧光检测海马组织缺氧探针hypoxyprobe-1及Iba-1的表达 海马组织用30%蔗糖溶液脱水至沉底,再用4%多聚甲醛固定12 h,保存至-80 ℃冰箱。取出组织,用OCT包埋后,在-20 ℃冰冻切片机中进行海马组织切片,厚度设置为10 μm。切片制作完毕后,滴加含0.3%Triton-X 100的10%山羊血清溶液封闭通透1 h。充分洗涤,再滴加hypoxyprobe-1(Abcam,1∶500)、Iba-1(Abcam,1∶100)荧光一抗稀释液,4下孵育过夜。次日,室温避光孵育荧光二抗(Abcam,1∶1 000)1 h。滴加DAPI(碧云天)溶液,避光孵育15 min。最后,在荧光显微镜下拍照、分析。
1.2.6 ELISA检测脑组织中炎症因子IL-6、TNF-的表达 取出海马组织,充分匀浆、离心后提取上清液。BCA法检测蛋白浓度,按照IFN-γ、TNF-α试剂盒(碧云天)说明书操作步骤,在酶标仪中检测各样本中IFN-γ、TNF-α的表达量。

2 结果
本研究共有37只大鼠完成实验,体外循环组共18只,术中死亡1例,术后第3天死亡1例。假手术组共19只,其中术中死亡1例。两组大鼠的实验完成率比较,差异无统计学意义(P>0.05 )。
2.1 两组大鼠认知功能检测 两组大鼠的逃避潜伏期均有随时间变化的趋势,随着时间的进展,两组大鼠的逃避潜伏期均明显缩短(P<0.05);此外,两组大鼠的分组与时间存在明显的交互作用,于术后1、3、7 d,体外循环组大鼠的逃避潜伏期相比于假手术组均明显延长(P<0.05)。两组的游泳速度比较无明显差异(P>0.05,见图1)。

A:两组大鼠不同时间点的Morris水迷宫轨迹; B:两组大鼠不同时间点的的隐秘平台逃避潜伏期及游泳速度; *:同一时间点与假手术组相比,P<0.05;#:表示与同组内术前1 d相比,P<0.05。图1 两组大鼠Morris水迷宫实验
2.2 两组大鼠海马组织缺氧情况检测 术后1、3、7 d完成Morris水迷宫实验后,采用免疫荧光及Western blot检测缺氧探针hypoxyprobe-1的表达水平。免疫荧光结果表明,术后1、3、7 d体外循环组大鼠海马CA3区出现明显的缺氧病灶,而假手术组海马无明显变化(见图2 A)。两组大鼠hypoxyprobe-1的相对表达量存在分组与时间的交互效应,术后1、3、7d体外循环组大鼠海马hypoxyprobe-1的相对表达量均显著高于假手术组(P<0.05);此外,体外循环组大鼠hypoxyprobe-1的相对表达量有随时间变化的趋势,hypoxyprobe-1的相对表达量随时间进展而显著降低(P<0.05,见图2 B、C)。
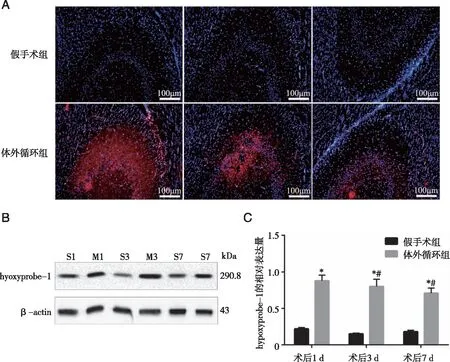
A :免疫荧光染色检测术后1、3、7 d两组大鼠海马缺氧探针hypoxyprobe-1的表达(蓝色表示DAPI核染色,红色表示hypoxyprobe-1的表达); B:两组大鼠术后1、3、7 d hypoxyprobe-1的Western blot条带 ;C :两组大鼠hypoxyprobe-1的相对定量分析;S:假手术组,M:代表体外循环组;*:同一时间点与假手术组相比,P<0.05;#:与同组内术后1 d相比,P<0.05。图2 两组大鼠海马组织缺氧情况检测
2.3 两组大鼠海马区小胶质细胞活化情况 术后1、3、7 d完成水迷宫实验后,采用免疫荧光及Western blot检测两组海马中小胶质细胞的标记物Iba-1的表达变化。免疫荧光染色结果表明,术后1、3、7 d体外循环术组大鼠海马中小胶质细胞荧光强度明显增强,而假手术组无明显变化(见图3A)。两组大鼠Iba-1的相对表达量存在分组与时间的交互效应,术后1、3、7 d体外循环组大鼠海马Iba-1的相对表达量均显著高于假手术组(P<0.05);此外,体外循环组大鼠Iba-1的相对表达量有随时间变化的趋势,hypoxyprobe-1的相对表达量随时间进展而显著降低(P<0.05,见图3 B、C)。
2.4 两组大鼠海马炎症因子释放情况 为进一步评价海马中的神经炎症情况,采用ELISA检测两组大鼠海马中炎症因子TNF-α及IFN-γ的水平。结果表明,两组大鼠TNF-α及IFN-γ的水平存在分组与时间的交互效应,术后1、3、7 d体外循环组大鼠海马TNF-α及IFN-γ的水平均显著高于假手术组(P<0.05);此外,体外循环组大鼠TNF-α及IFN-γ的水平有随时间变化的趋势,随时间进展而显著升高(P<0.05,见图4)。

A :免疫荧光染色检测术后1、3、7 d两组大鼠海马小胶质细胞标记物Iba-1的表达(蓝色表示DAPI核染色,绿色表示Iba-1的表达); B:两组大鼠术后1、3、7 d Iba-1的Western blot条带 ;C :两组大鼠Iba-1的相对定量分析;S:假手术组,M:代表体外循环组;*:同一时间点与假手术组相比,P<0.05;#:与同组内术后1 d相比,P<0.05。图3 两组大鼠海马小胶质细胞活化情况

A:两组大鼠不同时间点海马中TNF-α的释放水平; B:两组大鼠不同时间点海马中IFN-γ的释放水平; *:同一时间点与假手术组相比,P<0.05;#:与同组内术后1 d相比,P<0.05。图4 两组大鼠海马炎症因子释放情况
3 讨论
POCD是麻醉手术后最常见的神经系统并发症,可延长住院时间,增加远期并发症发生率和死亡率,从而严重影响患者的术后转归[6]。在POCD的诸多影响因素中,体外循环术是不容忽视的高危因素,作为心脏手术中的高级生命支持手段,体外循环术后POCD的发生率远远高于其他影响因素,高达60%以上[7]。然而,体外循环术导致POCD发生的潜在机制尚不可知。因此,我们通过建立大鼠的体外循环术后POCD模型,以期探讨体外循环术导致POCD关联机制。结果表明,体外循环组大鼠从术后1d开始出现认知功能降低的行为学表现,尽管随着时间的进展虽有一定地自愈倾向,但术后7d的认知功能仍显著低于假手术组,提示体外循环可成功诱导出大鼠的POCD症状;同时,通过免疫荧光染色发现大鼠的海马CA3区在体外循环术后出现明显缺氧灶,而且在缺氧灶及其周围还观察到小胶质细胞的增殖、活化以及炎症因子TNF-α、IFN-γ的表达上调,上述变化提示体外循环术可导致大鼠海马CA3区发生缺氧及神经炎症现象。
学习和记忆等认知能力降低不仅是POCD的典型症状,也是其主要诊断标准[8]。作为评价实验动物学习、记忆等相关认知功能的常用评价工具,Morris水迷宫从上世纪80年代起一直沿用至今[9]。因此,本研究选择Morris水迷宫对体外循环术后大鼠的认知功能进行检测。结果发现,体外循环组大鼠的隐匿平台逃避潜伏期从术后1d开始延长,且重复实验后探索时间无明显缩短,提示体外循环术后大鼠对于空间记忆以及学习的能力显著降低,即典型的认知功能下降表现。然而,两组的游泳速度之间无明显差异,说明体外循环术并未影响其运动功能。因此,行为学结果提示大鼠实施体外循环术可诱导出大鼠的POCD症状。理想的动物模型是深入挖掘体外循环导致POCD相关机制的关键,本研究采用的大鼠体外循环模型是参照段铭杰等[10]改进的大鼠无血预充非停跳体外循环后认知功能障碍模型,该模型的优点是创伤小,操作简便,术后1d即可进行水迷宫行为学检测。相应地,本研究体外循环大鼠术后认知功能改变与他们的结果相似,即在术后1d就出现显著降低。此外,本研究体外循环组中两只死亡大鼠的死因分别是术中气管导管脱落和术后伤口出血,并非体外循环术直接导致的死亡,提示该模型具有较好的安全性。
尽管体外循环术与POCD联系紧密,但对其关联机制却知之甚少。早期Goto等[11]通过核磁共振发现,体外循环术后大脑出现大量微梗死灶,其主要原因是由于体外循环术中形成的大量微血栓阻塞血管而导致脑组织的缺血缺氧。通过缺氧探针hypoxyprobe-1的免疫荧管染色,我们观察到体外循环术后大鼠的海马CA3区出现明显缺氧灶,提示微血栓对CA3区的供血动脉造成阻塞,这可能与其特殊的血管分布有关。海马的血液供应依赖于海马纵动脉,其包含两大分支:海马内侧横动脉和海马外侧横动脉,而CA3区仅仅由内侧横动脉提供血液供应,当内侧横动脉发生栓塞后则无法建立侧支循环而导致缺血缺氧[12]。因此,体外循环术中产生的微血栓一旦堵塞CA3区滋养血管即可导致相应脑组织缺血缺氧。
目前认为,POCD主要与以下病理改变有关,包括:神经元退行性变及凋亡、血脑屏障功能障碍、神经炎症等[13]。一直以来,神经炎症被看做是POCD发生发展的中心环节,过表达的炎症因子可诱导神经元的凋亡及坏死。临床研究发现, POCD患者脑脊液中炎症因子及细胞的数量显著上调,提示POCD患者出现中枢的神经炎症,但值得注意的是,并非所有出现中枢神经炎症的患者均发生POCD,说明中枢的神经炎症仅仅是POCD的必要条件而不是充分条件[14]。众所周知,海马作为学习、记忆等认知功能的责任脑区,是否发生认知功能障碍往往取决于海马区有无损害。相应地,前期研究对POCD大鼠的海马进行取材,发现海马中出现以小胶质细胞增殖、活化为特征的神经炎症[15]。同样地,本研究通过免疫荧光染色及ELISA发现,体外循环术后大鼠海马CA3区的小胶质细胞明显活化及炎症因子TNF-α、IFN-γ显著上调,说明体外循环术后POCD大鼠的神经炎症主要发生在海马CA3区。
不难发现,体外循环术后小胶质细胞活化的部位与海马缺氧部位基本一致,均发生在海马的CA3区。故阐明海马CA3区缺血缺氧与神经炎症之间的关系可能对揭示体外循环术与POCD之间的关联机制有重要的意义。Chu 等[16]在有关缺氧性脑病的研究中发现缺氧灶中小胶质细胞明显活化,Koh等[17]进一步发现,缺氧条件中表达上调的缺氧诱导因子α(HIF-1α)可直接激活小胶质细胞内的活化信号并促进其释放炎症介质。因此,上述研究提示缺氧的确可诱导小胶质细胞的活化。相应地,在本研究中,我们有理由相信体外循环过程中微血栓所致的海马CA3区缺血缺氧可诱导该部位小胶质细胞的活化及神经炎症的进展,从而导致CA3区神经元的损伤,最终出现POCD的相关症状。
综上所述,本研究发现体外循环术导致大鼠出现POCD的相关表现,并且两者之间的关联机制可能与海马CA3区梗死缺氧所致的小胶质细胞活化及神经炎症反应有关。
——体外循环质量控制的基石

