基于单(6-巯基-6-去氧)-β-环糊精修饰金电极对L-半胱氨酸的快速灵敏检测
彭与煜, 王 煜, 于鑫垚, 曾巨澜, 肖忠良, 曹 忠
(长沙理工大学化学与生物工程学院, 电力与交通材料保护湖南省重点实验室, 长沙 410114)
L-半胱氨酸(L-Cys)作为一种脂肪族含巯基的极性α-氨基酸, 是人体的条件必需氨基酸和生糖氨基酸, 在体内蛋白质折叠、 代谢和转运、 解毒以及对重金属的亲和力等生理过程中起着至关重要的作用[1~3].L-Cys还是生物体多种疾病如肝损伤、 心脏病、 皮肤病、 败血症、 艾滋病、 帕金森症和阿尔茨海默氏病以及癌症等治疗的标志物和重要配方药品[4~6], 但过多服用L-Cys也会造成人体血糖的降低和中枢神经损伤[2,7]. 因此, 快速灵敏检测L-Cys方法的发展变得至关重要, 并引起了广泛关注.
目前, 检测L-Cys的常用方法有比色法[8,9]、 分光光度法[10]、 拉曼光谱法[11]、 高效液相色谱法[12]、 气相色谱-质谱联用法[13]、 液相色谱-质谱联用法[14]、 荧光分析法[15]及光电化学分析法[16]等, 这些方法多数需要昂贵的精密仪器或复杂的样品制备流程, 不方便实地实时使用. 目前, 现场环境实时检测、 移动实验室和便携式检测仪器等方法具有良好的发展前景[17~21], 其中简单、 快速的电化学传感分析方法被逐渐应用于检测氨基酸等含氮分子[21~27]. Selvarajan等[28]将NH2—官能化的BaTiO3纳米颗粒悬浮在三维基质的琼脂糖膜中, 通过电流-电压技术构建了一个自供能的L-Cys传感器, 并通过非侵入式方法对尿液中的L-Cys进行实时检测, 该方法具有良好的选择性和线性范围, 检测下限达到10 μmol/L. Amini等[29]制备了双水杨醛邻苯二胺钴配合物修饰的碳糊电极, 其对半胱氨酸有灵敏电位响应, 线性范围为2~10 μmol/L, 检测下限为1 μmol/L. Bai等[30]采用电化学共沉积法制备了β-二氧化锰纳米线-壳聚糖修饰玻碳电极, 该电极对L-Cys显示出优异的电催化氧化电流响应, 测定范围达到0.5~630 μmol/L, 检测下限为70 nmol/L.
尽管电流型电化学传感器的响应性能在不断提高, 但与电位型电化学传感器相比, 其仍存在操作流程较繁琐、 仪器电路设计较复杂及不方便携带等问题; 而电位型电化学传感器如选择性膜电极具有制作简单、 便于携带、 易于微型化和实时监测等特点[21,31~38], 且适用于在线和现场分析, 在测定无机离子和含氮有机分子方面有良好的应用前景. Shahrokhian[36]制备了一种基于铅酞菁作为离子载体的L-Cys选择性电极, 将铅酞花青结合到增塑的聚氯乙烯膜中, 电极具有良好的长期稳定性和抗干扰能力, 其检测L-Cys的线性范围为1×10-6~5×10-2mol/L, 标准曲线斜率为-57.8 mV/pc, 检测下限为1.0×10-6mol/L. 目前, 用于高选择性、 高灵敏性测定生物体液中L-Cys的电位型传感分析方法仍然极具挑战性.
β-环糊精(β-CD)是直链淀粉在环糊精葡萄糖基转移酶作用下生成的由7个吡喃葡萄糖单元组成的环状低聚糖[39].β-环糊精具有外缘亲水而内腔疏水的特殊筒状结构, 可以与多种金属离子、 生物药物分子及有机分子等结合形成主客体包合物, 从而备受关注[40~45], 特别是可以将其应用于氨基酸含氮小分子的识别检测[22,46]. 但迄今鲜见基于巯基功能化β-环糊精修饰电极用于L-Cys检测的电位型传感器的研究报道.
基于此, 本文通过分子自组装方法将(6-巯基-6-去氧)-β-环糊精修饰在金电极表面, 构建了一种成本低、 响应快、 灵敏度高且易于微型化的电位型电化学传感器. 该电极对L-Cys有良好的电位响应性能, 可用于猪血清和尿液中L-Cys的快速灵敏检测, 检测下限达到6.0×10-8mol/L, 在生命科学、 生物医学和畜禽健康养殖等领域有良好的应用前景.
1 实验部分
1.1 试剂与仪器

Fig.1 Structures of HS-β-CD(A) and L-Cys(B)
单(6-巯基-6-去氧)-β-环糊精(HS-β-CD, C42H70O34S,Mw=1151.05), 结构如图1(A)所示, 购于山东滨州智源生物科技有限公司;L-Cys[结构见图1(B)]、L-缬氨酸(L-Val)、L-色氨酸(L-Trp)、L-苯丙氨酸(L-Phe)、L-亮氨酸(L-Leu)、L-苏氨酸(L-Thr)、L-丙氨酸(L-Ala)、L-异亮氨酸(L-Ile)、L-甘氨酸(L-Gly)、L-精氨酸(L-Arg)、L-脯氨酸(L-Pro)、L-胱氨酸(L-Cyn)、L-甲硫氨酸(L-Met)、L-组氨酸(L-His)、L-赖氨酸(L-Lys)、 尿酸(UA)、 葡萄糖(GLC)以及NaH2PO4·2H2O和Na2HPO4·12H2O均购于国药集团化学试剂有限公司(上海); 铁氰化钾和亚铁氰化钾、 乙醇、 盐酸、 氢氧化钠、 氯化钙、 氯化钾及氯化钠购于湖南试剂厂(株洲). 所用试剂均为分析纯, 实验用水为超纯水(电导率≥18.3 MΩ·cm).
奥利龙868型pH/mV计(美国Thermo Orion公司); PHSJ-3F型酸度计(上海雷磁仪器厂); 217型双盐桥饱和甘汞电极(上海康宁电光技术有限公司); CHI-760B型电化学工作站(上海辰华仪器有限公司); KQ3200B型超声波清洗器(昆山市超声仪器有限公司); JCP-ZZ-200B型磁控溅射/蒸镀多功能一体化镀膜机(北京泰科诺科技有限公司); EBV-6DA型热蒸镀仪(日本ULVAC公司); MIRA3型场发射扫描电子显微镜(SEM, 捷克TESCAN公司); K-Alpha 1063型X射线光电子能谱仪(XPS, 英国Thermo Fisher公司); Agilent 1260型高效液相色谱仪(HPLC, 美国Agilent公司).
1.2 HS-β-CD/GE电极的制备
将双氧水和浓硫酸按体积比1∶3混合配制Piranha溶液. 将金电极在超纯水中超声清洗5 min, 再依次用1.0, 0.3和0.05 μm的Al2O3粉打磨抛光, 分别在乙醇和超纯水中超声清洗5 min, 自然晾干后置于Piranha溶液中浸泡20 min, 再依次用超纯水、 乙醇和超纯水超声清洗, 自然晾干; 将该裸金电极浸泡于5×10-3mol/L HS-β-CD的氢氧化钠溶液中24 h; 将HS-β-CD自组装膜修饰的金电极取出, 分别用乙醇和超纯水洗净, 干燥后备用.
1.3 HS-β-CD/GE电极的性能测试
以5.0 mmol/L的K3Fe(CN)6/K4Fe(CN)6和0.5 mol/L Na2SO4溶液为氧化还原电解质溶液, 采用交流阻抗和循环伏安(CV)法检测自组装膜修饰电极的性能. 以双盐桥饱和甘汞电极为参比电极, HS-β-CD修饰的金电极为工作电极, 采用标准曲线法测定样品溶液中的L-Cys. 使用的PBS缓冲溶液(0.010 mol/L)的pH=3.0~9.0, 其配制方法是将一定比例的NaH2PO4·2H2O, Na2HPO4·12H2O和NaCl溶于超纯水, 通过滴加盐酸校正pH值. 新鲜配制的L-Cys标准溶液的浓度为1.0×10-2mol/L, 用缓冲液逐级稀释后备用.
1.4 样品前处理及L-Cys的测定
猪血清和猪尿液样品来源于6头活体三元杂小猪(体重7~15 kg), 由中国科学院亚热带农业生态研究所畜禽健康养殖实验室提供. 分别将不同来源的6个猪血清和6个猪尿液样品于8000 r/min转速下离心处理10 min, 取上层清液用pH=6.0的PBS缓冲液稀释10倍, 采用HS-β-CD/GE电极测定L-Cys的含量, 并与高效液相色谱法测定结果进行比较, 同时进行加标回收率测定.
2 结果与讨论
2.1 HS-β-CD/GE电极的SEM表征
采用SEM对裸GE电极、 HS-β-CD/GE电极及检测L-Cys后的电极(L-Cys/HS-β-CD/GE)的表面形貌进行了测试, 结果如图2所示. 可见, 裸金电极表面的颗粒较整齐光滑[图2(A)], HS-β-CD/GE电极表面的颗粒包裹有絮状薄层物质[图2(B)], 说明HS-β-CD通过Au—S键自组装在金电极表面, 而检测L-Cys后电极表面的粗糙程度加大, 吸附物增多[图2(C)], 表明L-Cys通过分子间作用吸附结合在HS-β-CD/GE膜表面.

Fig.2 SEM images of electrode surfaces for bare GE(A), HS-β-CD/GE(B) and L-Cys/HS-β-CD/GE(C) electrodes
2.2 HS-β-CD/GE电极的响应原理及电化学性能
HS-β-CD是一种环状巯基化合物, 一端含有巯基, 另一端是口腔状的环形结构, 口腔环内部疏水, 外部亲水. 其一端的巯基可与Au通过Au—S键组装在金电极表面, 另一端的口腔环上亲水的羟基(OH—)可通过分子间作用力与L-Cys的巯基(SH—)和氨基(NH2—)形成氢键, 使L-Cys部分进入环糊精空腔, 产生包合作用[39,47], 从而导致HS-β-CD/GE电极表面膜电位发生变化, 实现对L-Cys的超分子识别, 其响应识别过程示意图如图3所示.

Fig.3 Schematic illustration of the response process of HS-β-CD/GE for L-Cys
为了探讨自组装金电极膜表面与L-Cys的相互作用关系, 采用循环伏安和交流阻抗法考察了上述不同电极在5.0 mmol/L K3Fe(CN)6/K4Fe(CN)6和 0.5 mol/L Na2SO4介质溶液中的电化学行为, 结果如图4所示. 图4谱线a为裸金电极, 电流值较大, 且对应的阻抗值很小, 说明裸金电极具有强传递电子能力. 谱线b为HS-β-CD修饰金电极, 由图4(A)可见, 修饰后电极的电流值变小, 相应的交流阻抗谱图[图4(B)]中高频部分出现半圆, 阻抗值明显增大, 说明HS-β-CD通过一端的巯基在金表面上形成了不导电的单分子自组装膜层, 阻碍了[Fe(CN)6]3-/4-在电极表面的电子传递. 修饰L-Cys(1.0×10-4mol/L)后, 电极的电流值增大[图4(A)谱线c], 阻抗值相应地减小[图4(B)谱线c], 这是由于HS-β-CD通过另一端的环糊精空腔和L-Cys发生的强超分子结合作用而吸附了带负电荷的L-Cys,L-Cys参与了电极表面的电子转移过程, 增强了电子传导性, 所以界面阻抗减小, 其阻抗的变化趋势能从相应的循环伏安谱图中得到印证[如图4(A)所示], 表明该方法用于L-Cys的识别检测具有可行性.
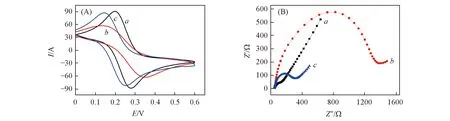
Fig.4 Cyclic voltammetry(A) and impedance(B) curves of bare GE(a), HS-β-CD/GE(b), and L-Cys/HS-β-CD/GE(c) electrodes in the media solution of containing 5.0 mmol/L K3Fe(CN)6/K4Fe(CN)6 and 0.5 mol/L Na2SO4
2.3 HS-β-CD/GE电极的XPS表征
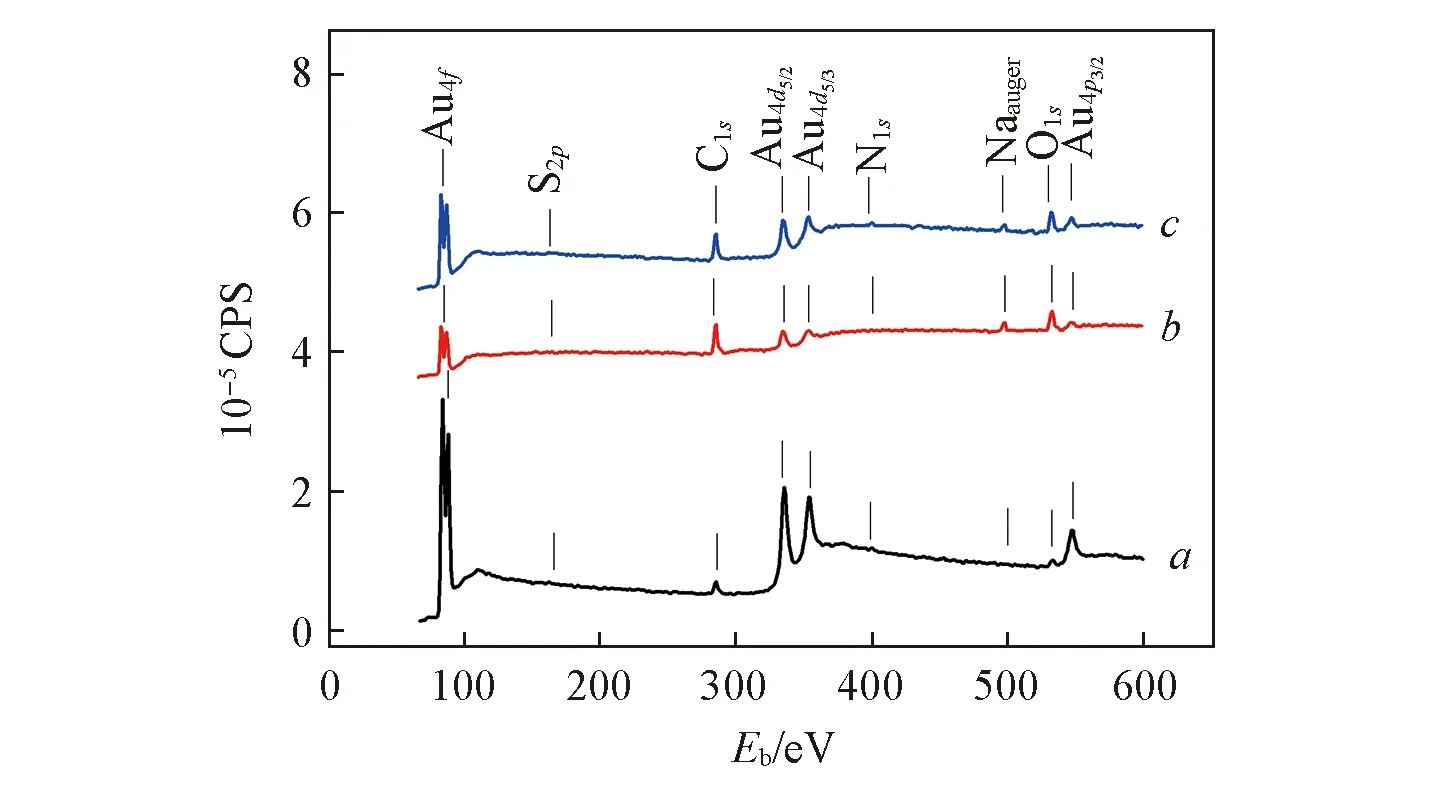
Fig.5 XPS spectra of the surfaces for bare GE(a), HS-β-CD/GE (b) and L-Cys/HS-β-CD/GE(c) electrodes
为了进一步研究HS-β-CD 修饰金电极与L-Cys 的作用机理, 采用X射线光电子能谱对裸GE, HS-β-CD/GE及L-Cys/HS-β-CD/GE电极表面进行了测试. 由XPS能谱图(图5)分析其元素组成可以发现修饰电极与目标物之间的相互作用关系[35,48]. 由图5可知, 与裸金电极(谱线a)相比, 自组装HS-β-CD后电极(谱线b)的Au4f, Au4d和Au4p峰的强度明显下降, 其中Au4f的结合能从84.20 eV降低为83.58 eV, 下降了0.62 eV, 且C1s和O1s峰的强度明显增大, 这是由于组装HS-β-CD后电极表面形成了不导电的薄膜, HS-β-CD导致表面C和O的含量增加. 检测L-Cys后,L-Cys/HS-β-CD/GE电极(谱线c)与HS-β-CD/GE电极(谱线b)相比, 表面N1s峰的强度有所增大, 这是由于加入L-Cys后, 带负电的L-Cys以分子间作用力结合在HS-β-CD膜上或经包合进入环糊精空腔而导致表面N元素含量的增加; 而Au4f, Au4d和Au4p峰的强度明显增大, 说明电极表面导电性相对于HS-β-CD/GE(谱线b)有所增强, 这与上述电化学循环伏安和交流阻抗表征结果一致, 证明了HS-β-CD/GE对L-Cys的超分子识别作用.
2.4 HS-β-CD/GE电极的最佳修饰时间
研究了HS-β-CD/GE在pH=6.0条件下, 修饰时间分别为4, 8, 12, 24, 36和48 h时, 电极电位随L-Cys浓度(1.0×10-7~1.0×10-4mol/L)的变化关系[图6(A)], 并依次求出其线性响应段的斜率, 作出斜率与修饰时间的关系图[图6(B)]. 由图6(A)可见, 该电极在修饰时间为8, 12和24 h时具有较高线性拟合度, 其中24 h时的线性响应范围最宽; 由图6(B)可见, 电极修饰时间相对延长(如24 h)时响应性能稳定性和重现性更好. 因此, 选择24 h作为电极的最佳修饰时间.

Fig.6 Typical potential response curves to L-Cys at different modification time(A) and effect of electrode sensitivity on modification time(B)(A) Modification time/h: a. 4; b. 8; c. 12; d. 24; d. 36; f. 48.
2.5 HS-β-CD/GE电极的最佳pH值
研究了在pH值分别为3.0, 4.0, 5.0, 5.5, 6.0, 6.5, 7.0, 8.0和9.0的PBS缓冲溶液条件下, HS-β-CD/GE电极电位随L-Cys浓度的变化关系, 并依此求出响应斜率, 绘制了不同pH条件下电位差随浓度变化曲线以及斜率与pH关系曲线(图7). 由图7(A)可见, 该电极在弱酸性(pH=5.0~6.0)条件下对L-Cys的响应灵敏度较一致, 当pH=6.0时, 其斜率值为(-65.29±1.0) mV/pc(25 ℃), 接近能斯特响应斜率的理论值; 由图7(B)可见, 电极在pH分别为5.0, 5.5和6.0时均具有良好的响应线性关系, 而电极在pH=6.0时的响应稳定性、 检测限等性能较好, 故选择最佳的pH值为6.0.
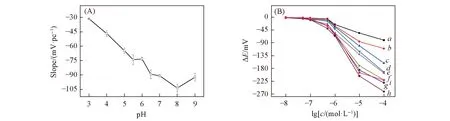
Fig.7 Effect of electrode sensitivity on pH(A) and corresponding potential response curves for L-Cys at different pH values(B)(B) pH value: a. 3; b. 4; c. 5; d. 5.5; e. 6; f. 6.5; g. 7; h. 8 ; i. 9.
2.6 HS-β-CD/GE电极的响应性能
在优化的实验条件下, 考察了HS-β-CD/GE电极对L-Cys 的电位响应性能. 图8为该电极在PBS缓冲溶液(pH=6.0)中对浓度为1.0×10-10~1.0×10-4mol/L的L-Cys进行检测得到的电位响应随浓度变化的曲线图. 可见, 随着L-Cys 浓度的增大, 电极电位逐渐降低, 说明修饰电极表面键合的L-Cys数量增加, 且该电极与L-Cys浓度在1.0×10-7~1.0×10-4mol/L范围内具有良好的线性关系, 采用最小二乘法拟合得到线性方程为ΔE=-65.29lgc-464.5, 根据作图法[49]得到其检测下限为6.0×10-8mol/L.

Fig.8 Potential response curve of HS-β-CD/GE to L-Cys in PBS(pH=6.0) with various concentrationsThe red lines are the fitted curves of potential change vs. logarithmic concentration of L-Cys.
2.7 响应时间、 稳定性和重现性
考察了HS-β-CD/GE电极对不同浓度L-Cys 检测所得电位信号随响应时间的动态变化及其稳定性情况. 图9(A)为在PBS缓冲溶液(pH=6.0)中加入不同浓度(1.0×10-8~1.0×10-4mol/L)L-Cys后的动态电位变化曲线图. 可见, 在测试浓度范围内电极电位每次达到电位平衡的反应时间均较短, 以达到电位响应最大值的90%来计算[见图9(B)], 其响应时间为63 s, 表明该电极对L-Cys具有较快的响应速度. 当电位随着时间的延长而逐渐趋向于稳定时, 加入下一个浓度进行检测, 同时也说明电极的响应性能稳定. 随后, 用该电极对浓度为1.0×10-6mol/L的L-Cys样品连续监测30 min, 电位漂移<±2.0 mV(n=11), 所得电位数据的相对标准偏差为2.5%, 表明该电位传感器具有良好的稳定性. 用该电极对L-Cys样品检测30 d后, 其响应斜率为-77.4 mV/pc, 下降了18.56%, 说明该电极可以使用至少30 d, 具有较长的使用寿命.
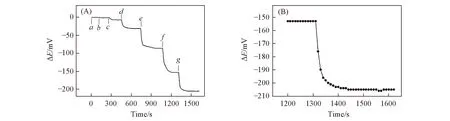
Fig.9 Dynamic curve of HS-β-CD/GE responding to various concentration of L-Cys in PBS(pH=6.0)(A) and enlarged plot of stage G for 1.0×10-4 mol/L of L-Cys(B)c(L-Cys)/( mol·L-1): a. 1.0×10-8; b. 5.0×10-8; c. 1.0×10-7; d. 5.0×10-7; e. 1.0×10-6; f. 1.0×10-5; g. 1.0×10-4.
实验还考察了HS-β-CD/GE电极对不同浓度L-Cys样品溶液的电位响应重现性, 即对1.0×10-6和1.0×10-5mol/LL-Cys样品溶液的电位响应值分别测试6次, 结果如表1所示. 通过对数据的分析与处理发现,L-Cys浓度不同时二者的标准偏差分别为±0.75和±1.05 mV, 相对标准偏差分别为0.54%和1.31%, 可见二者的相对标准偏差均比较小, 说明该电极具有良好的重现性.

Table 1 Reproducibility of HS-β-CD/GE responding to L-Cys in PBS(pH=6.0)*
* AV: average; SD: standard deviation; RSD: relative standard deviation.
2.8 HS-β-CD/GE电极的选择性
对于电位型电化学传感器来说, 选择性是评价其传感性能的重要参数, 也是判断其能否实际应用的一个重要因素[31,50]. 采用混合溶液法考察了HS-β-CD/GE电极对L-Cys与19种猪血清和猪尿液中常见共存物质混合溶液的电位响应情况. 图10为HS-β-CD/GE电极对浓度为1.0×10-6mol/LL-Cys检测的电位值达到稳定时, 分别加入浓度为1.0×10-4mol/L的L-Val,L-Trp,L-Phe,L-Leu,L-Thr,L-Ala,L-Ile,L-Gly,L-Arg,L-Pro,L-Cyn,L-Met,L-His,L-Lys, Na+, K+, Ca2+, UA和GLC等19种组分后的电位变化柱状图. 可见, 仅在加入L-Cyn时电位值升高了(22±2) mV, 而加入100倍浓度其它13种氨基酸和Na+, K+, Ca2+, 尿酸和葡萄糖时电位值几乎未发生变化, 即不干扰电极的测定.
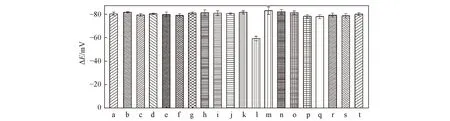
Fig.10 Effects of interfering substance on HS-β-CD/GEThe concentration of L-Cys is 1.0×10-6 mol/L, and the concentrations of other coexisting substances are 1.0×10-4 mol/L. a. L-Cys; b. L-Cys+L-Val; c. L-Cys+L-Trp; d. L-Cys+L-Phe; e. L-Cys+L-Leu; f. L-Cys+L-Thr; g. L-Cys+L-Ala; h. L-Cys+L-Ile; i. L-Cys+L-Gly; j. L-Cys+L-Arg; k. L-Cys+L-Pro; l. L-Cys+L-Cyn; m. L-Cys+L-Met; n. L-Cys+L-His; o. L-Cys+L-Lys; p. L-Cys+Na+; q. L-Cys+K+; r. L-Cys+Ca2+; s. L-Cys+UA; t. L-Cys+GLC.
2.9 回收率测定与分析应用
在最佳实验条件下, 考察了HS-β-CD/GE电极对实际样品如猪血清和猪尿液中L-Cys含量的检测效果, 与HPLC分析结果基本一致(见表2). 同时, 采用该电极对猪血清和猪尿液样品进行加标测定, 即在预处理的猪血清和猪尿液样品中分别加入不同浓度的L-Cys, 测得的回收率结果如表2所示, 可见, 猪血清样品的回收率为96.6%~104.7%, 猪尿液样品的回收率为95.0%~101.6%, 2种样品测试的相对标准偏差(RSD)分别小于5%和6%, 表明该自组装膜电化学传感器具有良好的准确性, 且实用性强, 可用于实际样品中L-Cys含量的测定分析, 在生命科学、 生物医学和畜禽健康养殖等领域具有重要的应用价值.
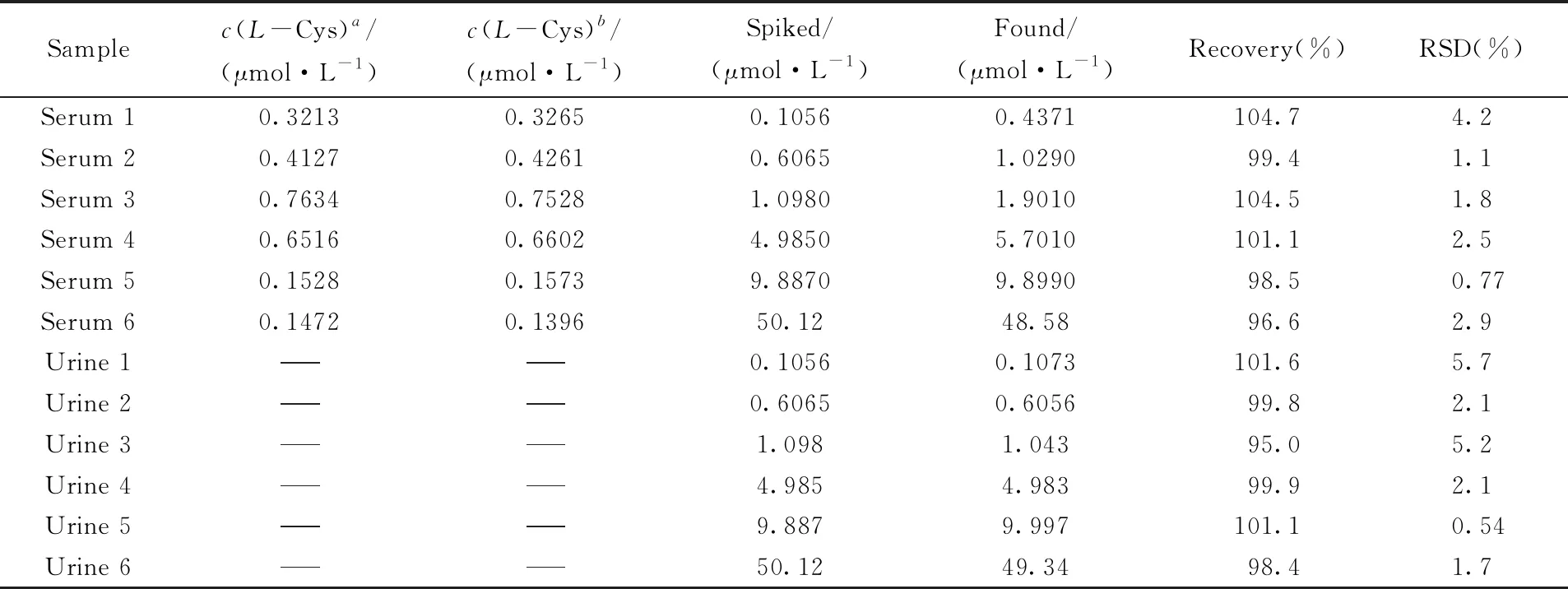
Table 2 Recovery of the proposed HS-β-CD/GE for determination of L-Cys in pig serum and urine samples
a. Initial value was measured with HPLC(n=3), which was provided by Institute of Subtropical Agriculture, Chinese Academy of Sciences;b. the data was measured with the proposed HS-β-CD/GE electrode(n=3). --- represents not detected.
3 结 论
制备了单(6-巯基-6-去氧)-β-环糊精自组装膜修饰金电极, 其对L-半胱氨酸(L-Cys)显示出优异的超分子识别作用, 膜电位响应斜率为(-65.29±1.0) mV/pc, 检测下限为60 nmol/L. 将该电极应用于实际猪血清及猪尿液样品中L-Cys的检测, 显示出良好的准确性和可行性. 该电位型电化学传感器制作简单、 响应快速灵敏, 有望成为一种在线检测L-Cys的新手段.
- 高等学校化学学报的其它文章
- 可双光子激发的聚集诱导发光光敏剂及其生物医学应用
- 金属有机框架材料的结构、 动力学行为和主客体相互作用的固体核磁共振研究
- 大面积多元化表面等离激元金纳米粒子结构的制备
- Determination of Triazine Herbicides from Fruit Juice Samples Using Effervescence Assisted Microextraction Method Based on Acidic Ionic Liquid Packed Syringe
- 聚谷氨酸接枝聚乙二醇@碳酸钙遮蔽体系用于提高聚乙烯亚胺基因转染效率
- 基于萘普生-芳基金属配合物的抗癌及抗炎性能

