亚甲基四氢叶酸还原酶基因MTHFR多态性与唐氏综合征风险的相关性研究
柴鸥 侯志敏
唐氏综合征(Down’s syndrome,DS)又称21三体综合征,是临床上常见的因常染色体数目异常引起的遗传性疾病,在新生儿中发病率为1/800~1/600[1]。由于多余的染色体物质打破了遗传平衡,导致胎儿在母体内发育异常,新生儿表现为智力障碍,精神体格发育迟缓,并伴有严重多组织、器官发育畸形[1,2]。目前针对DS尚无有效的治疗方法,因此有效的产前诊断和预防措施可减少此类患儿的出生。羊膜穿刺是临床上进行DS诊断的主要方法,但由于该种方法会有1%~2%流产的风险[3],因而基于羊膜穿刺的产前诊断很难普及[4]。因而,孕中期检测母体血清标志物进行DS无创性筛查,判断发生DS的风险,已成为目前产前筛查的主要方法。James等[5]研究发现调节叶酸代谢的亚甲基四氢叶酸还原酶(MTHFR)可能在染色体分离过程中起重要作用,再采用病例对照的方法研究发现MTHFR 基因多态性是DS发生的风险因素之一。近年来随着基因测序技术的发展,越来越多的研究发现母亲叶酸代谢相关基因多态性可能是DS发生的风险因素,但由于种族和地域的差异,这类研究结果还存在争议[6]。本研究以中国人群为研究对象,选取叶酸代谢相关基因MTHFR的两个位点,通过分析其在孕中期母亲中的分布频率及DS风险性,探索叶酸代谢基因的多态性与DS风险之间的关联性。
1 资料与方法
1.1 一般资料 选取2017年1月至2018年6月于我院妇产科门诊建卡的孕中期(14~21周)女性150例,年龄20~38岁,行DS产前筛查,以DS风险率1/270为切割值,≥1/270者为高危组(50例),<1/270者为低危组(100例)受试者排除其他妊娠期疾病。研究经医院伦理委员会批准,产妇签署知情同意书。
1.2 方法
1.2.1 血清标志物检测:采集受试孕妇清晨空腹外周血5 ml,标本3 000 r/min 离心10 min后分离血清,采用化学发光法检测血清标志物甲胎蛋白(alpha-fetoprotein,AFP),人类绒毛膜促性腺激素β亚单位(β-human chorionicgonadotrophin,β-hCG)和游离雌三醇(unconjugated oestriol,uE3),采用软件综合分析DS风险率(切割值:1/270)。
1.2.2 DNA抽提:同时收集EDTA抗凝血3~5 ml用于MTHFR C677T和A1298C基因多态性的检测,采用QIAamp DNA Blood kit试剂盒提取基因组DNA。
1.2.3 PCR扩增及测序:MTHFR基因扩增采用 Applied BiosystemsTM的VeritiTMPCR 热循环仪(Thermo Fisher scientific公司)。引物设计及扩增条件同文献[6],具体如下:根据GenBank中MTHFR基因序列号(ID:4524)采用NCBI的Blast在线引物设计软件合成引物:MTHFER C677T 上游引物:5’-ACTGTCATCCCTATTGGCAGGTTA-3’,下游引物: 5’-TCGGTGCATGCCTTCACAA-3’;A1298C 上游引物:5’-GGTCCCCACTTCCAGCATC-3’,下游引物:5’-GCAAGTC-CCCCAAGGAGG-3’。反应总体系20 μl,其中PCR mix(日本东洋纺)10 μl,上、下游引物各1 μl(10 μmol/L),DNA模板1 μl,双蒸水7 μl。PCR产物直接送Invitrogen生物公司进行单向或双相测序。
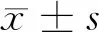
2 结果
2.1 DS血清标志物情况 高危组AFP和uE3含量低于低危组(P<0.001);高危组β-HCG含量显著高于低危组,差异有统计学意义(P<0.01)。见表1。


组别AFP(μg/L)β-hCG(μg/L)uE3(mg/ml)高危组(n=50)20.53±2.9960.13±5.970.78±0.16低危组(n=100)29.99±3.19*10.88±3.37*1.54±0.15*
注:与高危组比较,*P<0.05
2.2 H-W 遗传平衡检测 高危组与低危组的MTHFR C677T、A1298C 基因型分布符合Hardy-Weinberg 遗传平衡定律(P>0.05),研究对象具有群体代表性。见表2。

表2 MTHFR基因Hardy-Weinberg 遗传平衡检测
2.3 MTHFR C677T和A1298C基因频率及等位基因频率比较 根据唐氏筛查初步结果,将受检查者分为高危组和低危组,其中高危组50例,低危组100例,C677T基因型比较无统计学意义(P>0.05),而A1298C对应的基因型比较差异有统计学意义(P<0.05)。见表3。

表3 MTHFR C677T和A1298C基因型及等位基因平率的比较
2.4 MTHFR单体型分析 虽然上述两个位点的基因型未见明显差异,但进一步采用SHEsis在线软件构建单体型,高危组和低危组中携带的单体型存在差异,携带“C-A”单体型者其DS风险明显降低[P<0.001,OR=0.325,95%CI (0.196~0.537)],但携带“C-C”或“T-C”单体型者其明显增加DS的风险,统计量分别为[P<0.001,OR=4.177,95%CI (2.157~8.091)]和[P<0.001,OR=4.207,95%CI (2.065~8.570)]是一个重要的危险因素。见表4。

表4 MTHFR个SNP位点单体型与DS风险分析
3 讨论
唐氏综合征又名先天愚型,是最早确认的常染色体病,因其最初发现人体第21号染色体发生三体异常而致病,故又称21-三体综合征,是全球重点预防的重大缺陷疾病。
经羊膜穿刺检测胎儿细胞核型是诊断唐氏综合征的金标准,但羊膜穿刺具有诸多的不良反应,包括宫内感染和流产,导致该技术无法广泛开展。目前主要采用孕中期产妇血清学标志物进行筛查,利用风险分析软件计算患DS的风险率。本研究对高危组和低危组血清标志物比较发现,高危组AFP和uE3均低于低危组,而β-HCG显著高于低危组,这可能是DS胎儿发育迟缓,包括肾上腺、肝脏、胎盘等组织器官发育不全,合成AFP及uE3的能力降低,因而在母亲体内这两种标志物的浓度异常降低[8]。然而,上述筛查方法的预测率仅达65%~80%[9],无法满足人民日益增长的健康要求。因此,需要更加精确和完善的预测方法。
研究表明,造成DS的主要原因是细胞的低21号染色体无法完全分离,进一步有学者开始提出叶酸代谢异常是导致染色体分离异常的主要原因[2,10],因为叶酸代谢产生的亚甲基四氢叶酸可参与DNA的合成和DNA甲基化以维持DNA的稳定性。而叶酸代谢有多个酶的参与,其中亚甲基四氢叶酸通过MTHFR与甲硫氨酸合成酶是其重要的关键酶。叶酸代谢酶基因的突变会导致这些关键酶催化质量下降,DNA甲基化程度减低,DNA稳定性降低而致染色体分离不全[6]。MTHFR C677T的突变已被大家广泛认识的突变位点,此种突变可使基因产物丙氨酸替换为缬氨酸,该突变体不耐热而导致酶活性降低,进而造成DNA低甲基化,参与三体的发生过程[11]。本研究结果显示,高危组女性发生MTHFR、发生C677T C-T的突变发生率更高,说明该位点突变可能与DS发生有关,与以往研究结果[12]一致。然而,有文献报道称日本人[13]、意大利人[14]MTHFR C677T 的多态性与DS 综合症不存在相关性,梁蓉等[15]报道北京地区MTHFR C667T 的多态性不是DS 母亲的风险因素。
另一个MTHFR重要的突变位点为A1298C,其突变发生胞嘧啶取代腺嘌呤,导致编码多肽由原来的谷氨酸变成丙氨酸,影响酶活性。对印度女性的调查中发现A1298C位点突变不是DS发生的风险[12],但在埃及女性中其又是一种重要的危险因素[16]。本研究结果显示,高危组中“C”等位基因频率显著高于低危组,提示改位点突变与DS风险之间的关系。
由于地区和种族的不同,MTHFR C677T和A1298C两个位点对DS风险的影响不尽相同,但是确认的是MTHFR C677T和A1298C多态性是可以直接影响DNA低甲基化[17]。因此,我们采用单体型构建的方法同时分析这两个位点与DS风险的关系,发现“C-C”和“C-T”两种单体型可DS发生风险增加4.177倍和4.207倍;而“C-A”单体型携带者发生DS的风险为0.325,故认为该单体型为一个重要的保护因素。
综上所述,由于地域和人种的差别,MTHFR C677T和A1298C位点基因及基因型是本研究对象的风险因素,但DS的发生又不仅仅同MTHFR基因多态性有关,可能还存在其他潜在因素影响DS发生的风险,如孕妇年龄[18]、环境因素[19]、营养因素[20]等相关。因此,在评估DS风险时,应从遗传和环境等多方面全面考虑,从而得出更确切的结论。

