多重荧光定量PCR在动物检测中的应用
张若楠 于 雷 王 钊 韩荣伟 于忠娜*
(①青岛农业大学海都学院 山东 莱阳 265200 ②青岛农业大学食品科学与工程学院 山东 青岛)
多重荧光定量PCR技术可以利用一次反应,同时检测、鉴别出多种病原体,在临床混合感染的诊断上具有独特优势和很高的实用价值。与实时荧光定量PCR技术结合,可以定量拷贝数、省去PCR后处理,减少交叉污染,整个检测过程耗时短、准确、高效、特异。因此本文对多重荧光定量PCR技术的分类及各种方法的优缺点做了简要概述,并对近年来多重荧光定量PCR在动物中的应用概况及其研究进展,如在动物性食品卫生中的应用、细菌病诊断、病毒病诊断、饲料中动物源性成分的检测、抗性基因检测及肿瘤早期诊断等有关方面进行概述,旨在为该技术的进一步开发应用提供理论参考。多重PCR技术与实时荧光定量PCR的结合,拓宽了其应用范围,但也存在一定的局限性,如荧光基因种类有限、需要专门的仪器设备、外源DNA的干扰、引物探针含量及其特异性都可能影响检测结果。因此,处理好这些问题是多重实时荧光定量PCR技术更好应用于动物研究中的关键。
自从20世纪80年代聚合酶链式反应(Polymerase chain reaction,PCR)[1]问世以来,该技术就成为体外快速扩增特定基因或DNA序列最常用的方法。但由于该方法是应用PCR来对样品中的模板量进行定量,也就是说需要通过凝胶电泳分离来检测扩增产物进行分析,由于平台效应的存在,定量的准确性受到影响,且操作过程中还容易交叉污染,产生假阳性。1996年美国Applied Biosystems推出了实时荧光定量PCR技术,它不仅实现了PCR从定性到定量的飞跃,而且与常规PCR相比,RQ-PCR具有简便易行、灵敏度高、特异性强等优点,而且也有效解决了常规PCR假阳性率高等缺点[2]。在诊断中,有时不能获得足够的待测样品体积而限制了PCR技术的应用,而多重荧光定量PCR的出现很好地解决了这一难题,该技术能在同一PCR反应体系中实现多种病原体或基因的同步检测,大大缩短了检测时间,节省了试剂的用量。
1 多重荧光定量PCR技术的概述
多重荧光定量PCR技术是在荧光定量PCR 的基础上,利用两对或两对以上的引物以及相应的探针,实现在同一个反应体系中完成多个目标序列同时进行检测[3]。而实时荧光定量PCR技术根据使用的荧光物质的不同可分为荧光染料和荧光探针两类。荧光染料是一种扩增序列非特异性的检测方法,而荧光探针是在常规PCR基础上运用荧光共振能量转移(fluorescence resonance energy transfer,FRET)技术,加入荧光标记探针,巧妙地把核酸扩增、杂交、光谱分析和实时检测技术结合在一起,在PCR指数扩增期间通过连续监测荧光信号的强弱来即时测定特异性产物的量,并据此推断目的基因的初始量[4]。
2 多重荧光定量PCR技术的分类
多重荧光定量PCR分为荧光染料和荧光探针。染料法是荧光定量PCR最早使用的方法。染料能结合在DNA双链上,在激发光源的照射下发出荧光信号。随着反应的进行PCR产物不断增加,因此染料结合在PCR产物上的量也会越多。而探针式则是通过与靶序列特异性杂交的探针来指示扩增产物的增加。
2.1 荧光探针
探针式荧光检测技术是利用荧光共振能量转移原理来设计探针,在探针5′端标记一个荧光报告基团(Reporter,R),3′端标记一个淬灭基团(Quencher,Q),二者可以构成能量传递。当R基团与Q基团距离较近时,Q基团可以吸收或抑制R基团发出的荧光;当R基团和Q基团相距较远时,Q基团则不能再吸收或抑制R 基团所发出的荧光,这时R基团的荧光释放出来,荧光信号增强。常用的有TaqMan探针、分子信标、双杂交探针、复合探针等[5]。
2.2 荧光染料
荧光染料也称为DNA结合染色。该方法是利用染料无法与单链DNA结合而可以与双链DNA结合并在结合时发出荧光信号,而在游离状态下则不发出荧光信号[6]的原理实现的。因此可以用荧光信号强度来代表双链DNA的数量,进而来计算PCR的扩增产物量。目前主要使用的是SYBR Green Ⅰ。但由于SYBR Green Ⅰ对PCR有一定的抑制性,且存在荧光强度低,稳定性差的问题,近年来出现了一些性能改进的染料,如SYBR Green ER、Power SYBR、Eva Green TM等[7]。
3 不同荧光探针及SYBR Green Ⅰ荧光染料的优缺点
不同荧光探针及SYBR Green Ⅰ荧光染料的分类情况、优缺点对比及在实践中的应用概况如表1所示[8-13]。
4 多重荧光PCR技术在动物检测中的应用
4.1 在动物性食品卫生中的应用
(1)肉、蛋、奶等畜产品常常会被各种病原菌污染而引起相应的食源性疾病,因此快速检测食品中的病原菌是及时有效预防疾病传播及食物中毒的重要前提,多重荧光PCR技术即可同时检测多种病原细菌。(2)邵彪[14]等建立了同时检测食品中多种细菌的多重荧光PCR快速检测方法,该方法与单重体系具有很好的一致性。索原杰[15]建立了一套可以适用于不同实际情况中的牛奶致病菌检测的多重实时荧光PCR检测方法,并探究了乳酸菌对致病菌的生长抑制作用,该研究能为牛奶中主要致病菌的检测提供一定的技术指导。
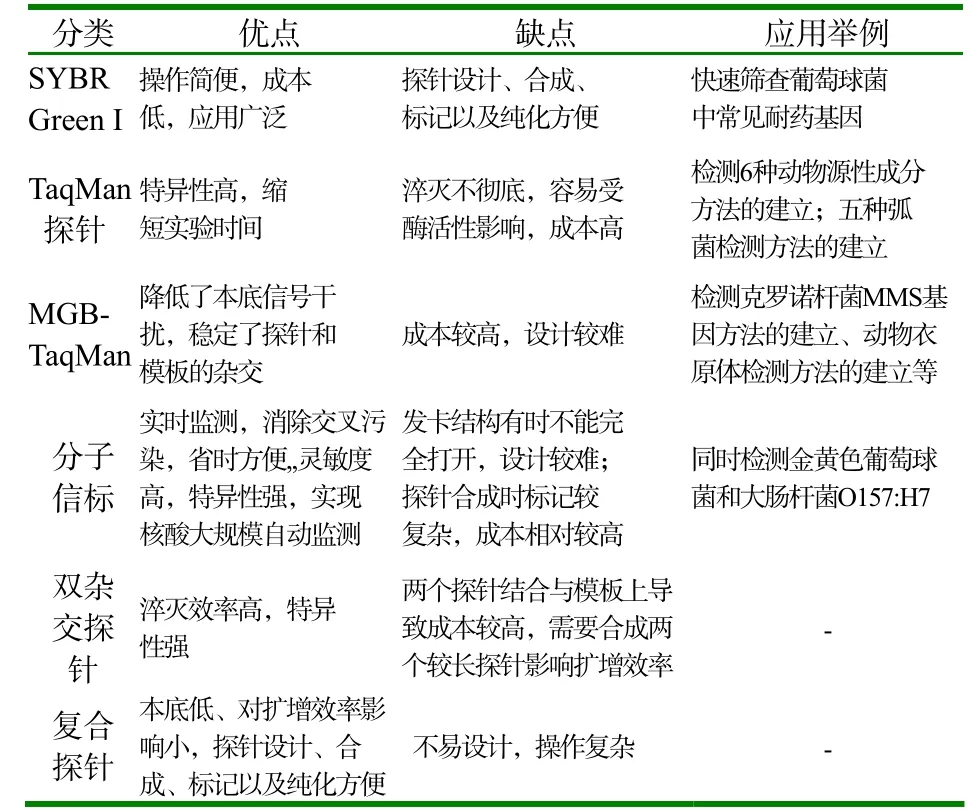
表1 不同荧光探针及SYBR Green Ⅰ荧光染料的优缺点及其应用
4.2 在微生物检测中的应用
4.2.1 细菌病诊断 (1)肠产毒素大肠埃希菌是一种引起人类和动物细菌性痢疾和细菌性食物中毒的常见肠道致病菌,严重危害人类健康和牲畜的安全,常见病原菌的检验方法存在着检测周期长、工作量大、 所需试剂多,而且假阴性率高,灵敏度低,或假阳性率高,特异性差等缺点。夏灿[16]等根据GenBank公布的大肠杆菌O157:H7 的菌体抗原基因rfbE、鞭毛抗原基因fliC、溶血素基因hlyA、紧密黏附素基因eaeA和志贺样毒素基因stx1和stx2的序列,建立了2个能够快速、特异性地检测大肠杆菌O157:H7及其4个主要毒力基因的三重荧光定量PC R方法。该试验建立的三重荧光定量PCR 方法的敏感性、重复性及特异性均较好,可作为同时快速检测肠出血性大肠杆菌O157:H7及其毒力基因的方法。这种快速、简便、准确、特异的检测方法是一种理想的检测多种致病菌检测方法,应用前景广阔。(2)邢进[17]建立了一种同时检测实验动物中的流感嗜血杆菌、溶血嗜血杆菌和多杀巴斯德杆菌多重实时荧光定量PCR(qPCR)检测方法。分别根据三种病原菌的Hpd基因和KMT1基因设计特异性引物和Taqman探针,经特异性、敏感性和重复性验证,建立多重qPCR检测方法,并对822份实验动物呼吸道样本进行检测应用。结果所建立的多重qPCR方法与其他29种病原菌间无交叉反应,对三种病原菌的检测限可达到10个拷贝/ul。(3)随着海产品和鱼类产业养殖规模的迅速扩大和集约化程度的不断提高,各类水产病害接踵而至,已成为制约海产品产业可持续发展的重要瓶颈。刘智超[18]建立了养殖大菱鲆中4种致病菌多重PCR和荧光定量PCR检测方法。多重PCR可在一次PCR反应中完成4种病菌的定性检测,而荧光定量PCR可对相应致病菌进行定量检测,定性与定量相结合,又相互验证,对大菱鲆这4种常见致病菌检测能达到准确快速定量的目的,这将为大菱鲆疾病的防控和健康养殖提供强有力的技术支撑。(4)李涛[19]等人建立的海产品中霍乱弧菌、副溶血性弧菌和单增李斯特菌三重荧光定量PCR检测试剂盒同样适合于海产品等产品中三种致病菌的快速筛检。除此之外,多重荧光定量PCR还可用来检测水产动物源细菌磺胺类耐药基因。
4.2.2 病毒病诊断 (1)王蓉蓉[20]等人根据GenBank中猪链球菌2型三种毒力因子CP2SJ、MRP、EF基因序列,建立了一种基于Taqman探针法的三重荧光定量PCR,可同时检测上述三种毒力基因。该方法灵敏度高,CP2SJ、MRP、EF的最低检测限分别为90、40、60拷贝数/μl的质粒;特异性强,与其他病原菌无交叉反应;重复性好,变异系数均小于3%。整个检测扩增在60 min内完成。饶品彬[21]成功建立了六种猪病毒Eva Green多重实时荧光PCR方法,可以对这六种猪病毒进行快速准确地检测和鉴定。刘高鹏[22]分别建立了针对该5种腹泻病毒的普通多重PCR和EvaGreen多重实时荧光定量PCR方法并应用于临床样品检测。所建立的多重实时荧光定量PCR方法可较好地用于临床样品5种腹泻病毒检测。(2)犬细小病毒(CPV)是一种存在于家养犬并在世界范围内流行的重要病原体,其主要抗原类型为CPV-2及其变体CPV-2A、2B和2C,Yaru Sun[23]等人建立了一种多重TaqMan实时PCR方法,用于检测和鉴别四种抗原类型。他们分别设计了两组引物和探针,用这些引物和探针来进行多重TaqMan实时PCR检测。通过两个独立的实时PCR,有效区分CPV-2、2A、2B和2C,且无交叉反应性。PCR与DNA测序有100%的一致性,提供了同时检测的灵敏检测方法和鉴别CPV病毒的四种抗原类型,并将该方法用于CPVS病毒的定量检测基因组。(3)宋爽[24]等以牛羊常发病为研究对象,建立了PPRV、BTV、CPV单重、多重PCR方法和单重、多重荧光定量PCR方法,能够准确的对这几种牛羊常见病进行快速的检测,具有较强的应用价值。
4.3 饲料中动物源性成分的检测
(1)刘艳艳[25]等人为了快速鉴别饲料中的狐狸、水貂、貉子和狗源性成分,根据线粒体16S rDNA种间保守序列,设计合成针对狐狸、水貂、貉子和狗的特异性引物和探针,通过对荧光PCR反应体系和反应条件的优化筛选,建立了多重实时荧光PCR方法,在同一PCR反应体系中可以同时完成4种动物源性成分检测。该方法特异性强,灵敏度高,狐狸、水貂、貉子和狗的DNA检出限为0.01ng。结果表明,该方法可以有效地鉴别出饲料中狐狸、水貂、貉子和狗源性成分,同时适用于相关动物产品中。(2)付理文[26]等人建立了一种可同时检测猪、牛、羊、鸡、鸭、鹅6种动物源性成分的六重实时荧光定量PCR方法。应用此方法分别对18种不同源性动物DNA和200份不同来源样品进行猪、牛、羊、鸡、鸭、鹅源性成分检测。结果表明,所建立的六重实时荧光PCR方法灵敏度高,对六种动物的最低核酸检测量分别为0.049ng、0.048ng、0.085ng、0.13ng、0.162ng、0.074ng(50μl体系);特异性强,对狗、兔、鼠、驴、马、骆驼等其他12种动物无特异性扩增;200份样品的检测结果表明六重qPCR检测方法敏感,同一反应体系下实现一次对6种动物快速定量检测,耗时短、效率高、适用性广。(3)高灵敏度和定量的无公害猪肉鉴别工具的研制重要的是认证加工肉制品,特别是在清真产品的情况下。定量方法是区分故意掺假与交叉污染的关键。Joana S. Amaral[27]等人开发和验证了一种新的特异性和高灵敏度的EVRAGEN实时性PCR系统。肉制品中猪肉定量PCR系统的研究基于标准化的分析DCT方法被成功地开发和优化,并应用于猪肉的检测和定量,其值分别为0.0001%和0.01%(W/W)。该方法具有真实性、精确性和重复性。在检测样品中,40%的清真产品检测出猪肉,与标签不一致。(4)Mi-ju Kim[28]等人开发了一种基于TaqMan®探针的快速双重RTPCR检测法。该方法能在40min内的同时检测鸡肉和鸽肉的线粒体细胞色素b基因,二者的绝对检出限均为0.1pG。从生的或热处理的肉中提取的DNA,可以检测到0.01%只鸽子DNA。,以及相反的鸡的DNA。该方法可作为一种鉴别生肉和熟肉制品中鸽肉和鸡肉的快速、灵敏、特异的检测方法。
4.4 抗性基因检测
抗生素的广泛使用导致了耐药性微生物的增多,对抗性基因的快速检测能有效控制疾病的发展,及时调整治疗方案。黄国秋[29]等人根据Gen Bank中细菌磺胺类耐药基因Sul1、Sul2和Sul3的保守序列设计3对特异性引物及相应Taq Man探针,以重组质粒标准品为模板对反应条件进行优化,建立一种可同时检测上述3种耐药基因的三重荧光定量PCR方法,并对该方法进行敏感性、特异性、重复性及临床菌株检测试验。结果表明:该方法定量范围为1×10~1~1×10~8拷贝/反应时,其标准曲线呈良好的线性关系;该方法灵敏度高(3个基因的最低质粒检测限均可达到10拷贝/反应)、特异性强(与其他病原菌及病毒无交叉反应)、重复性好(变异系数均小于2%);对临床菌株的检测结果与药敏试验结果的符合率达94.2%,且整个检测过程可在2h内完成。所建立的可同时检测Sul1、Sul2和Sul3基因的三重荧光定量PCR方法可用于临床检测细菌的磺胺类耐药基因。
4.5 肿瘤早期诊断
DNA甲基化作为表观遗传学的一种,在维持胚胎发育、基因印记、正常细胞功能以及人类疾病发生中起着重要作用。检测DNA甲基化对疾病特别是肿瘤进行早期诊断、预后分析、合理用药等有重要的临床意义。因此快速准确、操作简便、成本低廉的分析技术是甲基化研究及临床检测所必需的。陈晓云[30]提出了改良多重实时荧光定量PCR技术,并利用该技术检测64份大肠癌标本及其正常对照的CpG岛甲基化表型。
5 多重荧光PCR技术的前景和不足
多重PCR技术与实时荧光定量PCR的结合,拓宽了其应用范围,打破了传统的科学术语,实时荧光定量PCR通常用于描述应用多个寡核苷酸探针区分多个扩增子的情况,但由于可获得的荧光基因种类有限,导致这种方法的应用是有一定难度的,另外实时荧光定量PCR需要专门的仪器设备,检测所用的高特异的探针合成成本高,同时,外源DNA的干扰、引物探针含量及其特异性都可能影响检测结果。因此,如何简化样品处理过程、使检测标准化、降低检测的成本是多重实时荧光定量PCR技术在应用于动物方面中需要改进的方面。

