海洋链霉菌Streptomyces sp.MCCC 1A09830抗菌成分的分离与鉴定
,*
(1.南京农业大学食品科技学院,江苏南京 210095; 2.自然资源部第三海洋研究所海洋生物遗传资源重点实验室,福建厦门 361005)
天然产物是小分子药物的重要来源,为人类提供了大量的合成药物、半合成药物,以及合成药物所需的骨架[1]。微生物来源的天然产物是天然产物研究的重要组成部分。据统计,在已有的500000种天然产物中,大约有70000种天然产物是由微生物提供的[2]。微生物来源的天然产物因为具有多样的生物活性,而在医药行业得到了广泛的应用,如抗生素、免疫抑制剂、抗糖尿病药、抗癌药物等[3]。
海洋占地球面积的70%,拥有着地球97%的水资源、87%的生物资源,因此成为了新型微生物的重要来源,为人类提供了丰富的天然产物[4-6],也为药物开发提供了珍贵的先导化合物资源[7]。海洋微生物及其代谢产物已经成为新世纪药物开发的热点[8-9],其中海洋链霉菌因其突出的生物合成潜力,而在天然产物研究中占据着重要的地位,其代谢产物具有多样的生物活性,如抗菌、抗氧化、抗病毒、抑制血管生成等[10]。研究者们已经从海洋链霉菌中得到了许多新型的天然产物。Khalil等[11]从海洋链霉菌Streptomycessp. CMBM0150的发酵产物中得到了aranciamycins I和aranciamycins J。Chen等[12]从海洋链霉菌Streptomycessp. OUCMDZ-3434的产物中分离得到Wailupemycin类化合物。王聪等[13]从广西北部湾的泥样中分离到了Streptomycessp. MDCW-126,并从其发酵产物中分离得到形孢菌素,这是一种具有抑菌活性的吲哚咔唑类化合物。
张玉便等[14]从取自南大西洋深海沉积物的3个样品中分离得到了132株放线菌,对部分菌株进行了活性检测与系统发育分析,没有进行产物分离与结构鉴定。本文为了充实、丰富文章内容,进一步研究发酵菌种,以其16S rRNA基因序列为基础,构建进化树,确定菌种与已知菌种的亲缘关系,并对Streptomycessp. MCCC 1A09830发酵产物中的活性产物进行分离、鉴定。
1 材料与方法
1.1 材料和仪器
Streptomycessp. MCCC 1A06678(H2)、Streptomycessp. MCCC 1A09830(H3)、Streptomycessp. MCCC 1A09831(H4)、Streptomycessp. MCCC 1A09832(H5)、Streptomycessp. MCCC 1A09835(H7)、Streptomycessp. MCCC 1A09966(H9)和Streptomycessp. MCCC 1A10313(H10) 中国海洋微生物菌种保藏管理中心;以上菌株的16S rRNA基因序列 由中国海洋微生物菌种保藏管理中心提供;Bacillussubtilis,EscherichiacoliATCC 25933、StaphylococcusaureusRN4220和SaccharoraycescerevisiaeCRY1-2(用作活性检测的酵母菌) 由本课题组保藏;酵母粉、氯化钠、胰蛋白胨、酵母提取物 生工生物工程(上海)股份有限公司;琼脂粉 北京索莱宝科技有限公司;HP-20树脂 上海捷瑞生物工程有限公司;柱层析硅胶(200~300目) 青岛海洋化工厂分厂;Luria-Bertani(LB)固体培养基(g/L):胰蛋白胨10.0、酵母粉5.0、氯化钠10.0、琼脂粉15.0、pH7.0;Luria-Bertani(LB)液体培养基(g/L):胰蛋白胨10.0、酵母粉5.0、氯化钠10.0、pH7.0;MS 液体培养基(g/L):D-甘露醇20.0、大豆粉20.0、pH7.0;MS 固体培养基(g/L):D-甘露醇20.0、大豆粉20.0、琼脂粉20.0、pH7.0;Yeast Extract Peptone Dextrose(YPD)酵母培养基(g/L):酵母提取物10.0、蛋白胨20.0、葡萄糖20.0、琼脂粉20.0、pH7.0。
CT15RT高速冷冻离心机 上海天美科学仪器有限公司;IMS-70全自动雪花制冰机 常熟市雪科电器有限公司;SW-CJ-1FD超净工作台 苏州苏洁净化设备有限公司;CTO-10ASVP岛津高效液相色谱仪 岛津中国;WUF-400型-80 ℃超低温冰箱 DAHAN科学仪器有限公司;立式压力蒸汽灭菌锅 上海申安医疗器械厂;37 ℃培养箱、37 ℃烘箱 余姚市金宏仪器厂;EYEL型旋转蒸发仪 上海爱朗仪器有限公司。
1.2 实验方法
1.2.1 进化树构建方法 将海洋菌株的16S rDNA序列上传到NCBI网站进行比对,用MEGA 5.0的Clustal W Mutiple alignment对结果中同源性高的序列和海洋菌序列进行多序列比对,将两端的空位删除,保存;保存的文件用MEGA打开,从phylogeny中选择Neighbor-jionig Tree构建发育进化树,进一步确定Streptomycessp. MCCC 1A09830与已知菌种的亲缘关系。
1.2.2 抗菌活性物质粗物的制备
1.2.2.1 孢子的培养 选择MS固体培养基用于孢子的培养;使用灭菌棉棒蘸取孢子液并在MS平板上划线,30 ℃培养2~4 d;挑取生长良好的单个孢子,划满整个MS平板,30 ℃培养7 d左右。
1.2.2.2 孢子的收集 对生长状态良好的孢子进行收集,使用无菌棉签蘸取灭菌水,将平板上的孢子收集到50 mL的离心管中;使用塞有脱脂棉的无菌枪头将离心管中的孢子过滤到新的50 mL离心管中,去除孢子中的培养基成分,配平后离心,4000 r/min,10 min,弃上清;加入灭菌水冲洗,配平后离心,4000 r/min,10 min,弃上清;取20%甘油清洗孢子,配平后离心,4000 r/min,10 min,弃上清;加入20%甘油,配平后离心,4000 r/min,10 min,弃上清;取10%甘油重悬,将孢子分装在小管中,在-80 ℃冰箱中保存。
1.2.2.3 发酵与粗物提取 使用不同的培养基对Streptomycessp. MCCC 1A09830进行发酵,发现MS培养基的发酵产物的活性最高,因此选择MS培养基作为种子培养基和发酵培养基(含树脂)。将树脂浸泡在100%乙醇中,过夜后去掉乙醇,清水洗净,备用;配制MS液体培养基,称取适量大豆粉,加入定量的去离子水,煮沸2 h后用双层纱布过滤至三角瓶中,加入定量的D-甘露醇并搅拌均匀,定容后分装在250 mL三角瓶中,每个三角瓶加入50 mL的培养基,使用纱布、报纸封口,高压灭菌处理;吸取50 μL孢子液,按照1‰的比例接种于250 mL三角瓶的MS培养基中,在28 ℃,225 r/min的摇床条件下培养3~5 d;取4 mL无污染、颜色正常的种子液转接于400 mL含有大孔吸附树脂(5%)的MS液体培养基中,在28 ℃,225 r/min的摇床条件下培养10 d。发酵结束后,将MS发酵培养基从摇床中取出,清水冲洗发酵液数次至只剩下树脂,树脂通过漏斗过滤后,在室温条件下晾干;将树脂浸泡于100%甲醇中,4 h,浸泡过的甲醇转入旋转蒸发仪进行浓缩,温度设置为35 ℃;重复浸泡树脂,浓缩至干,溶于甲醇的物质即为抗菌活性物质粗物。
1.2.2.4 粗物检测 取10 μL抗菌活性物质粗物,经甲醇稀释至300 μL,使用新注射器吸取粗物稀释液,通过有机相针头过滤器过滤后,置于液相小瓶中待测;对样品进行高效液相色谱(High Performance Liquid Chromatography,HPLC)分析,进样量是10 μL;HPLC分析条件:Diamonsil C18(5 μm,4.6 mm×250 mm)色谱柱,检测器为SPD-M20A,柱温箱温度为25 ℃,流速为1 mL/min,检测波长为254 nm;分析方法为甲醇/ddH2O(20∶80~100∶0,线性梯度洗脱,50 min)。
1.2.3 抗菌活性物质的分离纯化 本实验的分离纯化方法是硅胶柱层析,采用干法上样,干法装柱。
1.2.3.1 拌样 拌样是硅胶柱层析的重要步骤,硅胶用量与拌样的均匀程度是影响分离效果的重要因素[19]。具体步骤如下:称取定量的硅胶粉(200~300 目,样品质量∶硅胶量=1∶3)置于陶瓷研钵;一边将抗菌活性物质粗物缓慢的加入硅胶,一边用药匙研磨硅胶,待硅胶中的甲醇挥发、硅胶颗粒分散均匀后,停止拌样,所得硅胶粉为上柱样品。
1.2.3.2 装柱 装柱是影响样品分离效果的关键一步,要将硅胶压实,以免样品条带发生弥散,导致纯化效果不理想。具体步骤如下:清洗层析柱,甲醇润洗、晾干;取定量硅胶(200~300 目,质量是样品量的20倍)缓慢装入层析柱,使用真空泵抽真空并轻敲柱身,使硅胶填充均匀,当硅胶界面不在下降时,停止抽真空,保持硅胶界面水平;将样品缓慢加入玻璃柱中,保证样品均匀分布在柱子表面,并在样品表面覆盖一层硅胶,以防加洗脱液时样品飞溅;在样品上方塞入小团棉花,沿柱子边缘加入洗脱液,使用三角瓶收集组分。
1.2.3.3 洗脱 配制洗脱液,采用梯度洗脱,梯度洗脱是指选择不同极性的溶剂、按照不同的比例对样品进行洗脱。本次实验选取二氯甲烷、甲醇作为洗脱剂。梯度顺序如下,100%的二氯甲烷,二氯甲烷∶甲醇=100∶1,二氯甲烷∶甲醇=100∶2,二氯甲烷∶甲醇=100∶3,二氯甲烷∶甲醇=100∶5,二氯甲烷∶甲醇=100∶10。对洗脱的溶液进行分组、蒸干,加入甲醇溶解。浓缩合并有活性的样品后,进行第二次硅胶柱层析分离。第二次分离选择石油醚、二氯甲烷、甲醇作为洗脱剂,梯度顺序如下,石油醚∶二氯甲烷=5∶1,100%的二氯甲烷,二氯甲烷∶甲醇=100∶1,二氯甲烷∶甲醇=100∶1.5,二氯甲烷∶甲醇=100∶2,二氯甲烷∶甲醇=100∶3,二氯甲烷∶甲醇=100∶4,二氯甲烷∶甲醇=100∶5,二氯甲烷∶甲醇=100∶8,二氯甲烷∶甲醇=100∶10。浓缩样品并使用HPLC对活性样品进行分析,检验纯化效果。
1.2.4 抗菌活性物质的制备 样品预处理:使用新注射器吸取1.2.3.3中制备的活性样品,通过有机相针头过滤器进行过滤,置于液相小瓶中,备用。使用HPLC对活性样品进行制备,色谱条件为:YMC-Pack ODS-A(5 μm,10.0 mm×250 mm)色谱柱,柱温箱温度25 ℃,流速为4 mL/min。制备方法为:甲醇/ddH2O(70∶30~80∶20,线性梯度洗脱,30 min)。将制备好的样品进行旋蒸至干燥,使用色谱级甲醇溶解样品,低温保存。对制备好的样品进行HPLC检测,检验制备效果,检测条件:Diamonsil C18(5 μm,4.6 mm×250 mm)色谱柱,柱温箱温度为25 ℃,流速为1 mL/min,检测波长为254 nm。分析方法为:甲醇/ddH2O(20∶80~100∶0,线性梯度洗脱,50 min)。
1.2.5 抑菌活性检测与结构鉴定
1.2.5.1 抑菌活性检测 将过夜培养的枯草芽孢杆菌、大肠杆菌ATCC 25933、金黄色葡萄球菌、酿酒酵母CRY1-2,按照体积分数1%的比例分别加入未凝固的固体LB培养基中,摇匀并倒入平板,使培养基凝固;使用打孔器将普通滤纸制成直径为0.5 cm的纸片,滤纸片经烘干后备用;取20 μL抗菌活性物质的稀释液,浓度为20 mg/mL,滴加在滤纸片上,使其充分吸收产物;待滤纸片晾干后,分别放置在平板表面,轻轻按压,使纸片完全接触培养基,前三种指示菌37 ℃、酿酒酵母CRY1-2 30 ℃,培养过夜,观察抑菌圈大小,抑菌圈的大小表示抑菌活性的强弱。
1.2.5.2 结构鉴定 化合物1经色谱级甲醇溶解,通过有机相针头过滤器过滤后,转移至质谱样品瓶中,备用;对样品进行HR-ESI-MS检测以获得活性物质的分子量,推定化合物分子式。样品经氘代甲醇溶解后,转移至核磁管中,进行核磁共振分析,得到核磁共振数据,将核磁数据与文献数据比较,确定了化合物的结构。
1.3 数据处理
实验均有三个平行,核磁数据、进化树数据、液相数据的处理均采用word2007,核磁图谱采用MestReNova处理。
2 结果与分析
2.1 进化发育树的构建
使用MEGA 7.0,以海洋菌的16S rRNA基因序列和比对结果序列为基础,构建进化树,研究Streptomycessp. MCCC 1A09830与其它菌种的亲缘关系(如图1)。建树方法采用邻接法(neighbor-joining,NJ),通过bootstrap检测置信度。Streptomycessp. MCCC 1A09830与Streptomycessp. NEAE-126同源,相似度为99.85%,且自展值达到了98%。

图1 基于16S rRNA基因序列构建的7株海洋链霉菌的系统发育树Fig.1 Phylogenetic tree of 7 marine Streptomyces based on the 16S rRNA gene sequences
2.2 抗菌活性物质粗物的制备
由图2可知,活性物质粗物的样品主要有8种组分,保留时间集中在30~46 min之间,其中强度最高的有3个峰,保留时间分别在31.5、34.5、43.0 min左右。根据液相结果,需要对发酵粗提物进行下一步的硅胶柱层析分离。

图2 抗菌活性物质粗物的液相色谱分析Fig.2 HPLC analysis of fermentation broth ofStreptomyces sp. MCCC 1A09830
2.3 抗菌活性物质的分离纯化
发酵粗提物经过硅胶柱层析得到了初步分离产物,活性产物主要在2个梯度(甲醇∶二氯甲烷=100∶3,甲醇∶二氯甲烷=100∶5)的洗脱收集液中。由图3可知,该样品主要有4个组分,活性产物的保留时间在40.0 min左右。与图2比较,图3样品中的组分种类相对较少,说明经过硅胶层析处理后,样品的杂质更少,这更有利于产物的纯化与活性组分的判断。整体上,发酵粗提物在硅胶柱上的纯化效果很好,达到了纯化的目的。

图3 硅胶层析后活性组分的液相色谱分析Fig.3 HPLC analysis of purified active compoundafter silica gel column chromatography
2.4 抗菌活性物质的制备
通过产物粗提、硅胶柱层析分离、高效液相色谱的分析与制备等多个步骤,实现了对Streptomycessp. MCCC 1A09830发酵产物的纯化,最终得到化合物1。由图4可知,该化合物的保留时间为39.5 min,化合物呈单峰,峰形较为对称,这说明样品中的杂质很少,HPLC的纯化效果满足检测要求,这为下一步的核磁共振检测打下了基础。本次发酵试验,发酵液的总体积为14.4 L,共获得15 mg化合物。

图4 化合物1的液相色谱分析Fig.4 HPLC analysis of compound 1
2.5 活性检测与结构鉴定
2.5.1 活性检测 本研究对化合物1进行了抑菌试验,选取了枯草芽孢杆菌、大肠杆菌ATCC 25922、金黄色葡萄球菌和酿酒酵母CRY1-2作为指示菌。试验结果如图5,化合物1针对枯草芽孢杆菌、大肠杆菌ATCC25933、金黄色葡萄球菌和酿酒酵母的抑菌圈直径分别为:2.4、1.5、1.2、1.2 cm。试验结果表明,化合物1对枯草芽孢杆菌的抑菌效果最高,且对细菌、酵母菌都有抑制活性,且抑制能力是不同的。张玉便等[14]对Streptomycessp. MCCC 1A09830的粗提物进行了活性检测,发现该菌株的发酵粗提物对枯草芽孢杆菌具有活性,抑菌圈大小为9 mm。

图5 化合物1的抑菌实验Fig.5 Antibacterial assay of compound 1
2.5.2 结构鉴定 在本研究中,化合物1的结构是通过高分辨质谱数据、一维核磁共振(1D NMR)及二维核磁共振(2D NMR)确定的,质谱采用的是HR-ESI-MS。高分辨质谱数据显示m/z 512.2983为[M+Na]+,m/z与理论计算值 m/z 512.2983相同(图6),说明该化合物分子式为 C28H43NO6,计算分子量为489.3085。通过scifinder 按分子式搜索,得知该化合物与Borrelidin类化合物[15]结构相似度较高。用 COSY、HSQC、HMBC和C13NMR 归属了碳化学位移及氢化学位移(表1),通过碳化学位移比较发现该化合物可能是Borrelidin A或B(δC13=145.6,δC-14=129.0)。再通过氢化学位移比较,发现该化合物与Borrelidin A数据吻合(δH-13=6.9,d;δC-14=6.6,dd)。其它位置化学位移均与Borrelidin A数据吻合,所以该化合物结构被确定为Borrelidin A(图7)。Borrelidin A的氢谱和碳谱如图8~图9。Borrelidin A,又称为疏螺旋体素、勃利霉素,是一种带有腈官能团的大环内酯。外观是一种白色无定形粉末。关于Borrelidin A的合成基因簇已有报道[16-18]。

表1 化合物1碳谱与氢谱化学位移Table 1 Chemical shift of carbon spectrum and hydrogen spectrum of compound 1

图6 化合物1的高分辨质谱Fig.6 High resolution mass spectrometry of the compound 1
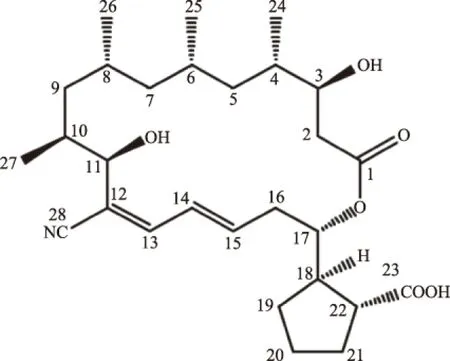
图7 化合物1的结构Fig.7 Chemical structure of compound 1

图8 化合物1的1H NMR谱(500 MHz)Fig.8 1H NMR(500 MHz)spectrum of compound 1

图9 化合物1的13C NMR谱(125 MHz)Fig.9 13C NMR(125 MHz)spectrum of compound 1
3 结论与讨论
本研究通过对7株海洋链霉菌的16S rRNA基因序列的分析,探究了海洋链霉菌Streptomycessp. MCCC 1A09830与其它菌种的亲缘关系;同时以海洋链霉菌Streptomycessp. MCCC 1A09830为研究对象,通过液体发酵的方式富集菌株的次级代谢产物,经过产物粗提、硅胶柱层析、高效液相色谱等技术手段,对Streptomycessp. MCCC 1A09830的活性组分进行了分离纯化,最终得到化合物1。进化分析结果显示Streptomycessp. MCCC 1A09830与Streptomycessp. NEAE-126同源,且自展值达到了98%;化合物1的活性检测结果显示其对枯草芽孢杆菌、大肠杆菌ATCC25933、金黄色葡萄球菌、酿酒酵母CRY1-2具有抑制作用。通过高分辨质谱、核磁共振等手段获得ESI-MS质谱、1H NMR氢谱图、13C NMR碳谱图,确定了产物的结构。最终确认化合物1与文献报道[19]中的Borrelidin为同一种化合物。疏螺旋体素最早发现于娄彻氏链霉菌(Streptomycete.rochei)的发酵产物中[19-20],具有抗细菌、真菌[21-22]、病毒[23]、疟原虫[24-27]的生物活性。疏螺旋体素不仅可以抑制新血管的形成和人脐静脉内皮细胞增殖,还能诱导毛细血管细管细胞凋亡[28-29],这对癌症的治疗有一定的帮助[30]。除了Borrelidins A,研究者们进一步还发现了Borrelidins B[16]、Borrelidins C-I等一系列疏螺旋体素类似物[31],这些研究表明疏螺旋体素具有很高的研究价值。
此外,本研究还发现发酵粗提物中还含有其它的微量组分,需要进一步的分离、纯化和结构鉴定。这项工作不仅丰富了Borrelidin的生产菌库,为海洋菌株活性产物的分离提供了支持,也表明了海洋微生物在天然活性小分子的方向具有一定的发展潜力,可以为天然药物开发提供宝贵的研究资源。

