两株红树林来源链霉菌的鉴定和抗菌活性研究
叶景静,卢覃培,贾舒涵,郑红芸,孙承航,黄大林
(1.桂林医学院基础医学院微生物实验室,广西 桂林 541004;2.中国医学科学院&北京协和医学院医药生物技术研究所微生物化学研究室,北京 100050)
由于耐药菌的日益泛滥,以肠球菌(Enterococcus)、金黄色葡萄球菌(Staphylococcusaureus)、克雷伯菌属(Klebsiellaspp.)、不动杆菌属(Acinetobacterspp.)、铜绿假单胞菌(Pseudomonasaeruginosa)和产超广谱β-内酰胺酶的肠杆菌科细菌(ESBL-producingEnterobacteriaceae)为主要的 ESKAPE[1]耐药问题现今给临床上的治疗已经带来了极大困难,所以新型抗生素的研发已经是一个急需解决的问题。
放线菌是我们从自然界里发现抗生素的重要来源之一[2]。人们从微生物次级代谢产物中发现了一大批具有不同化学结构和生物活性的抗生素,如氯霉素、红霉素、利福霉素、庆大霉素和雷帕霉素等。据报道,现有抗生素约三分之二是由放线菌产生的[3]。然而,从普通环境中获得新的微生物天然活性产物越来越困难[4]。因此,人们开始将研究的目光投向特殊环境微生物,如海洋、洞穴、热泉和沙漠等,以期得到新的微生物种类,进而获得新的抗生素或其他生物活性物质[5]。
红树林因为受到潮水周期性的浸没,具有水分高、耐缺氧、盐分高等特点,是生长在热带、亚热带海岸潮间带的特殊生态系统,是一种独特的植物群落,该地区有着十分丰富新颖的放线菌微生物资源[6]。本次实验地点选择了污染少、物种丰富和研究相对较少的广西茅尾海红树林[7],发现2株活性较强的链霉菌,从生物学特征,抗菌活性和系统发育树进行研究,这为发现新抗生素提供了微生物资源。
1 材料与方法
1.1 材料
1.1.1样品 2株从广西茅尾海红树林根际土壤获得的链霉菌。
1.1.2培养基 ①分离用培养基:M1(高氏一号培养基):海晶盐3 g,可溶性淀粉20 g,MgSO40.5 g,K2HPO40.5 g,KNO31 g,琼脂18 g,蒸馏水1 L,pH 7.2;M2(高氏二号培养基):胰蛋白胨3 g,葡萄糖10 g,氯化钠5 g,蛋白胨5 g,复合维生素1 mL,琼脂18~20 g,蒸馏水1 L,pH 7.2;M3(海藻糖-脯氨酸培养基):脯氨酸1 g,海藻糖5 g,(NH4)2SO41 g,NaCl 1 g,K2HPO41 g,MgSO4·7H2O 1 g,CaCl22 g,复合维生素1 mL,琼脂18~20 g,pH 7.2;M4(棉子糖-组氨酸培养基):L-组氨酸1 g,棉子糖5 g,KNO31 g,K2HPO41 g,NaCl 1 g,CaCl22 g,MgSO4·7H2O 1 g,琼脂20 g,pH 7.3~7.4。② 纯化选用培养基:改良ISP2 固体培养基。③发酵选用培养基:改良 ISP2 液体培养基。④检定菌株选用培养基:Mueller-Hinton( M-H) 培养基(英国OXOID)。
1.1.3抑制剂 重铬酸钾 25.0 mg·L-1,放线菌酮 50.0 mg·L-1,萘啶酮酸 25.0 mg·L-1。
1.1.4检定菌株 鲍曼不动杆菌敏感株ATCC19606和耐药株2799、金黄色葡萄球菌敏感株ATCC29213和耐药株ATCC43300、大肠埃希菌敏感株ATCC25922和耐药株2800、铜绿假单胞菌敏感株ATCC27853和耐药株2774、粪肠球菌敏感株ATCC33186和耐药株VRE310681、肺炎克雷伯菌敏感株ATCC10031和耐药株ATCC700603,都由中国医学科学院医药生物技术研究所提供。
1.1.5试剂与仪器 硅胶板silica gel 60 F254 20180204,德国Merck公司;Chelex100 树脂 20180911,美国 BioRad公司;重铬酸钾 20180328,Sigma 公司;引物( 27F,1492R) 20180312、萘啶酮酸20171123、GelGreen染料20170927、DNA Marker 20180907,上海生工生物工程股份有限公司;放线菌酮20171207、2×Easy Taq SuperMix 20180907,北京全式金公司;乙酸乙酯(分析纯) 20180726,二氯甲烷(分析纯) 20190408,甲醇(分析纯) 20180906,丙酮(分析纯) 20180918,北京化工厂。
微量移液器 Eppendorf,Germany,旋转蒸发仪OSB-2100,日本EYELA公司;电泳仪,北京市六一仪器厂;离心浓缩机 Christ,德国;凝胶成像仪,美国 Bio-Rad 公司;快速多任务 PCR 仪,Gene Company;WZT-1M 细菌比浊仪,上海劲佳;旋转式摇床,全恒温培养箱、上海智城分析仪器制造公司;双人单面洁净工作台,新加坡ESCO;半自动TLC点板仪、全自动展开缸 瑞士CAMAG 公司;台式压力蒸汽灭菌器,上海申安医疗器械厂。
1.2 方法
1.2.1处理样品 参考吴越等[8]的样品处理方法,将采集的新鲜潮湿样品置于无菌平皿中,在通风的空间室,温条件下自然风干,并罩上纱布以防蚊虫掉落,等样品完全干燥后,再用无菌研钵将土壤研磨成细沙状。分别称取5 g不同土壤,倒于45 mL装有无菌玻璃珠和无菌水的小锥形瓶中溶解,放在180 r·min-1、28 ℃ 的摇床里振荡3 h;再吸取1 mL 土壤悬浊液于9 mL无菌水中,依次稀释浓度为 10、1、0.1 g·L-1,接着分别吸取0.2 mL稀释液涂布于4种不同分离培养基上,将分离平板用宽度适中的封口膜封口,避免培养过程中水分的蒸发和杂菌的污染。放入 28 ℃培养箱中,恒温培养 4 周以上,随时进行形态观察。
1.2.2菌种的分离、纯化与保藏 培养2 ~8周,定期观察平皿生长情况,若有霉菌生长,及时将燃烧酒精棉花覆盖在上,如有菌落生长,首先进行初步排重,再挑取单菌落在培养基上,进行四区划线纯化,以获取纯培养物。将新鲜菌体,尽量多的,存入20%无菌脱脂牛奶中,真空冷冻干燥后,保藏于4 ℃冰箱。同时,存入20%甘油管,保存于-80 ℃冰箱。
1.2.316S rRNA基因序列的扩增及测序和构建系统进化树分析 ① 参考Chelex-100 法提取放线菌基因组DNA[9]。选用扩增引物为通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′) 和1492R ( 5′-GGTTACCTTGTTACGACTT-3′)。PCR反应体系为50 μL如下:2 × Easy Taq Supermix 25 μL,27F(10 μmol·L-1) 1.5 μL,模板 2 μL,1492R( 10 μmol·L-1) 1.5 μL,无菌水20 μL。PCR反应条件如下:预变性95 ℃ 5 min;变性 94 ℃ 1 min,退火55 ℃ 1 min,延 伸72 ℃ 2 min,35 个循环;后延伸 72 ℃ 10 min。② PCR产物采用 1% 琼脂糖凝胶 电压110 V、时间30 min 电泳检测,凝胶成像仪观察电泳结果;获得的阳性结果交由生工生物工程(上海) 股份有限公司测序。③ 将获得的序列利用EzT-axon-e 工具[10]和 BLAST 程序进行相似性比对。从中选择相似性较高且是有效描述的典型菌株的 16S rRNA 基因序列作为参比对象,采用Clustal W进行多序列比对[11],采用MEGA 7.0 软件[12]通过邻接法( Neighbor-Joining) 进行聚类分析,和构建系统发育树[13],根据 Kimura two parameter[14]模型估计系统进化矩阵,重复取样 1 000次进行自展值( Bootstrap value) 分析,来评估系统进化树拓扑结构的稳定性。
1.2.4抗菌活性筛选
1.2.4.1样品的制备 将纯化的菌株,装于有 100 mL 液体发酵培养基的500 mL锥形瓶中,分别接种3瓶,摇床转速为180 r·min-1,温度 28 ℃ 培养1周左右。将培养好的发酵液4000 r·min-1离心 30 min,将获得上清液用等体积的乙酸乙酯分多次萃取,浓缩干燥后,用 3 mL的甲醇溶解酯相。萃取后的水相60 mL,挥发干燥,丙酮浸泡菌体静置24 h,两者都用 3 mL 1 ∶1甲醇水溶液溶解。
1.2.4.2检定菌株的制备 将检定菌株分别接种于装有10 mL MH液体培养基的 50 mL 试管中,摇床设置 37 ℃、180 r·min-1培养 12~24 h,再将菌悬液调为0.5 麦氏浓度单位按 8%~1% 浓度加入到温度降至55 ℃左右的培养基中,倒之前先摇晃混匀,每皿倒入培养基15~20 mL ,置 4 ℃冰箱备用。
1.2.4.3抗菌活性筛选 筛选方法采取纸片扩散法(K-B法),在无菌圆形滤纸片(d=6 mm)上,分3次加入共60 μL 已制备完成的3类样品(水相、酯相、菌体),挥发干燥后,贴在含有检定菌的培养皿上,将平皿放在37 ℃培养箱,12~24 h 后,测量抑菌圈的大小。
1.2.5活性物质的TLC分析
1.2.5.1TLC展开条件的选择 ①点样:将 TLC 铝箔板切成 1 cm×10 cm 长条状,距下边缘 1 cm 处点样,至铝箔板吸附达到饱和为止②分析:选择二氯甲烷:甲醇体积比分别为 49 ∶1,19 ∶1,9 ∶1 的展开剂,在展开缸中预饱和 15 min,然后垂直放入已经点样的 TLC 铝箔条。③ 测活:待TLC铝箔板上的溶剂挥发干后,在紫外灯 (254 nm) 下标记各点位置,将它们分别贴于 MRSA 检定板上,37 ℃下培养 16 h 后,观察抑菌圈的位置,并计算出 Rf值,确定活性点的位置。
1.2.5.2 TLC板制备活性物质 粗提物用少量甲醇溶解后,用 CAMAG LINOMAT5 半自动点样仪点样于硅胶 20 cm×10 cm 硅胶板 (silica gel 60 F254,Merck) 上,以二氯甲烷 ∶甲醇=9 ∶1 (V/V) 为展开剂,上行展开分离,待溶剂挥干后,在紫外灯 (254 nm) 下标出条带,并按展开方向为条带编号。将条带分别刮下,根据条带的 Rf值选择适当极性的洗脱剂将活性成份充分洗下,收集洗脱液并浓缩备用。
2 结果
2.1 抗菌活性采用标准菌株进行抗菌活性试验,结果显示菌株B353和B486对革兰阳性菌和革兰阴性菌均具有较好的活性( Tab 1),菌株B486对金黄色葡萄球菌有较好的抗菌活性,其中敏感株抑菌活性弱于耐药株,菌株B353对粪肠球菌和金黄色葡萄球菌均表现出较强抑菌活性,其中对金黄色葡萄球菌的抗菌活性较强(Fig 1)。
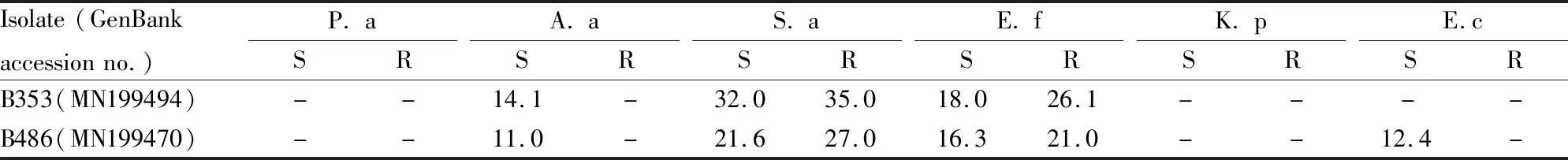
Tab 1 Results of antimicrobial activity screening of culturable strains B353 and B486(mm)
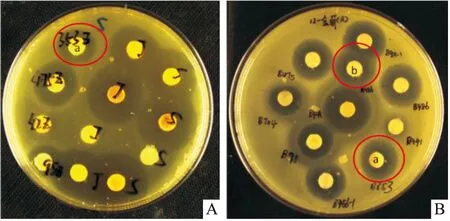
Fig 1 Partial antimicrobial activity of culturable strains B353 and B486A:Antibacterial activities of Enterococcus faecalis sensitive strain;B:Antibacterial activities of Staphylococcus aureus resistant strain;a:B353;b:B486.
2.2 菌落特征在改良的 ISP2 培养基上,菌株B353和 B486 生长状态良好,菌落紧贴于培养基表面生长,多皱褶,干燥,典型的放线菌形态。菌株B353菌落起先白色,逐渐生长转为灰白色,质地疏松,布满孢子丝,易被挑取。B486表面干燥,有褶皱,质地较密,菌落为白色,当孢子丝产生大量孢子并布满菌落表面形成颗粒状,生长周期较长,不易挑起(Fig 2)。
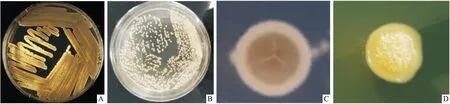
Fig 2 Colony morphology of two strains of Streptomyces under macroscopic stereomicroscope and on culture medium
2.3 基于16S rRNA构建2株放线菌的系统发育树菌株B353和菌株B486分别测通获得菌株的16S rRNA 基因序列(1 364 bp和1 375 bp),将序列提交 GenBank,登录号分别为MN199494和MN199470。登录 EzTaxon,比对结果发现菌株B353和菌株B486与StreptomycesseoulensisNRRL B-24310T的相似率都为99.93%,且菌株B353和菌株B486在 N-J 树上形成一簇再与之为一簇,菌株B353和菌株B486 初步鉴定是链霉菌属StreptomycesseoulensisNRRL B-24310T的两个变种( Fig 3) 。
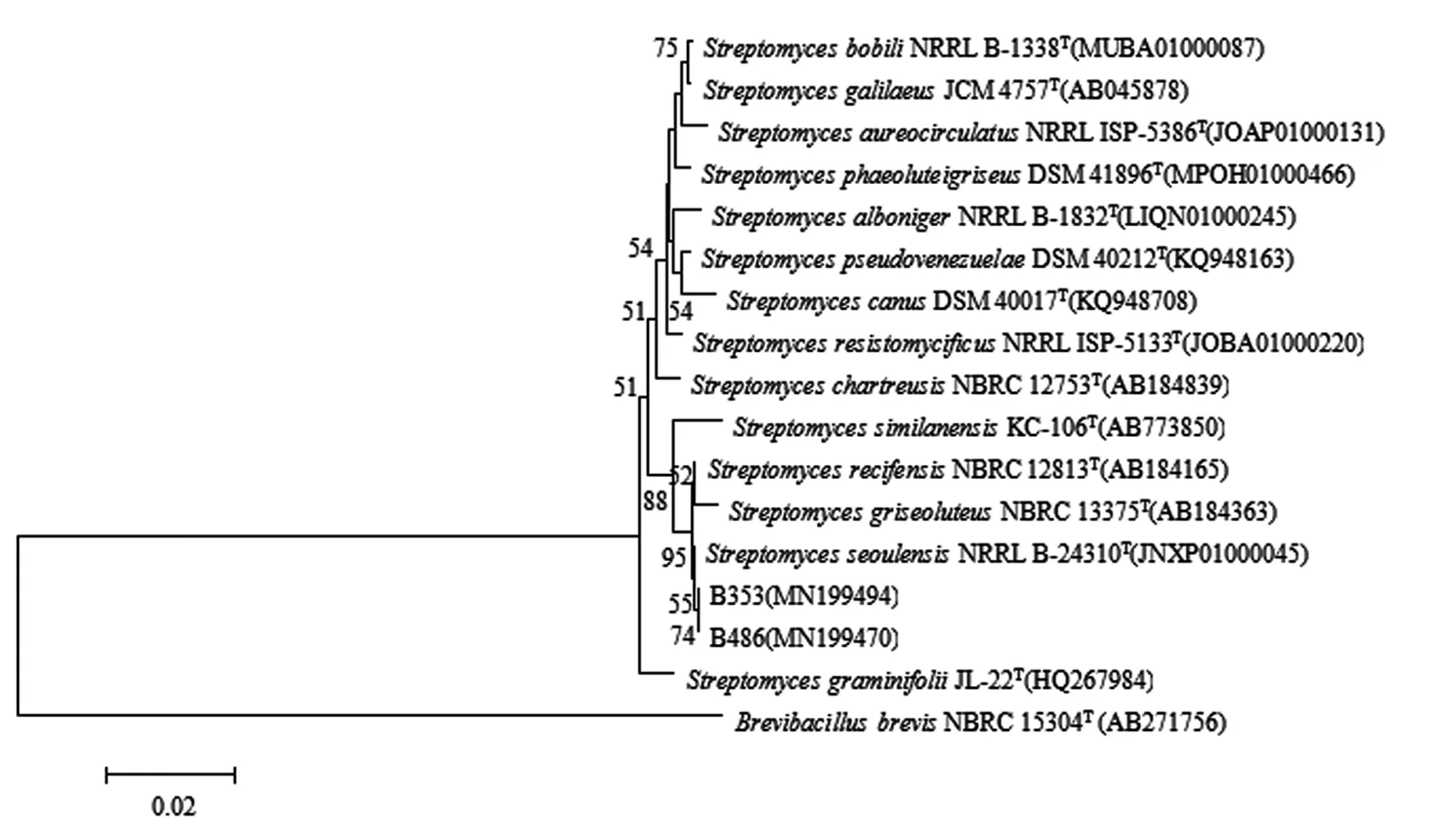
Fig 3 Neighbour-joining phylogenetic tree based on 16S rRNA sequence of B353 and B486
2.4 活性物质TLC 分析结果菌株B353发酵液粗提物在二氯甲烷 ∶甲醇=9 ∶1 的条件下有较好的展开效果,在Rf值0.8的位置显示出了抑菌活性,确定二氯甲烷 ∶甲醇=9 ∶1 为最佳展开条件,TLC 板上 9~10、10 和 10~11 号条带有抗金葡菌活性,且 10号带活性最强,而其他条带无活性。菌株 B486发酵液粗提物在二氯甲烷 ∶甲醇=9 ∶1 的条件下有较好的展开效果,在Rf值0.7的位置显示出了抑菌活性,确定二氯甲烷 ∶甲醇=9 ∶1 为最佳展开条件,TLC 板上 11、12 和 12~13号条带有抗金葡菌活性,且 12号带活性最强,而其他条带无活性( Fig 4)。菌株B353和菌株B486洗脱过滤后得到活性物质。
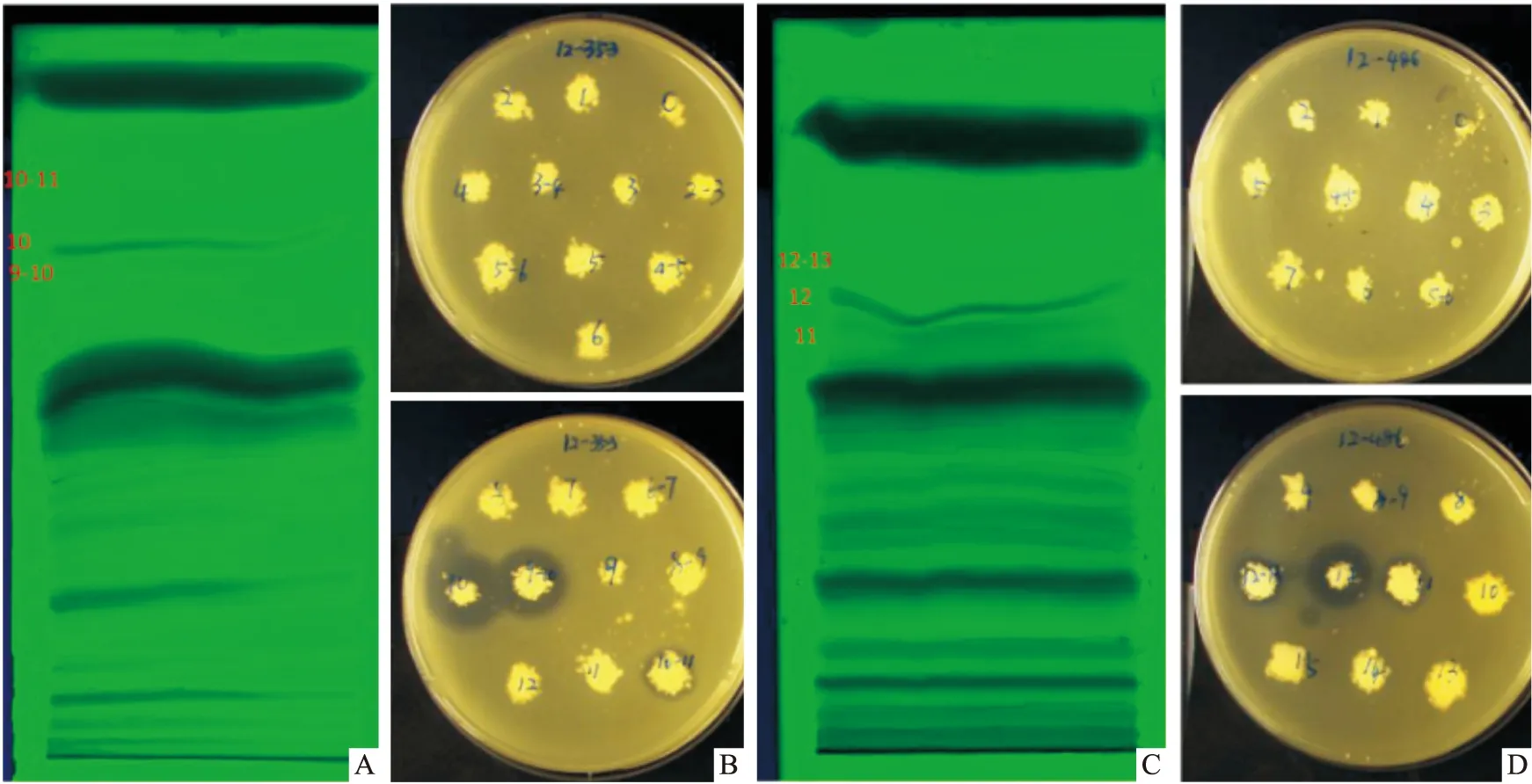
Fig 4 TLC profile of EA extract of strain B353 and strain B486 and anti-MRSA results of each bandA:TLC profile of EA extract sample of strain B353 cultural broth at UV 254 nm,band 9~10,10 and 10~11 (red);B:The anti-MRSA results of the bands from TLC,band 9~10,10 and 10~11 showed inhibition zone;C:TLC profile of EA extract sample of strain B486 cultural broth at UV 254 nm,band 11,12 and 12~13 (red);D:The anti-MRSA results of the bands from TLC,band 11,12 and 12~13 showed inhibition zone.
3 讨论
生长在红树林这种极端环境的放线菌有着不同于陆地微生物的代谢途径,因此其次级代谢产物在类型、生物活性和结构等方面都表现出与普通环境放线菌有着不同的特点[15]。据文献报道,红树林土壤中分离出的放线菌远多于植物内生分离出的放线菌[16],其中链霉菌属是红树林土壤放线菌中的优势菌属。Zhang 等[17]在 1 株链霉菌中分离得到了 2 个对大肠杆菌有着较好的抗菌活性的新化合物。许琳雅等[18]从StreptomycesNo.H74-18 菌株中发现新化合物 antimycin A18 及 A19和分离得到抗霉素类化合物。这些研究表明,红树林中的链霉菌有着巨大的开发潜能和研究价值。
广西茅尾海红树林是我国特有的岩滩红树林,有着丰富和新颖的土壤微生物。本实验研究广西茅尾海来源的两株链霉菌的生物特征和抗菌活性。两株菌B353和B486在测序比对后,通过构建进化树和表征的显微镜观察,初步鉴定为链霉菌属的两个变种。菌株B353和菌株B486对革兰阳性菌和革兰阴性菌均具有较好的活性,说明两株菌的抗菌能力较为广谱。其中菌株B353的抗菌活性明显强于菌株B486,两份活性物质对金黄色葡萄球菌的抗菌能力也是各有区别。这为我们筛选新型抗生素打下了一定的物质基础。
大量的研究结果表明,红树林有着丰富的链霉菌其生物活性代谢物质依然有着研究潜力。本次实验结果表明广西红树林中放线菌资源丰富,其中链霉菌属对金黄色葡萄球菌良好的抗菌活性,这为活性次级代谢产物的筛选和新型抗生素的开发奠定了基础。