基于网络药理学的山豆根神经毒性机制探讨
刘 畅,俸婷婷,刘雄伟,石 慧,沈奇涛,周 英
(贵州中医药大学 1.药学院、2.药食两用资源应用与开发研究中心,贵州 贵阳 550025)
山豆根为豆科植物越南槐(SophoratonkinensisGagnep.)的干燥根及根茎,味苦,性寒有毒,具有清火、解毒、消肿、止痛的功效。山豆根具有抗炎、抗心律失常、抗溃疡保肝等药理作用,同时也可引起严重的毒副反应,如神经毒性、肝毒性、心血管毒性及引起胃肠道反应、过敏反应等,以神经毒性最为典型[1]。神经毒性反应的临床表现称为山豆根中毒性脑病(radixsophoraetonkinensistoxic encephalopathy)[2],其临床表现为头昏、眼花、疲乏无力、嗜睡等,严重者则大汗淋漓、视觉障碍、意识模糊,全身肌肉颤动、抽搐、惊厥、昏迷,最终中枢性呼吸衰竭而死亡。山豆根主要含黄酮、生物碱及多糖类成分,如金雀异黄素、槐酮、槐定、苦参碱、氧化苦参碱、臭豆碱、金雀花碱、N-甲基金雀花碱、槐果碱、氧化槐果碱、槐氨、槐醇等[3]。苦参碱、氧化苦参碱为主要的生物碱成分,既是药效物质基础,也是毒性物质基础[1],而金雀花碱含量太低难以引起毒性反应[4]。
山豆根中生物碱是引起毒性反应的物质基础,超剂量服用是中毒的主要原因,据报道用量3~5 g未发生中毒事件,6~9 g发生中毒反应的报道为4.7%,12~15 g发生中毒反应的报道为17.6%[3]。研究表明,过量服用山豆根后,苦参碱、氧化苦参碱等生物碱成分可抑制体内乙酰胆碱酯酶(acetylcholin esterase,AChE)活性,诱发恶心、呕吐、头晕、出汗、吞咽困难、构音障碍,以及腹泻、肌肉痉挛、全身抽搐等乙酰胆碱样临床症状[1]。山豆根能够导致神经中毒,但山豆根中有效成分的毒性作用分子机制,其有效成分占比与其所发挥的活性是否成比例,目前尚不清楚。
中药具有多成分、多靶点、多通路的特点,药物分子作用于单一靶点或信号通路的研究难以揭示其科学内涵。网络药理学从相互关联的角度研究问题,从整体水平上研究药物的作用机制,为中药复杂作用规律提供新的思路[5]。从系统、整体的角度将药物和疾病关联起来,从多个角度将药物成分靶点网络与生物靶点网络相结合,更加系统全面地研究药物的作用机制。因此,本研究应用网络药理学的思路构建山豆根“活性成分-靶点-通路”的相互作用网络关系,探讨山豆根神经毒性潜在作用的分子机制。
1 方法
1.1 山豆根成分收集与筛选以“山豆根”为关键词在传统中药系统药理学数据库和分析平台TCMSP(http://tcmspw.comltcmsp.php)中查找山豆根所含活性成分。在PubChem数据库中下载其活性成分Smiles化学式。利用相对分子质量(MW)≤500,口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-like,DL)≥0.18 筛选山豆根的活性成分。OB 值是评价药物能否发挥药效的重要指标,DL 值代表成分与已知药物的相似性,OB 值越高通常表示药物的生物活性分子的DL值越好,对确定中药成分是否对机体产生活性具有重要参考价值。CTD 数据库(http://ctdbase.org/)提供多种毒理学信息,将TCMSP 数据库中筛选出的化合物输入CTD 数据库中进行毒性查询,得到山豆根中有毒的化合物成分。
1.2 作用靶点的筛选
1.2.1山豆根活性成分作用靶标预测 Swiss Target Prediction(http://www.swiss target prediction.ch/) 能够精确预测生物活性分子靶点的服务器,根据化学成分的2D和3D结构,基于Daylight FP2 的分子指纹方法,并采用Tanimoto系数定义的相似度度量方法进行预测。利用PubChem(https://pubchem.Ncbi.nlm.nih.gov/) 数据库,将所有的化合物转化为标准的Canonical SMILES 格式,将Canonical SMILES格式文件导入Swiss Target Prediction平台,将其属性设置为“homo sapiens”,预测活性化合物的潜在靶点,利用UniProt 数据库将这些靶蛋白转换成对应的基因名称。
1.2.2神经相关靶点的收集 通过GeneCards(https://genecards.weizmann.ac.il/v3/),以“toxic encephalopathy”或“nerve toxicity”为关键词检索与神经毒性相关的基因,筛选并删除重复靶点基因,与山豆根作用的靶标基于进行交集比对,最终获得山豆根有毒化合物的神经毒性潜在靶点。
1.3 网络构建
1.3.1核心靶点之间的蛋白与蛋白相互作用(PPI)网络图 为了分析山豆根神经毒性靶点间的相互作用,将山豆根神经毒性潜在靶点导入String 数据库,获得靶点间相互作用关系,保存为TSV格式,把其中条目node1和node2数据导入Cytoscape 3.7.1软件,计算Degree值,将靶点大小和颜色设置用于反映节点数的大小,颜色的深浅设置用于反应结合分数的大小,从而获得最终的蛋白互作网络。
由于广义互相关算法(GCC-PHAT)[8]所需的数据量少且具有较好的抗混响能力,是目前基于到达时间差定位方法中使用较多的一种算法。信号x1和x2的广义互相关函数的计算如式(1)所示:
1.3.2“化合物-靶点”网络图 将候选化合物与山豆根神经毒性潜在靶点导入Cytoscape 3.7.1 软件,建立山豆根毒性成分-靶点网络,预测出山豆根引起神经毒性反应的化合物与靶点网络关系图。化合物节点数(degree) 表示化合物对应的预测神经毒性靶点的个数,度值较大的化合物进行重点分析,靶点的节点数(degree) 的度值越大,则这个靶点越有可能是化合物的关键作用靶点。
1.4 靶点通路注释分析GO(gene ontology)分析广泛应用于基因功能分类,主要用来描述基因的分子功能、生物学过程和细胞组分。利用DAVID工具(https://david.ncifcrf.gov/)进行对山豆根-中枢神经系统受损交集蛋白靶标基因GO生物学过程富集分析(P<0.05)。应用 KOBAS 3.0(http://kobas.cbi.pku.edu.cn/)工具对山豆根-中枢神经系统受损交集蛋白靶标基因进行KEGG通路富集分析(P<0.05),筛选山豆根神经毒性潜在靶点基因可能具有的生物学功能及参与的生物学通路。最后,将分析得到的靶点通路与山豆根成分相对应,利用Cytoscape3.7.1 软件进行网络构建,形成毒性成分-靶点-通路网络。
2 结果
2.1 山豆根活性成分的筛选利用TCMSP 数据库收集到79个山豆根主要化学成分。筛选过程中发现部分成分未能满足OB≥30%和DL≥0.18,但在山豆根中含量较高且有大量文献证明其与中枢神经系统损害有关,所以也将其纳入活性成分进行研究,筛选主要的化学成分21个。将21个主要化学成分输入比较毒物基因组学数据库(CTD)数据库,查找其毒理学作用,获取15种山豆根毒性相关信息(Tab 1)。
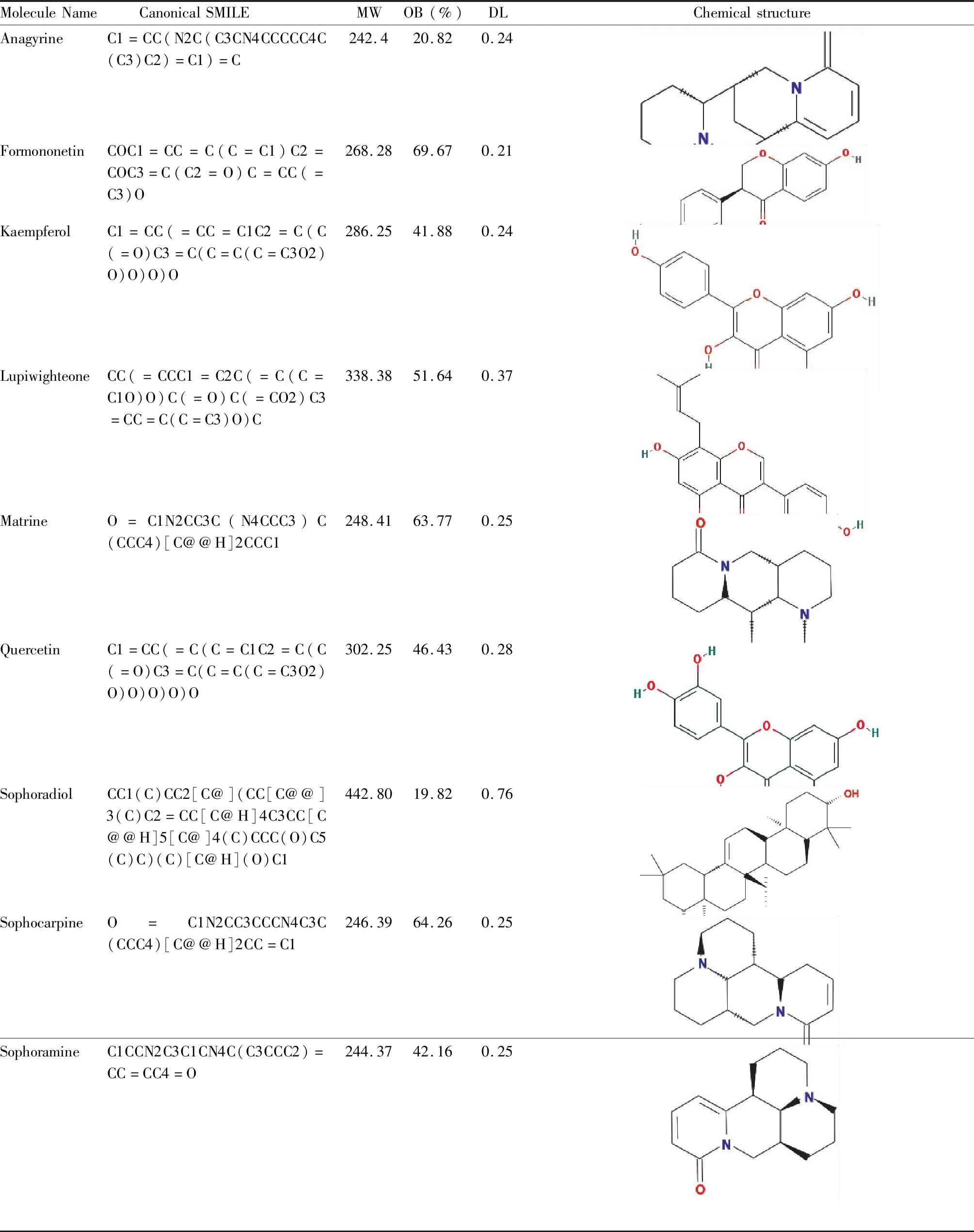
Tab 1 The toxicity compound of Sophora tonkinensis Gagnep
2.2 候选化合物神经毒性靶点预测及筛选Swiss target prediction数据库检索15种山豆根候选毒性成分对应的靶蛋白,合并以后去除重复的,整理得到14种化合物对应靶点共343个(未查询到臭豆碱对应的靶点),利用UniProt 数据库将靶蛋白转换成对应的基因名称。在GeneCards数据库检索与神经毒性相关的基因,其中以“toxic encephalopathy”为关键词检索到226个基因,以“nerve toxicity”为关键词检索到到475个基因,合并去重复靶点后共得到554个基因。将此网络与山豆根候选毒性成分对应靶点功能相映射,筛选得到89个山豆根神经毒性潜在的靶点。
2.3 靶点PPI网络作图将筛选出的山豆根神经毒性潜在靶点导入String 数据库中,获得蛋白相互作用关系,将其保存为TSV.文件,导入Cytoscape中构建蛋白互作网络。核心靶点蛋白互作(protein protein interaction,PPI)网络图(Fig 1)。其中颜色深浅反映该靶点连接其他靶点个数的多少,用连接度Degree 体现,颜色的深浅反映Degree程度。Degree 值越高,颜色越深(黄色)表明该靶点的作用越关键(Fig 1),连接度较高的核心靶点有AKT1(degree=58)、MAPK3(degree=52)、MAPK1(degree=45)、EGFR(degree=42)、SRC(degree=42)、HSP90AA1(degree=39)、APP(degree=37)、JUN(degree=37)、PTGS2(degree=37)等,靶点两两间的互作作用程度各不相同。
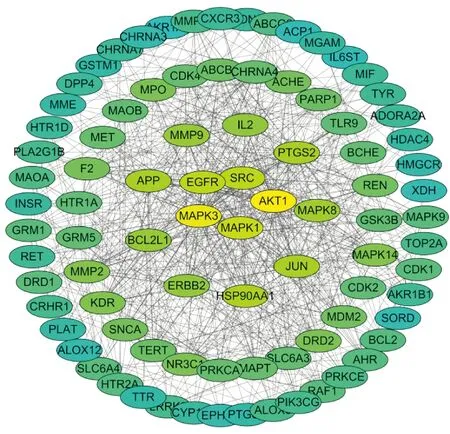
Fig 1 Nerve toxicity target interaction network of Sophora tonkinensis Gagnep
2.4 候选化合物-靶点网络分析化合物-核心靶点网络描述山豆根中候选毒性成分作用于上述89个靶点的网络(Fig 2)。每种化合物作用于多个靶点,每个靶点也可由多个化合物产生作用,但BCL2、BCL2L1、CDK4、ERBB2、GRM1、GSTM1、HDAC4、LRRK2、MAPK1、MAPK14、MAPK3、MAPK8、MAPK9、MDM2、NR3C1、REN、RET、SORD等仅有醉茄素(withaferine)作用。从蛋白靶点角度来看,较为重要的蛋白靶点ACHE、CHRNA3、CHRNA4、MAOA、PARP1、PTGS1、PTGS2、TYR、XDH等,其中PARP1与10种化合物存在互相关系,CHRNA4与8种化合物存在互相关系,ACHE与8种化合物存在互相关系。从化合物角度来看,槲皮苷(quercetin)、黄羽扇豆魏特酮(lupiwighteone)、金雀异黄酮(genistein)、苦参碱(matrine)、山柰酚(kaempferol)、醉茄素(withaferine)等,其中槲皮素(quercetin)与36个靶点存在相互关系。

Fig 2 A network of toxic compounds-nerve target of Sophora tonkinensis Gagnepred arrow node Represents active component,cyan node represents target.

Fig 3 Nerve toxicity target GO enrichment analysis in Sophora tonkinensis Gagnep
利用Kobas3.0在线软件进行KEGG 生物通路分析。KEGG结果表明,89个靶点主要富集在160个信号通路(P<0.05),主要涉及PI3K-Akt 信号通路(PI3K-Akt signaling pathway)、粘合斑(focal adhesion)、含血清素的神经突触(serotonergic synapse)、FoxO信号通路(FoxO signaling pathway)、神经活性配体与受体相关作用(neuroactive ligand-receptor interaction)、间隙连接(gap junction)、鞘脂类信号通路(sphingolipid signaling pathway)、神经营养因子信号通路(neurotrophin signaling pathway)、多巴胺能神经突触(dopaminergic synapse)、胆碱能突触(cholinergic synapse)、MAPK 信号通路(MAPK signaling pathway)、钙信号通路(calcium signaling pathway)、细胞凋亡(apoptosis)、T细胞受体信号通路(T cell receptor signaling pathway)、toll样受体信号通路(Toll-like receptor signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway)、细胞血管内皮生长因子信号通路(VEGF signaling pathway)等(Tab 2)。

Tab 2 Nerve toxicity target KEGG pathway analysis in Sophora tonkinensis Gagnep
2.6 山豆根有毒活性成分-靶点-通路网络模型将富集分析得到的20个主要通路对应山豆根有毒活性成分及靶点,构建“有毒成分-靶点-通路”网络模型。此网络黄色节点代表山豆根中的活性成分,青色节点代表潜在靶点,紫色箭头节点代表调控通路,边代表三者之间的相互作用(Fig 4)。从富集通路的多少来看,较为重要的蛋白靶点AKT1、BCL2、EGFR、GSK3B、JUN、MAPK1、MAPK14、MAPK3、MAPK8、MAPK9、PIK3CG、PRKCA、RAF1和SRC等,其中MAPK1和MAPK3均富集到17个通路,AKT1富集到15个相关的通路,PIK3CG富集到13个相关的通路,PRKCA富集到12个相关的通路。每种活性成分对应多个靶点,每个靶点连接多种成分,体现山豆根多成分、多靶点导致神经中枢受损的作用机制。同时多条通路之间是通过共有靶点连接而非独立分开的,表明各条通路之间可能协同作用在山豆根导致神经系统受损中发生作用。

Fig 4 Toxic component-target-pathway network of Sophora tonkinensis GagnepPurple arrow represents pathway;yellow node represents active component;cyan node represents potential target.
3 讨论
本研究利用网络药理学方法筛选出山豆根中主要毒性成分15种,包括臭豆碱Anagyrine、芒柄花黄素formononetin、山柰酚kaempferol、黄羽扇豆魏特酮lupiwighteone、苦参碱matrine、槲皮素quercetin、槐二醇sophoradiol、槐果碱sophocarpine、槐胺碱Sophoramine、槐定碱sophoridine、醉茄素 withaferine、金雀异
黄酮genistein、羽扇豆醇lupeol、金雀花碱cytisine、紫檀醇pterocarpol等。其中有毒活性成分作用于343个靶点,在Genecards数据库中得到神经毒性靶点554个,与山豆根的靶点映射得到山豆根神经毒性靶点89个。
由PPI网络分析筛选到9个较为重要的靶点:ACHE、CHRNA3、CHRNA4、MAOA、PARP1、PTGS1、PTGS2、TYR、XDH。其中PARP1与10种化合物存在互相关系,CHRNA4与8种化合物存在互相关系,ACHE与8种化合物存在互相关系。PARP1(poly ADP-ribose polymerase 1)是一种高度保守的细胞核内 DNA 结合蛋白,在 DNA 损伤与修复中发挥着重要的作用,DNA 损伤会诱发神经毒性,与神经系统退行性疾病的病理过程相关[6]。CHRNA4编码烟碱型乙酰胆碱受体(nicotinic acetylcholine receptors,nAChRs)亚基,该基因与癫痫症状有关[7]。乙酰胆碱酯酶(acetylcholinesterase,ACHE)能够水解乙酰胆碱,降低突触后膜对神经递质敏感性,可促进β-淀粉样蛋白(amyloid β-proteina,Aβ)纤维状沉积[8]。
为进一步分析山豆根神经靶点所涉及的信号通路和生物过程,对山豆根神经毒性靶点进行KEGG 信号通路和GO生物过程富集分析。将89个靶点基因进行通路富集分析,山豆根导致神经系统损害主要涉及炎症、细胞凋亡、神经突触、离子信号通路等,如PI3K-Akt 信号通路(PI3K-Akt signaling pathway)、含血清素的神经突触(serotonergic synapse)、神经活性配体与受体相关作用(neuroactive ligand-receptor interaction)、神经营养因子信号通路(neurotrophin signaling pathway)、多巴胺能神经突触(dopaminergic synapse)、胆碱能突触(cholinergic synapse)、MAPK 信号通路(MAPK signaling pathway)、钙信号通路(calcium signaling pathway)等。不同的信号通路及相关蛋白、基因调控参与毒性作用的发生,产生复杂的相互作用。
神经活性配体受体相互作用信号通路是质膜中枢上所有与细胞内外信号通路相关的受体和配体的集合[9]。MAPK信号通路与神经系统损伤的发生、修复存在着紧密的联系,通过酶、底物的交互级联反应与其它信号通路一起参与神经损伤的过程,活化的MAPK信号通路与阿尔茨海默病(Alzheimer′s disease,AD)的致病机制密切相关[10]。胆碱能神经元突触传递是胆碱能神经元、谷氨酸能神经元、γ-氨基丁酸等神经元之间重要的交流方式,而胆碱能神经元突触传递功能异常引起早期阿尔茨海默病认知功能下降[11]。研究表明,山豆根中毒后基底节区域的胆碱能神经及毛细血管相对比较丰富,乙酰胆碱酯酶(AChE) 抑制后,乙酰胆碱蓄积而使交感神经节兴奋,释放肾上腺素、去甲肾上腺素,导致血管痉挛,基底节水肿、渗血,乃至基底节坏死、软化[12]。当基底节受损,破坏多巴胺和乙酰胆碱的平衡,从而产生帕金森综合征样的锥体外系甚至锥体系的症状[13]。因此,山豆根中有效化合物可能通过作用与神经系统相关的靶点来干预神经系统,导致神经中毒。
大脑损伤引起兴奋性神经递质的过度释放,使突触后膜处于持续性去极化状态,造成大量Ca2+内流,引发细胞内Ca2+的生化反应,而Ca2+在神经传导、肌肉收缩和舒张、基因转录及信号传导等方面起重要作用,神经细胞内Ca2+的异常引起神经细胞的凋亡[14]。山豆根有毒活性成分-靶点-通路网络模型表明,山豆根中活性成分金雀花碱、芒柄花黄素、金雀异黄酮、山柰酚、黄羽扇豆魏特酮、苦参碱、紫檀醇、槲皮素、槐胺碱、槐定碱和醉茄素作用于靶点CHRNA7、ADORA2A、EGFR、HTR2A、DRD1、GRM5、PRKCA、ERBB2和GRM1富集于钙离子信号通路。山豆根活性成分可能引起神经元内Ca2+稳态失调及重要基因表达异常,导致神经细胞蛋白活性异常的表达、减少神经细胞信号传递,导致神经细胞坏死,最终产生神经进行性病变。
山豆根的毒性主要是由于其所含的苦参碱、氧化苦参碱、金雀花碱、槐果碱等生物碱引起,其中苦参碱、氧化苦参碱、槐果碱、氧化槐果碱、金花雀碱是引起山豆根临床中毒反应的化学成分,而苦参碱是引起山豆根毒性反应的主要化学成分[1]。小鼠腹腔注射不同浓度苦参碱,高剂量苦参碱组小鼠出现活动减少、行动迟缓、双目紧闭、震颤、轻度不安、前肢稍震颤等现象,部分小鼠出现兴奋、发抖;组织病理显示小鼠脑神经系统发生退行性变[15]。利用Swiss target prediction在线数据库预测到苦参碱的靶点为BCHE、CHRNA3、CHRNA4、CHRNA7、DPP4、DRD1、EPHX1、GRM5、HTR1D、MME、PARP1、SLC6A3、DRD2。nAChRs与多种中枢神经系统的功能有关,如随意运动、记忆力及注意力等[8]。苦参碱作为山豆根的主要有效成分,可能通过作用与nAChRs相关的靶点基因,如CHRNA3、CHRNA4、CHRNA7,使得受体释放的Ca2+异常,导致突触前释放的GABA减少。
山豆根候选毒性成分槐花二醇、紫檀醇、金雀异黄素、羽扇豆醇、紫藤皂醇A、臭豆碱的口服利用度OB值未能达到30%。研究表明,山豆根中生物碱的含量占山豆根干质量的0.93%,其中苦参碱0.52%、氧化苦参碱0.35%,而其它的微量成分如金雀花碱,含量太低难以引起毒性反应[4]。药物的口服生物利用度低将增大机体毒性的可能性,临床用药中山豆根超过药典规定剂量(6 g)时易发生急性中毒反应[3],而长时间服用山豆根会出现蓄积性中毒,由此可见,超剂量使用是山豆根中毒最根本的原因[2]。山豆根存在毒性反应且涉及多个系统,其毒性呈剂量依赖性。因此,山豆根过量服用导致中毒可能是由于某些有效化学成分口服利用度低,但过量服用造成有效成分在体内蓄积,影响与胆碱能突触、神经突触、钙离子通路等关键基因的表达。而胆碱能突触、神经突触、钙离子通路信号通路中重要因子差异表达,诱导或加速神经细胞蛋白活性表达的异常、减少神经细胞信号传递,从而导致神经中毒。
综上,本研究运用网络药理学的方法研究山豆根神经毒性的作用机制,超量服用山豆根,使口服利用度较低的化学成分,如槐花二醇、紫檀醇、金雀异黄素、羽扇豆醇、紫藤皂醇A、臭豆碱在体内蓄积,调控与胆碱能突触、神经突触、钙离子通路等关键基因的表达。而胆碱能突触、神经突触、钙离子通路信号通路中重要基因的差异表达,导致神经细胞蛋白异常表达,减少神经细胞信号传递,从而导致神经中毒。药有个性之特长,山豆根作用于神经毒性是多靶点、多通路、多功能的复杂网络结构机制,其主要通路不仅直接参与神经系统相关的通路,还通过炎症、细胞凋亡、离子信号通路等来干预和影响神经系统。但由于网络药理学研究存在局限性,基于系统生物学虽能够较为直观地系统地预测化学成分与作用靶点结合,但未能明确化学成分对关键基因表达的上调与下调关系,尚不能完全揭示药物在生物体内状况。因此以网络药理学研究方法为基点,进一步开展实验工作以阐明山豆根神经毒性的多靶点、多通路、整合调节的复杂网络结构机制。