兰州地区奶牛临床型乳房炎主要病原菌分离鉴定及耐药性分析
赵祎云,隋国燕,唐 峰,李世宏
(1. 锦州医科大学畜牧兽医学院 辽宁省畜产品质量与安全工程重点实验室,辽宁 锦州 121001 ; 2. 中国农业科学院兰州畜牧与兽药研究所 农业农村部兽用药物创制重点实验室,甘肃 兰州 730050)
奶牛乳房炎(Bovine mastitis)是由多种病原微生物感染或外伤所引发的一种综合征,是影响世界奶牛业发展的主要疾病之一[1]。奶牛乳房炎可导致产乳量下降、乳蛋白及乳糖含量下降等情况,从而影响乳品质量,部分病原菌可以将自身产生的毒素排入到牛乳中,引发食品安全问题[2]。此外,长期使用抗生素治疗奶牛乳房炎,可导致乳品中抗生素残留超标,进而引起食用者过敏、正常菌群失调或细菌耐药性[3]。在我国,奶牛乳房炎的感染率高达70%。据报道,奶牛乳房炎导致我国每年30亿元经济损失,损失金额高于发达国家[4]。
奶牛乳房炎的致病菌种类繁多是导致该病复杂性的重要原因之一[5]。目前,人们发现150多种病原微生物都可引起乳房炎。在我国,链球菌、大肠杆菌和金黄色葡萄球菌是乳房炎主要致病菌[6]。但是,不同地区的养殖场中,引起该病的病原不尽相同[7-8],这给诊疗工作带来压力。此外,长期的抗生素治疗还引起了临床致病菌耐药性的发生,进一步增加了乳房炎治疗的难度。因此,本试验通过采集2019年春、夏季兰州某规模化奶牛养殖场患有临床型乳房炎的病牛奶样,进行主要致病菌的分离鉴定以及药敏试验,为控制和治疗乳房炎提供依据。
1 材料与方法
1.1 实验动物 选取兰州地区某大型荷斯坦奶牛繁育基地患有临床型乳房炎的奶牛作为研究对象。患病乳区出现红、肿、热、痛等症状,且其他方面健康的泌乳期奶牛;乳汁中出现血液、絮状、凝块及清水等症状的泌乳期奶牛。
1.2 主要试剂 甘露醇高盐琼脂培养基(MSA)、MH琼脂培养基、BETA-SSA琼脂培养基,均购自青岛海博生物技术有限公司;伊红美蓝琼脂培养基(EMB)、麦康凯琼脂培养基(MCA)、90 mm血琼脂平板成品培养基、脑心浸出液肉汤(BHI),均购自广东环凯微生物科技有限公司;脱纤维绵羊血,购自广州鸿泉生物科技有限公司;细菌DNA提取试剂盒,购自北京索莱宝科技有限公司;16S rDNA PCR扩增试剂盒、DL-2 000 DNA Marker,均购自大连TaKaRa有限公司;K-B药敏纸片,购自英国OXOID公司。
1.3 病料采集 2019年5-8月,从兰州某规模化荷斯坦奶牛养殖场采集患有临床型乳房炎奶牛奶样共110份。采集样品前先用温水清洗整个乳区及乳头,并使用75%乙醇消毒,双手消毒后弃去前3把奶,将奶样装入无菌采样管中,每管5 mL标记编号和乳区后放入装有冰袋的采样箱中,24 h内带回实验室接种。
1.4 方法
1.4.1 主要病原菌分离纯化 轻摇混匀样品后取200 μL乳样加入2 mL BHI培养基中,37 ℃震荡培养18~24 h,用无菌接种环取富集培养物划线接种于血琼脂平板、麦康凯琼脂、BETA-SSA琼脂、高盐甘露醇琼脂培养基[9],置于37 ℃恒温培养箱中培养18~24 h,观察菌落形态,挑取典型形态菌落进行纯化培养,将已经纯化的细菌再挑单菌落至BHI培养基,于37 ℃摇床 24 h 扩大培养,并加入40%甘油于-80 ℃保存。
1.4.2 16S rDNA扩增 将冻存的菌液复苏后根据细菌DNA提取试剂盒说明书提取DNA,以提取的DNA作为PCR模板,反应体系如下:PCR Premix 12.5 μL,Forword Primer 0.25 μL、Reverse Primer 0.25 μL、16S-free H2O 11 μL、DNA模板1 μL,共25 μL。PCR扩增条件为:94 ℃预变性 5 min;95 ℃变性1 min,53 ℃退火 1 min,72 ℃延伸 1.5 min,30个循环;最终延伸温度72 ℃ 5 min。反应结束后使用1%琼脂糖凝胶进行检测,目的片段为550 bp,将PCR产物送至西安擎科生物有限公司进行测序,结果在NCBI上进行BLAST比对,确定细菌种属。
1.4.3 药敏试验及耐药性分析 对分离到的大肠杆菌、金黄色葡萄球菌、链球菌进行耐药性检测。根据奶牛乳房炎常用治疗药物,选择10种抗生素(青霉素G、红霉素、头孢噻肟、四环素、链霉素、卡那霉素、庆大霉素、环丙沙星、阿莫西林、氟苯尼考)进行药物敏感试验。根据美国临床和实验室标准协会(Clinical and laboratory standard institute,CLSI)[10],每个样品设置2个平行。
2 结果
2.1 主要病原菌分离纯化及16S rDNA鉴定 110份样品经分离培养、纯化以及16S rDNA测序,共有89份样品中分离出病原菌,其中包括大肠杆菌33株,金黄色葡萄球菌15株,链球菌23株,除此之外,本次试验还有22株非主要病原菌被分离出,具体细菌分离鉴定结果见表1。
2.2 耐药性分析 药敏试验结果显示:大肠杆菌、金黄色葡萄球菌和链球菌对青霉素和阿莫西林均表现出高度耐药,其次是红霉素和链霉素,而对庆大霉素、头孢噻肟、环丙沙星、氟苯尼考、卡那霉素的耐药率均在10%左右,而大肠杆菌和链球菌对于土霉素的耐药率为21.1%和29%,高于金黄色葡萄球菌的7.3%。3类主要病原菌耐药检测结果见表2。
3 讨论
导致奶牛乳房炎的病原体有多种,主要包括细菌、真菌、支原体、病毒等,但其中90%以上由细菌引起。引起奶牛乳房炎的细菌主要分为环境致病菌和传染性致病菌2类,环境致病菌包括大肠杆菌、绿脓杆菌、棒状杆菌等;传染性致病菌包括无乳链球菌、停乳链球菌、金黄色葡萄球菌等[11]。本试验采集到的110份临床型乳房炎奶样品中共有89份样品检测出病原菌,病原检出率为80.9%;混合感染有4份,占所有样品的3.6%。经试验发现,该牛场临床型乳房炎主要病原菌主要为大肠杆菌(35.5%)、金黄色葡萄球菌(16.1%)、无乳链球菌(14.0%)、停乳链球菌(7.5%)和乳房链球菌(3.2%)。其中大肠杆菌占比最高为35.5%,这与王丹等[11]、张莉莉[12]对兰州地区大肠杆菌检出结果基本一致。大肠杆菌作为最主要的环境致病菌之一,其主要是通过垫料、粪便等环境因素传播。建议在日常管理方面,应加强环境卫生管理,勤换垫料,勤对牛舍消毒,从源头减少环境致病菌的感染。无乳链球菌、停乳链球菌和金黄色葡萄球菌作为传染性致病菌中最重要的3种,在本次试验中占总分离细菌的37.6%。本结果与李宏胜等[13]、罗金印等[14]在兰州的调查结果相比有明显的改善。传染性致病菌由于超级耐药菌(耐甲氧西林金黄色葡萄球菌,MRSA)的出现治疗十分困难,长期影响奶牛养殖业的发展,近些年随着科技的进步,带有自动消毒的挤奶设备的应用与规范的挤奶流程,都能有效改善由传染性致病菌引起的乳房炎[15]。本试验还分离出除以上3类主要致病菌外的22株病原菌,其中主要为克雷伯菌和沙雷菌等条件致病菌且单种细菌分离比例均不足细菌总数的2%,但在日常生产中仍需加以防范,避免此类细菌感染而带来不必要的损失。

表1 细菌分离鉴定结果Table 1 Results of isolation and identification of bacteria
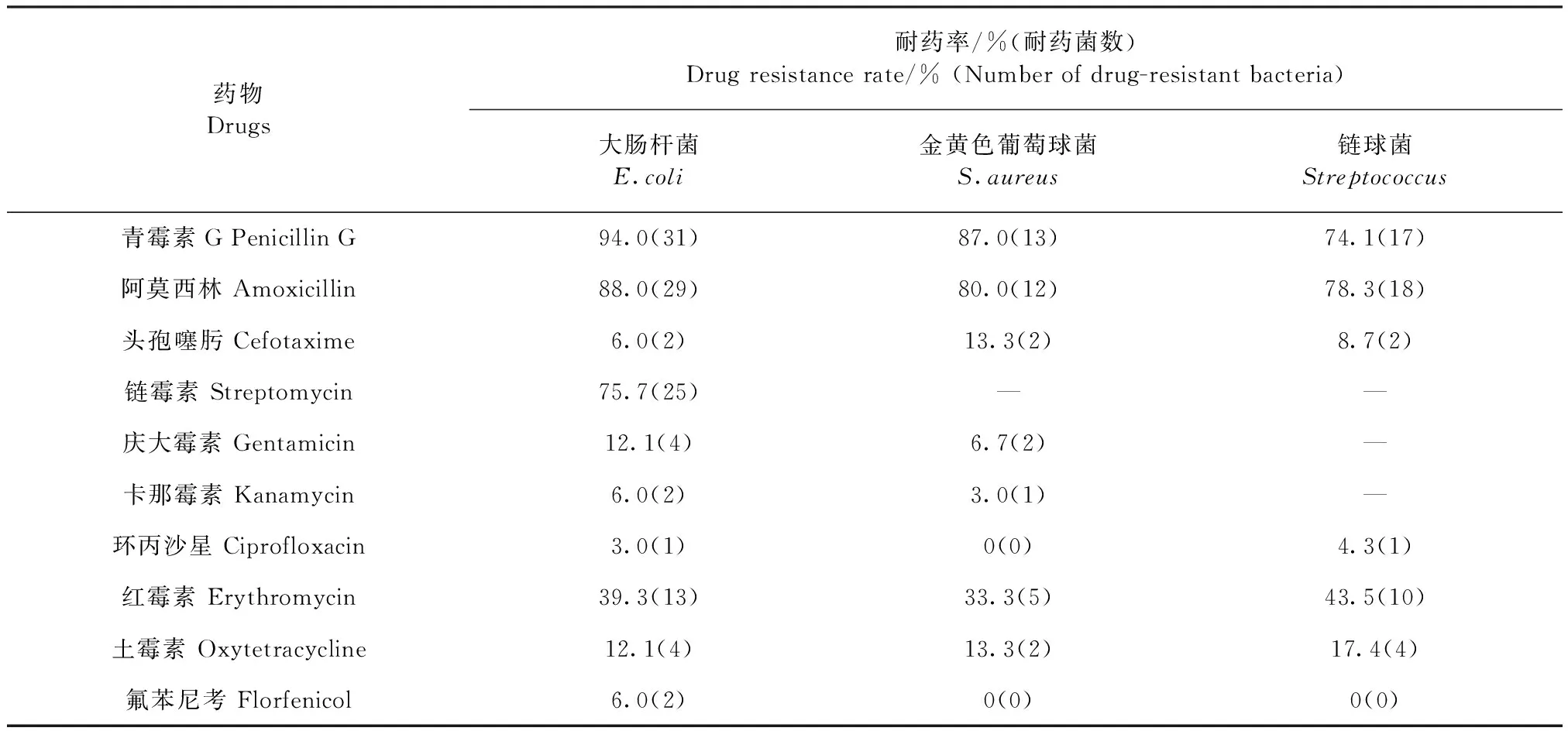
表2 病原菌耐药检测结果Table 2 Detection results of drug resistance of pathogenic bacteria
药敏试验结果显示,受试病原菌对青霉素G和阿莫西林的耐药率高达70%以上,最高达到94.0%,对链霉素的耐药率也达到了75.7%,这一结果与文献报道的结果基本一致[16-17]。导致这一结果的主要原因,是由于青霉素和链霉素是早期治疗奶牛乳房炎最常用的药物,在长期大量的使用这2种药物后使这些常见致病菌对其产生了耐药性。本试验结果中,头孢噻肟、环丙沙星、氟苯尼考、卡那霉素这4种药物对受试细菌的抑制效果极为显著,均在10%以下。由于近些年来,细菌的耐药性逐渐受到人们的重视,兽医工作人员在治疗奶牛乳房炎时会选用敏感药物,并采用交叉用药、联合用药等方法。这在一定程度上缓解了病原菌耐药情况的发生。因此,根据药敏试验结果,建议该奶牛场主要选择以上4种敏感药物,并采用交叉用药、联合用药等方法给药。
虽然,针对乳房炎病原菌的疫苗正大量投入研究中,但是由于不同地区的奶牛乳房炎病原菌种类繁多、危害程度各异,这导致现有的疫苗不能有效的针对每一种病原菌加以预防[18]。在此背景下,严格规范的日常管理和科学合理的用药治疗仍是防治奶牛乳房炎的重要方法。


