ELISA 法检测家禽活疫苗中禽白血病病毒污染的测量不确定度评估
(青岛易邦生物工程有限公司,山东青岛 266114)
禽白血病是由禽白血病病毒(avian leukosis virus,ALV)引起的一种以免疫抑制、生长抑制和髓细胞癌变为特点的传染性致骨髓细胞瘤疾病或成髓性白血病[1]。家禽活疫苗中ALV 的污染和传播是引起禽白血病流行的重要原因。因此,家禽活疫苗中ALV 污染检测对提高生物制品安全性非常重要[2]。
酶联免疫吸附(ELISA)法是具有特异性强、灵敏度高、操作简单、所需设备较少、试剂稳定等优点,成为近年来病毒检测方法中发展最快,应用最广的一种方法。用ELISA 法测定家禽活疫苗中ALV 污染状况,其测量结果的可信度很大程度上取决于不确定度的大小。测量不确定度是与测量结果相关联的参数,表征合理赋予被测量值的分散性。测量不确定度用标准偏差表示时,称为标准不确定度,如用说明了置信水准区间的半宽度表示方法,则为扩展不确定度。在家禽活疫苗的ALV 污染检测结果中引入测量不确定度[3-4],目的在于分析不确定度的来源并对其量化,有助于检测人员关注检测关键环节,提高检测结果的准确性,并为兽医实验室开展相关工作提供借鉴。
1 材料与方法
1.1 材料
1.1.1 样品 鸡新城疫活疫苗(La Sota 株)、鸡传染性支气管炎活疫苗(H120 株)、鸡传染性法氏囊活疫苗(B87 株)和“鸡新城疫、传染性支气管炎”二联活疫苗(La Sota 株+QXL87 株)。
1.1.2 试剂 ALV ELISA 检测试剂盒、鸡新城疫病毒阳性血清、鸡传染性法氏囊病毒阳性血清,购自中国兽医药品监察所。
1.1.3 仪器 酶标仪(型号SUNRISE),瑞士Tecan 公司产品;10~100 μL 单道移液器、30~300 μL多道移液器,Eppendorf 公司产品;恒温生化培养箱(型号SHP-150),上海精宏实验设备有限公司产品。
1.2 方法
1.2.1 样品制备 每批疫苗按照2015年版《中华人民共和国兽药典》三部附录中的ALV 检验法处理并接种鸡胚成纤维细胞,培养5 d,按常规方法消化、收获细胞;将其中1/2 收获的细胞作为第一代细胞培养物(P1样品),其余细胞继续培养。培养5 d 后,按同样方法收获细胞,作为第二代细胞培养物(P2样品)。按同样方法培养收获第三代细胞培养物(P3样品)[5]。将连续3 代细胞培养物P1、P2、P3样品反复冻融3 次,离心,取上清作为每批疫苗的待检样品。
1.2.2 测量不确定度来源分析 测量不确定度评定分为:A 类评定(uA),即重复样本检测引入的不确定度;B 类评定(uB),即可能影响测量结果的因素。根据检测原理、试剂盒说明书分析,本试验的不确定度主要是移液器加样量、温育时间、温育温度、酶标仪测量。
1.2.3 测量不确定评定
1.2.3.1 测量样品重复性引入的不确定度评定利用ALV ELISA 检测试剂盒检测各样品的OD650nm值,每批疫苗的连续3 代细胞培养物P1、P2、P3样品分别重复测定6 次[5],按照文献[3]计算标准不确定度相对标准不确定度。其中,为样品平均值,Sxi为样品重复检测的标准差,xi为每次重复的测量值,n为重复次数。
1.2.3.2 移液器加样引入的不确定度评定 移液器加样产生的不确定度包括移液器容量误差产生的不确定度uC和温度效应产生的不确定度uT[3,6-7]。移液器容量误差产生的不确定度uC,根据移液器校准证书获得100 μL 和300 μL 移液器在100 μL检定点的容量允许误差为±2%,按矩形分布处理计算uC=(100 μL×2%)。温度效应产生的不确定度uT,设定温度为20 ℃时水的膨胀系数为2.1×10-4/℃,实验室温度为(20±4)℃,ELISA试验中每次加样量为100 μL,按照矩形分布计算uT=100 μL×4×2.1×10-4。由于移液器容量误差和温度效应是2 个相互独立的分量,故移液器加样引入的标准不确定度。本次试验共有4 步加样过程(100 μL 样品、100 μL 酶结合物、100 μL 显色液、100 μL 终止液),且相互独立,故加样过程中引入的标准不确定度,相对标准不确定度uB1=uV2/100 μL。
1.2.3.3 酶标仪产生的不确定度评定 依据酶标仪校准证书,设定吸光度的示值误差为0.004,按照均匀统计分布计算标准差,按照文献[6-7]计算酶标仪对每个样品的相对标准不确定度
1.2.3.4 温育时间的不确定度评定 ELISA 试验中,孵育时间为(60±2)min,按照均匀统计分布计算标准差,共孵育2 次,依据文献[3]计算温育时间的相对标准不确定度
1.2.3.5 温育温度的不确定度评定 ELISA 试验共需孵育2 次,孵育的温度均为37 ℃,在使用电热恒温培养箱时,温度波动范围为±1 ℃,根据均匀统计分布计算标准差,依据文献[3]计算温育温度的相对标准不确定度
1.2.4 合成标准不确定度 因以上各分量互不相关,故合成不确定度就是将各个影响因素算出来的不确定度合在一起的过程,即将各个影响因素不确定度的2 次方加在一起,再开平方根,计算公式
1.2.5 扩展不确定度 扩展不确定度(U)以标准偏差的倍数表示。在ELISA 试验中一般使用2倍扩展不确定度,即k=2。当置信概率p=95%时,包含因子k=2,U=u×k,计算每批疫苗连续3 代细胞培养物P1、P2、P3样品的扩展不确定度。
1.2.6 测量不确定度报告 得出ELISA 试验的不确定度后,表示为X=x±U。x为实际样品的OD650nm值,U为不确定度,X表示被检样品的标准的OD650nm值所在的区间。
1.2.7 检测结果判定 根据ALV ELISA 试剂盒的结果判定标准,待检样品OD650nm值大于或等于0.300 判为阳性,小于0.300 判为阴性。如果疫苗的连续3 代细胞培养物P1、P2、P3样品的OD650nm值都小于0.300,即这批疫苗没有ALV 污染;疫苗的连续3 代细胞培养物P1、P2、P3样品中只要有1个样品的OD650nm值大于或等于0.300,即可判定这批疫苗有ALV 污染。
2 结果与分析
2.1 不确定度分量评定
2.1.1 测量样品重复性引入的不确定度评定 为获得重复性测量不确定度,对同一样品进行6 次测定,测量值xi、平均值X、标准差Sxi、标准不确定度uA和相对标准不确定度uA1的结果见表1~4。从表中可以看出,每个样品重复测定6 次,测量值xi是不相同的。测量不确定度用标准差表示时,就是标准不确定度,反应每个样品测量值的分散性。标准不确定度除以平均值就是相对标准不确定度,4 批疫苗的每个样品相对标准不确定度范围在0.02~0.04 之间。
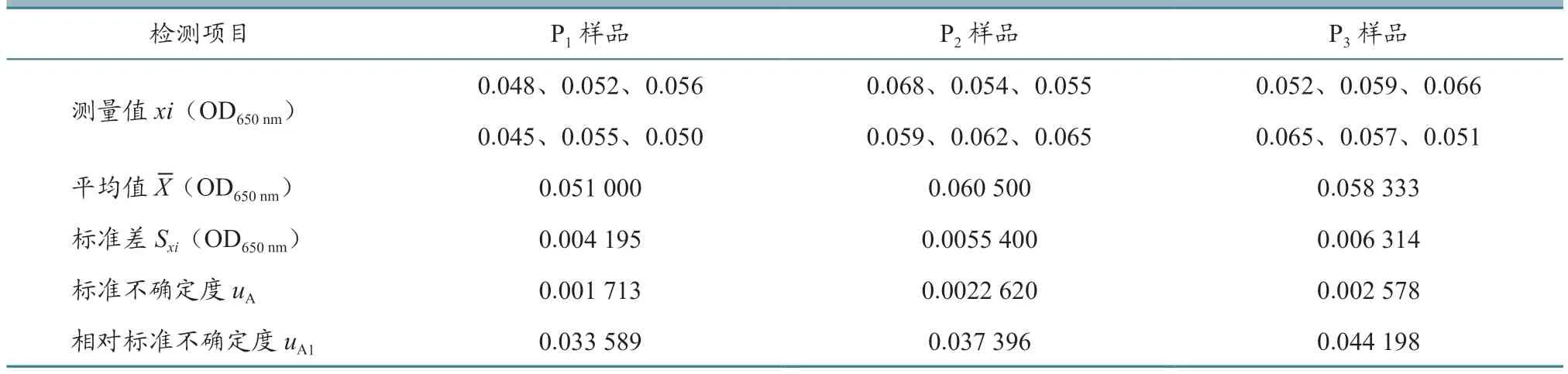
表3 鸡传染性法氏囊活疫苗(B87 株)样品重复测定结果(n=6)
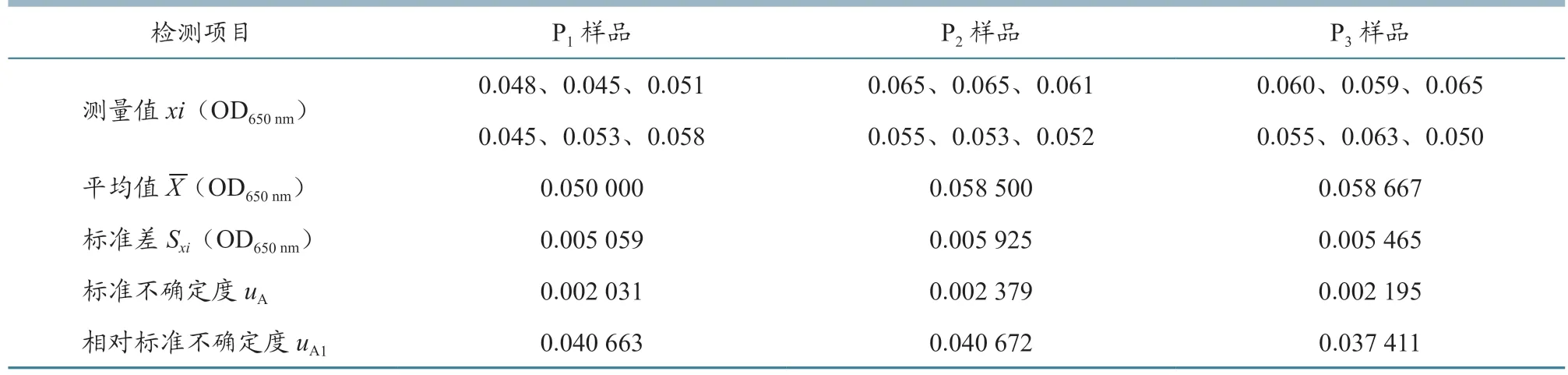
表4 鸡新城疫、传染性支气管炎二联活疫苗(La Sota 株+QXL87 株)样品重复测定结果(n=6)
2.1.2 移液器加样引入的不确定度评定
2.1.2.1 容量误差产生的不确定度 根据移液器容量允许误差,按矩形分布处理计算的移液器引入的标准不确定度
2.1.2.2 温度效应产生的不确定度 依据20 ℃时水的膨胀系数、实验室温度波动范围,按照矩形分布计算的温度效应引入的标准不确定度uT=100 μL×4×2.1×10-4=0.084 μL。
2.1.2.3 加样引入的标准不确定度 移液器加样引入的标准不确定度由移液器容量误差和温度效应2 个相互独立的分量,按公式计算得出,
2.1.2.4 加样引入的综合标准不确定度和相对不确定度 本试验共有4 步加样过程且相互独立,故加样过程中引入的综合标准不确定度,相对标准不确定度uB1=uV2/100 μL=2.315 504 μL/100 μL=0.023 155。4 批疫苗每个样品移液器加样的相对标准不确定度都相同,均为0.023 155。
2.1.3 酶标仪产生的不确定度评定 酶标仪的校准证书给出吸光度的示值误差为0.004,按照均匀统计分布计算,标准差为,计算得出酶标仪对每个样品的相对标准不确定度。测量每个样品的酶标仪标准差相同,但每个样品的平均值不同,导致酶标仪对每个样品的相对标准不确定度不同,由表5 可见,4 批疫苗的相对标准不确定度在0.038~0.046之间。
2.2 合成标准不确定度
根据公式计算每批疫苗样品的合成标准不确定度,结果见表6~9。从表中可以看出,样品的平均值在0.050~0.060 之间,样品的合成标准不确定度在0.003~0.004 之间。
2.3 扩展不确定度
当置信概率p=95%时,包含因子k=2,根据公式U=u×k,计算每批疫苗每个样品的扩展不确定度,结果见表6~9。从表中可以看出,样品的平均值X范围在0.050~0.060 之间,样品的扩展不确定度在0.007~0.008 之间。
2.4 测量不确定度报告
用测量结果的标准形式X=x±U表示每批家禽活疫苗每个样品测量结果,并进行有效数字修正,结果见表6~9。
2.5 检测结果判定
从表6~9 中可以看出,每批家禽活疫苗的连续3 代细胞培养物P1、P2、P3样品ALV OD650nm值不确定度范围在0.040~0.070 之间,上限值均小于0.300,判定为阴性,即所检测4 批活疫苗中没有ALV 污染。
3 讨论
测量不确定度是对测量结果质量的定量表征。测量结果的可信程度在很大程度上取决于其不确定度大小,而测量结果必须附有不确定度说明才是完整并有意义的。ELISA 检测中引入测量不确定度的概念后,给ELISA 的检测值赋予分散性,将检测值由原来的“点”变为“段”,可有效降低误判风险。本研究中,用ELISA 法检测4 批家禽活疫苗中ALV 污染情况,在测量的OD650nm值中,加入测量不确定度,提升了测量结果的可信度。杜鹃[6]在口蹄疫病毒O 型抗体液相阻断ELISA 试验中,引入ELISA 的测量不确定度,提升了测量结果的可信度,并有效降低了假阳性、假阴性出现的风险;史喜菊等[8]在牛布鲁氏菌补体结合试验中,引入测量不确定度,使测量结果的质量判定有了定量依据。

表5 酶标仪对每个样品的相对标准不确定度
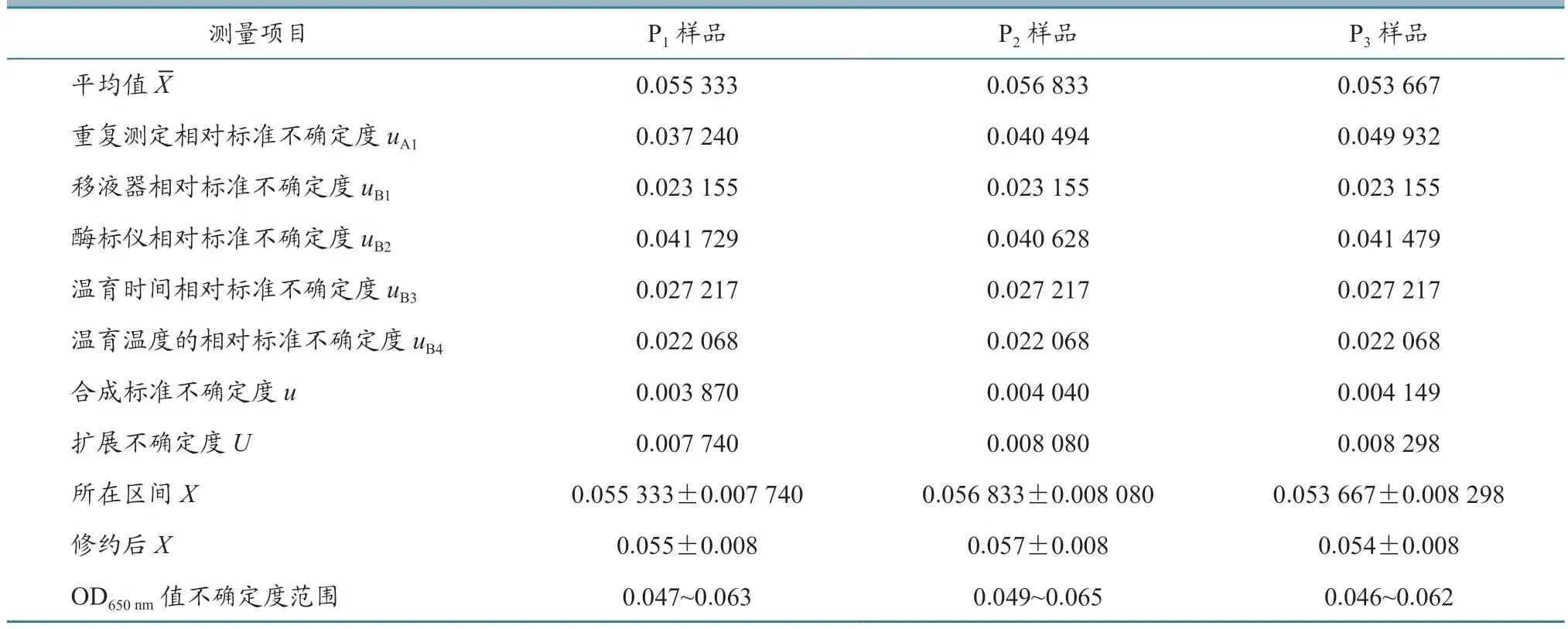
表6 鸡新城疫活疫苗(La Sota 株)样品各个不确定度评定结果
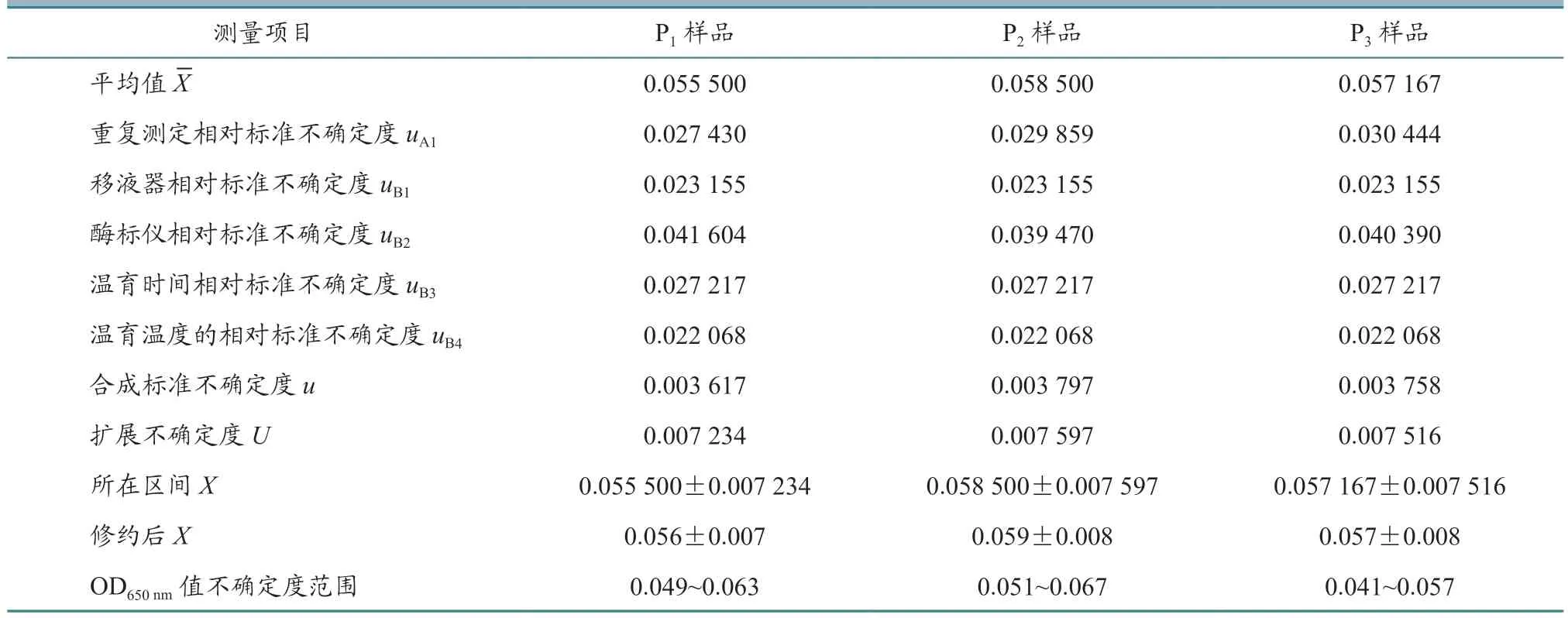
表7 鸡传染性支气管炎活疫苗(H120 株)样品各个不确定度评定结果
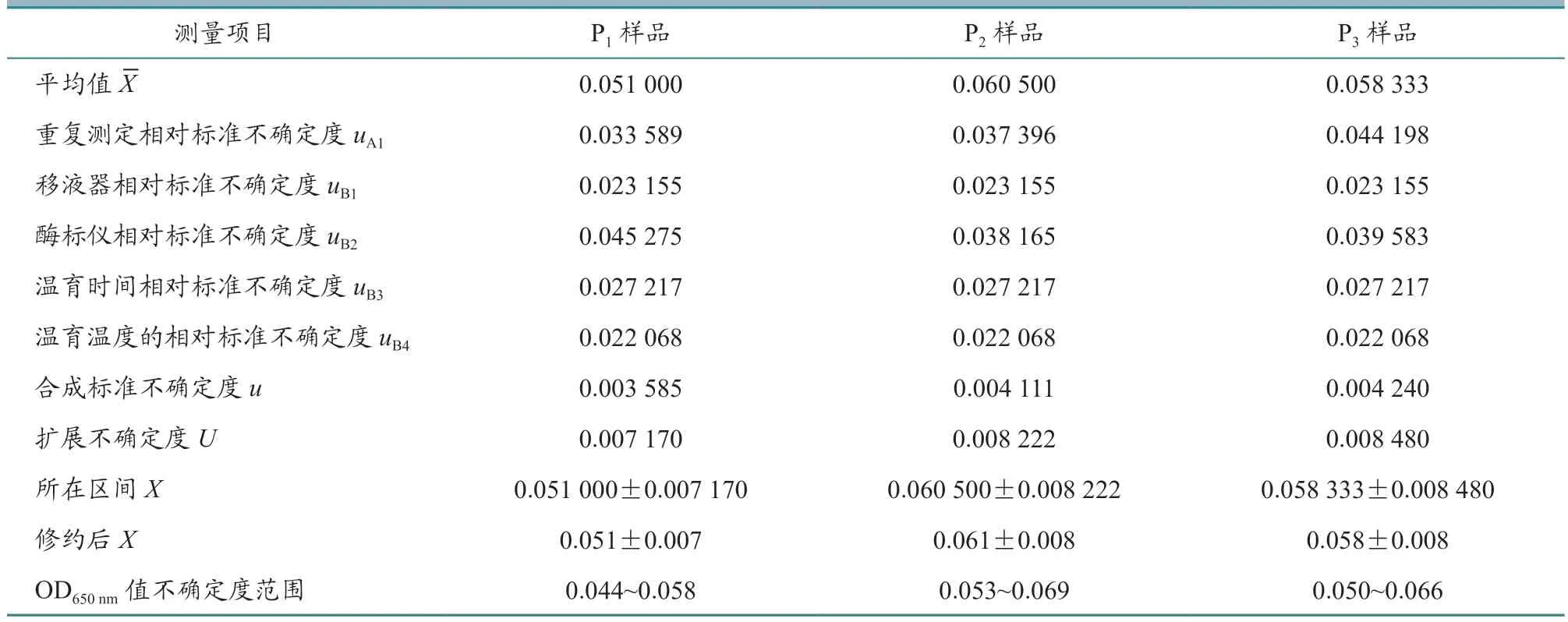
表8 鸡传染性法氏囊活疫苗(B87 株)样品各个不确定度评定结果
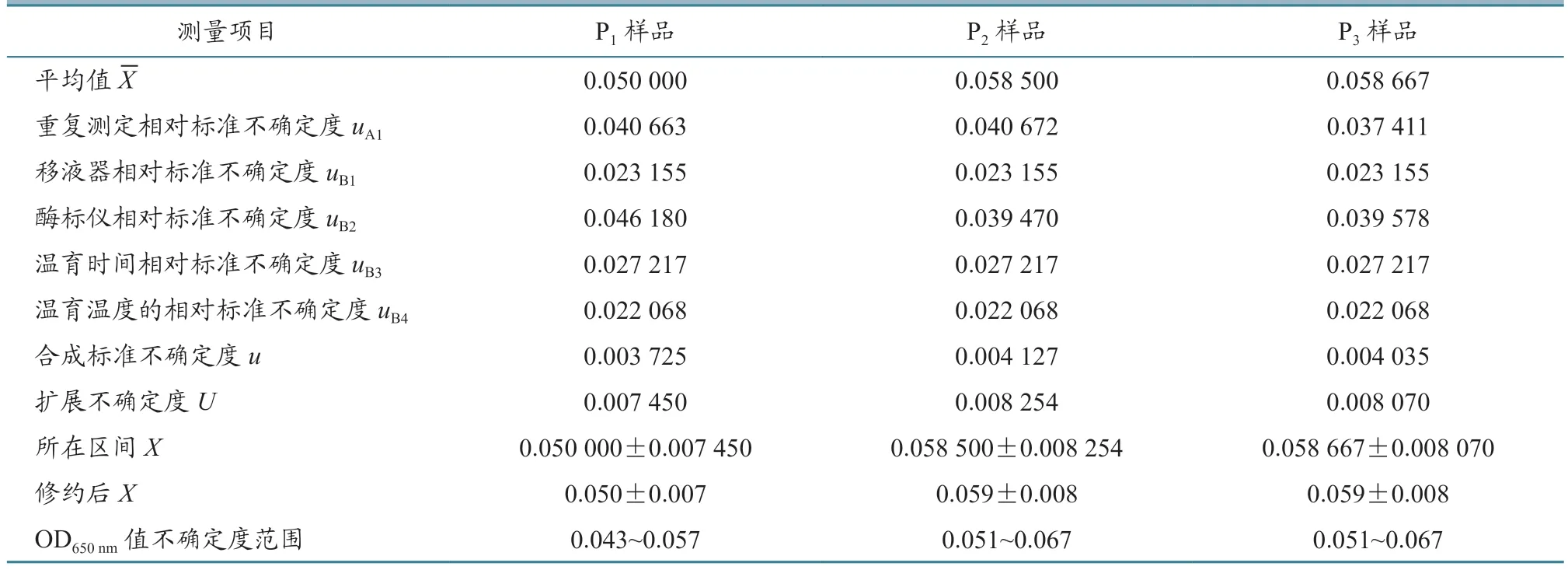
表9 鸡新城疫、传染性支气管炎二联活疫苗(La Sota 株+QXL87 株)样品各个不确定度评定结果
本研究中,4 批家禽活疫苗的禽白血病病毒的OD650nm值远远小于0.300,加入测量不确定度,对于结果的判定影响不大。假如测得的样品OD650nm值接近临界值0.300,加入测量不确定度,就可以降低误判风险。家禽活疫苗的外源ALV 的检验中,加入测量不确定度,可提升测量结果的可信度和降低误判风险,排除一切ALV 污染,从而给广大养殖生产企业提供真正纯净疫苗,为家禽养殖业的健康发展保驾护航。
用ELISA 法检测家禽活疫苗中ALV 污染的不确定度来源多样,既有样品重复检测引入的A 类不确定度,又有移液器、酶标仪及温育温度和温育时间测量误差等引入的B 类不确定度。在所讨论的影响测定结果不确定度的因素中,酶标仪测量和重复检测对不确定度结果的影响最大;移液器加样、温育温度和温育时间对不确定度影响程度较小。酶标仪测量引入的不确定度可以通过良好的仪器使用习惯,严格按照仪器的期间核查规程、维护规程进行核查和维护,并合理利用检定校准数据进一步减小酶标仪测量引入的不确定度;采用ELISA 法测定家禽活疫苗中ALV 污染的过程中,应尽可能增加重复试验次数,以减少样品重复性试验导致的不确定度,从而减少检测的总不确定度;应严格控制试验反应条件,选择精密度高、误差小的移液器,从而减小由其引入的不确定度,以提高检测质量。

