基于ERK和NF-κB途径探讨洋金花醉茄内酯Daturataturin A抑制HaCaT细胞增殖和迁移的作用
魏政,苏慧琳,匡海学*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.广东药科大学中药学院,广东 广州 510006)
洋金花是白花曼陀罗属一年生草本植物,具有止咳平喘、止痛镇静的作用,可用于治疗银屑病,疗效确切[1]。近年来的研究表明,醉茄内酯具有抗炎[2]、抗氧化[3]、抗肿瘤[4]和免疫抑制[5]效应。笔者推测洋金花中某些醉茄内酯,尤其是Daturataturin A(DTA)可能对表皮细胞生物学具有重要影响。醉茄内酯是一系列28C原子的甾体衍生物,在侧链C20位置上有一个δ内酯[6]。近年来,醉茄内酯类化合物的抗炎和对细胞毒性的影响已有报道,NF-κB信号通路是主要的药理靶标,可以调节各种生理过程,如细胞增殖、发展、免疫、细胞凋亡、炎症和代谢[6]。
银屑病是一种慢性复发性皮肤炎症,其主要病理表现为表皮角质形成细胞的异常增殖。表皮细胞NF-κB和ERK等异常激活,导致过度增殖、迁移、炎症等生物学进程。因此,本研究基于ERK和NF-κB途径,对洋金花醉茄内酯Daturataturin A(DTA)诱导HaCaT增殖、迁移、炎症及相关分子机制进行研究,从而探讨其治疗银屑病的作用机制。
1 材料与方法
1.1 材料
抗体NF-кB、抗体ERK、抗体p-ERK、抗体PCNA、HRP-标记的羊抗兔IgG、HRP-标记的羊抗鼠IgG(上海碧云天生物技术有限公司);IL-6、IL-8和 TNF-α ELISA试剂盒、CCk-8试剂(南京恩晶生物科技有限公司)。
1.2 洋金花的提取分离和Daturataturin A的精制
取干燥洋金花,用40倍量70%乙醇回流提取3次,每次2.5 h,合并提取液,冷却至室温,静置,滤过。滤液回收溶剂至浓缩液无醇味后,用0.1%的盐酸溶液5倍于浓缩液体积浸提6~8次,滤过。将此滤液进行732型阳离子交换树脂柱色谱,流速3 BV/h,流出液继续进行AB-8型大孔吸附树脂柱色谱,流速2.5 BV/h,吸附完全后用纯水将树脂洗至流出液还原糖反应阴性,用50%乙醇4 BV洗脱,最后用95%乙醇洗脱回收溶剂。结合前期药理学及化学成分研究,其中水洗脱部分主要含有水溶性杂质,95%乙醇洗脱部分主要含有脂溶性色素。50%乙醇洗脱组分中主要含有黄酮类化合物和甾体类化合物,是治疗银屑病的药效物质基础,即经大孔树脂得洋金花50%乙醇洗脱组分。
对50% EtOH洗脱部分以葡聚糖凝胶(Sephadex LH-20)柱色谱进一步分离,依次用水、MeOH进行洗脱,得到水洗脱组分(醉茄内酯类化合物)和甲醇洗脱组分(黄酮类化合物)。采用反相柱色谱和HPLC等现代方法对水洗脱组分进行分离,得到精制的Daturataturin A。
1.3 细胞培养
HaCaT细胞用含10%胎牛血清和100 U/mL青-链霉素的高糖DMEM培养基培养,以2.5%胰蛋白酶-0.02%EDTA消化细胞;48 h更换新的培养液。培养条件为37 ℃、5%CO2。
1.4 增殖、迁移、抗炎实验
采用CCK-8法检测并分析药物的量-效关系和时-效关系;WST-1、中性红、结晶紫联合测试药物对细胞不同细胞器靶点的影响;HaCaT细胞克隆形成实验测试DTA的抗增殖效应;细胞迁移实验采用细胞划痕法和transwell法;ELISA法检测炎症因子IL-6、IL-8、TNF-α 的表达情况。
1.5 免疫蛋白印迹法检测ERK、NF-κB、PCNA的表达
将细胞消化后,制成单个细胞悬液,均匀的分装至25 cm2培养瓶,使用相应完全培养液于37 ℃、5% CO2条件下培养。至细胞铺满80%,加入相应剂量的含药物的完全培养基中培养24 h或48 h,收获细胞。细胞裂解在4 ℃进行,所有试剂均预冷。首先,以PBS(pH值7.4)洗细胞,孵育在新鲜添加1%蛋白酶和磷酸酶抑制剂的RIPA裂解液(含Na3VO4100 mmol/L,PMSF 1 mmol/L)30 min,每瓶600 μL。用细胞刮刀收集细胞,4 ℃,13 000×g离心20 min,取上清液。BCA法测定蛋白质含量。加入4×负载缓冲液后,煮沸5 min,将15 μg蛋白装入聚丙烯酰胺凝胶电泳系统(SDS-PAGE)。利用图像分析软件(Analytik Jena, Jena,德国)对蛋白条带进行分析,确定目标蛋白与内参的比值。核蛋白的提取按照制造商的说明书(solarbio,北京)进行。
1.6 统计学处理
实验数据处理采用SPSS 20.0软件进行,对各组数据进行方差齐性检验,若P>0.05,则方差具有齐性,多组比较釆用单因素方差分析(One-way ANOVA),两两比较采用LSD-ttest ;若P<0.05,则方差不齐,采用单因素方差分析,并使用Brown-Forsythe或Welch校正,两两比较采用Durmett’s T3检验。检验结果以均数±标准差表示。P≤0.05表示有统计学意义,并应用Prism 5显示平均值和标准差的直方图。
2 结果
2.1 DTA抑制HaCaT增殖呈剂量和时间依赖关系
首先,应用CCK-8实验测定DTA(化学结构如图1f所示)对HaCaT抑制活性的量-效和时-效作用,实验重复3次,单次实验设置6个复孔,每隔6 h设为测试的时间点,并应用Prism 5利用平均值和标准差拟合量-效曲线。DTA 30 μmol/L、60 μmol/L、120 μmol/L对HaCaT呈量效依赖的抑制作用(图1a、图1c和表1、表2)。 24 h和48 h的IC50分别为32.74 μmol/L和26.07 μmol/L(图1b、图1d)。30 μmol/L DTA对HaCaT的抑制活性随时间递增,大约在24 h起到明显抑制增殖作用(图1e和表3)。

注:a.24 h CCK-8实验;b.24 h量效曲线;c.48 h CCK-8实验;b.48 h量效曲线;e.30 μmol/L DTA的时效曲线;f.Daturataturin A化学结构。图1 DTA抑制HaCaT活性的初步研究

表1 DTA作用于HaCaT细胞24 h的增殖抑制率

表2 DTA作用于HaCaT细胞48 h的增殖抑制率

表3 DTA在不同时间点作用于HaCaT细胞的增殖抑制率
克隆形成实验是比较敏感的测定细胞增殖能力的实验方法。利用多功能成像仪 (Analytik Jena,Jena,德国)及其配套的图像分析软件拍摄并计算克隆形成率。细胞以单个分散的形式接种在6孔板内,数日后,单个细胞不断复制形成克隆,计算克隆形成率,可以直观的反应细胞的增殖能力。肿瘤细胞大多具有克隆生长的能力,HaCaT细胞是永生化的表皮细胞,也具有较弱的克隆能力。在克隆形成实验,7.5 μmol/L DTA能够明显抑制HaCaT增殖(P<0.05),然而30 μmol/L DTA几乎完全抑制克隆形成(图2a、图2b和表4)。

图2 DTA抑制HaCaT细胞克隆形成

表4 DTA影响HaCaT细胞克隆形成率
2.2 DTA抑制IL-17诱导的HaCaT过度增殖
以IL-17诱导的HaCaT细胞作为银屑病模型,研究DTA的抗增殖作用。在同一个96孔板样本中,采用WST1、中性红、结晶紫三联测,分别显示DTA对线粒体、溶酶体、细胞膜三个细胞器靶点的作用。我们发现IL-17 50 ng/mL可诱导HaCaT过度增殖(P<0.05);DTA 7.5 μmol/L (P<0.05), 15 μmol/L (P<0.05) 和30 μmol/L (P<0.01)可剂量依赖的逆转这种趋势(图3a、图3b、图3c和表5、6、7)。三个不同的细胞器靶点实验显示,DTA 7.5 μmol/L对溶酶体的抑制并无显著意义,提示溶酶体中可能存在其他细胞保护作用的生物学进程(图3b和表6)。
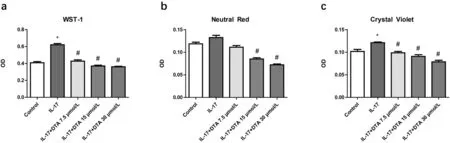
注:a. WST-1;b.中性红;c.结晶紫依次在一个样本中的连续测试;IL-17(50 ng/mL)添加到除空白组之外的各实验组,实验重复3次,单次实验设置6个复孔。图3 WST-1、中性红、结晶紫三联测试DTA抑制过度活化的HaCaT

表5 WST-1测试DTA抑制HaCaT细胞的过度增殖
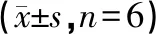
表6 中性红测试DTA抑制HaCaT细胞的过度增殖
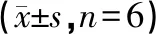
表7 结晶紫测试DTA抑制HaCaT细胞的过度增殖
2.3 DTA抑制HaCaT的迁移能力
细胞划痕实验显示DTA抑制HaCaT划痕愈合能力(图4a、图4b和表8)。Transwell实验显示了DTA可抑制HaCaT单细胞迁移(图4c、图4d和表9)。Transwell实验拍摄照片后,用33%乙酸抽提样本,酶标仪测520 nm波长吸光度,OD值代表迁移细胞的相对含量,结果显示与镜下细胞计数的方法相似(图4e和表10)。
检测到30 μmol/L DTA可抑制总ERK的表达(P<0.05),磷酸化的ERK可剂量依赖式的被DTA抑制(7.5 μmol/L;15 μmol/L,P<0.05;30 μmol/L,P<0.01)(图5a、图5b和表11)。

注:a和b为24 h细胞划痕实验;c、d、e为12 h Transwell实验;与Control比较, *P<0.05,**P<0.01。图4 DTA抑制HaCaT细胞迁移

注:与Control比较,*P<0.05,**P<0.01。图5 DTA抑制HaCaT细胞迁移的始动因子ERK

表8 DTA抑制HaCaT细胞划痕愈合

表9 Transwell实验检测DTA抑制HaCaT细胞迁移计数

表10 Transwell实验联合结晶紫抽提检测DTA抑制HaCaT细胞迁移的相对计数

表11 免疫印迹检测DTA抑制HaCaT细胞迁移的始动因子ERK和p-ERK与内参的比值
2.4 DTA抑制持续活化的NF-κB
作为炎症信号分子,NF-κB在多种肿瘤细胞高水平表达,同时,抑制NF-κB会导致肿瘤细胞增殖活性减弱。Cyclin D1是NF-κB的下游信号,表明炎症信号和增殖信号之间的关系[7]。NF-κB进入细胞核,激活转录因子,随后对细胞的增殖,存活和炎症反应有一系列的影响。笔者发现HaCaT细胞持续高表达NF-κB,免疫荧光显示强烈的NF-κB细胞核染色信号,这可能与HaCaT细胞永生化的特性有关。随着DTA(15 μmol/L,30 μmol/L,P<0.05)用量增加,在24 h,NF-κB免疫染色平均光密度显著降低,30 μmol/L DTA组NF-κB信号几乎完全消失(图6a、图6b和表12)。DTA(7.5 μmol/L, 15 μmol/L,P<0.05;30 μmol/L,P<0.01)可显著降低核内NF-κB/p65的表达(图6d和表12)。此外,PCNA在S期DNA合成是必需的,DTA(15 μmol/L,30 μmol/L,P<0.05)降低PCNA免疫染色平均光密度(图6a、图6c和表12);DTA(7.5 μmol/L, 15 μmol/L,P<0.05;30 μmol/L,P<0.01)可显著降低核内PCNA的表达(图6e和表12)。
炎症因子分泌的ELISA测定,显示30 μmol/L DTA可显著降低IL-6、IL-8、TNF-α的分泌(图7a、图7b、图7c和表13),其抗炎作用与抗银屑病药物Tretinoin (1 μmol/L)(P<0.05)相似。

表12 免疫印迹和免疫荧光检测DTA抑制HaCaT细胞NF-κB和PCNA的表达

注:与Control比较,*P<0.05,**P<0.01。图6 DTA 抑制持续活化的 NF-κB和下游的增殖信号

注:与Control比较,*P<0.05,**P<0.01。图7 DTA抑制分泌性的炎症因子

表13 ELISA 检测DTA作用下的HaCaT细胞IL-6、IL-8和TNF-α 的分泌
3 讨论
银屑病是一种慢性复发性皮肤炎症,其主要病理表现为表皮角质形成细胞的异常增殖。银屑病的临床表型有寻常型银屑病、斑点状银屑病、反向银屑病、红皮病型牛皮癣和脓疱性银屑病[8]。现已经提出许多假说来推测银屑病可能的病理模型。银屑病的临床表现为厚鳞屑,并伴有组织病理学改变,是以表皮角化为主要特征的一种疾病。然而,银屑病病理生理学的发现揭示了这种紊乱机制,角质形成细胞的过度增殖是银屑病的重要机制之一。
近年来提出了一种涉及IL-23/Th17免疫轴的银屑病致病模型[9]。在与这个轴相关的分子中,IL-17是影响银屑病的关键因子,并已开发出针对其的相应生物制剂[10-11]。IL-17激活核factor-kappa B (NF-κB)信号通路,并引起下游一系列细胞增殖和炎症进程。本研究显示DTA可抑制IL-17诱导的HaCaT过度增殖,可能是治疗银屑病的机制之一。
表皮角质形成细胞作为原驻的天然免疫细胞,可防御外来的有害物质侵袭,充当免疫卫兵的作用。激活的 NF-κB是一个含有p65和p50亚基二聚体的转录因子。NF-κB经IκB激酶诱导后与IκB分离,进入到细胞核而影响特殊靶基因序列。多种刺激可以激活NF-κB信号转导通路,包括TNF-α、IL-1、IL-17、病毒和脂多糖。银屑病患者皮损处相比于健康者 NF-κB表达上调[12]。作为炎症关键性调节因素,NF-κB可以调节各种细胞因子、趋化因子、黏附分子和酶的转录。也影响炎性细胞因子的产生,如TNF-α,IL-1,IL-6和IL-8。此外,NF-κB激活能影响角质细胞在银屑病皮损中的分化和增殖[13]。NF-κB是天然免疫的主要信号途径,银屑病患者角质形成细胞的产生与反应异常的炎性细胞因子有关,包括TNF-α, IL-6和IL-8[9],本研究显示了DTA可抑制持续活化的NF-κB及其下游的炎症因子。
蛋白激酶是信号网络的重要组成部分,可以使细胞作为有机体的一个组成部分发挥作用。胞外信号激酶ERK(Extracellular signaling kinase, ERK),磷酸化并转运至核内,参与了细胞增殖[14]和迁移[15]的多种进程。ERK和NF-κB存在着交互作用,本研究显示DTA抑制ERK的磷酸化水平,进而抑制HaCaT增殖、迁移和炎症进程。
醉茄内酯是一类广泛存在于茄科植物中的有活性的化合物。随着分子结构和药理研究的进展,其具有良好的抗癌作用的报道越来越多。茄科植物分布广泛,为其天然产物的结构和药理研究提供了大量资源。笔者研究结果揭示了洋金花醉茄内酯DTA可有效抑制HaCaT增殖和迁移,其机制可能是通过抑制炎症信号分子NF-κB和ERK进行的。这可能是洋金花制剂治疗银屑病的作用机制之一。

