基于差异蛋白组学探讨复方钩藤降压片与替米沙坦对左心室肥厚干预的作用研究
周曼丽,简维雄,2*,王健章,3,冯宇,钱舒乐,3,张家齐,3,俞赟丰
(1.湖南中医药大学中医学院,湖南 长沙 410208;2.湖南中医药大学国家重点学科中医诊断学湖南省重点实验室,湖南 长沙 410208;3.湖南中医药大学第一附属医院,湖南 长沙 410007)
人体和各种生命物质皆是由蛋白质组成。迄今为止,人类已经发现的蛋白质有100多万种, 可以按不同的组成、结构和修饰组成各种细胞和生命物质。蛋白质组学从整体角度分析了细胞生命过程中,其内部动态变化的蛋白质组成、表达水平、修饰状况、蛋白质之间的相互作用以及蛋白质与其他生物分子之间的相互作用, 从而了解蛋白质的功能及其在生命过程中的作用。由于疾病的发生和药物治疗靶点大多数是在蛋白质(包括酶、受体及信号转导蛋白) 水平,因此,蛋白质组学适用于研究药物的作用机制、寻找有效的药物靶点以及开发新药。为此,本项目应用同位素标记(iTRAQ)技术开展了复方钩藤降压片和替米沙坦对左心室肥厚干预的蛋白质组学研究,现报告如下。
1 材料
1.1 动物
选用SPF级12周龄自发性高血压大鼠(SHR)20只,随机平均分为CGTA干预组和TMST干预组。体质量(250±20)g,雄性。在人工调控的环境中22 ℃~26 ℃饲养,自由进食饮水,连续干预12周后用于实验。饲料及垫料由湖南中医药大学动物实验中心提供(SHR大鼠购自北京维通利华实验动物技术有限公司,饲料购自湖南斯莱克景达实验动物有限公司)。
1.2 试剂
Trypsin(Promega公司,美国);三乙胺碳酸氢盐仪、TEAB(Applied Biosystem公司,意大利);乙腈、甲酸(Sigma公司,美国);2-D Quant Kit(GE Healthcare公司,美国);8标iTRAQ 试剂(Applied Biosystem公司,意大利);复方钩藤降压片(湖南中医药大学第一附属医院制剂科);替米沙坦片剂(江苏万郑生化医药股份有限公司)。
1.3 仪器
离心机(5430r)(Eppendorf公司,德国);超纯水系统(Milli-Q Advantage)(密理博,美国);多功能生物样品均质器(precellys24)(Bertin,法国);超声波细胞粉碎机(VCX130)(Sonics,美国);小型垂直电泳槽(Mini-PROTEAN Tetra Cell)(伯乐,美国);扫描仪(powerlook2100xl)(UMAX,美国);酶联免疫吸附仪(iMark)(伯乐,美国);SCX强阳离子交换液相色谱柱(菲罗门公司,美国);Online HPLC(LC-20AD nanoHPLC)、Offline HPLC(C-20AB HPLC)(岛津公司,日本);质谱仪(Q EXACTIVE)(赛默飞世,中国)。
2 方法
2.1 心肌组织蛋白质提取
2.1.1 样品前处理
称量样品,每个样品称取0.1 g进行提取实验。
2.1.2 蛋白提取
参考文献[1]进行提取。1)将样品置于研钵,在液氮条件下研磨成粉末;2)把粉末转至加有裂解缓冲液Lysis Buffer离心管中,混匀,置于冰上5 min后加入终浓度为10 mmol/L的DTT,冰浴超声5 min;3)25 000×g4 ℃离心20 min,取上清转入新的离心管中,加入5倍以上体积冷丙酮沉淀过夜;4)25 000×g4 ℃再次离心20 min,弃上清;重复加入冷丙酮,捣碎沉淀,高速离心后弃上清;5)风干沉淀中残余丙酮,重复以上实验步骤后留取上清;6)向蛋白液加入终浓度10 mmol/L的DTT, 56 ℃水浴1 h;7)加入终浓度55 mmol/L的IAM,暗室放置45 min后循环上述实验过程,最后25 000×g4 ℃离心15 min,取上清用于定量。
2.1.3 定量信息
2.1.3.1 蛋白质浓度测量(Bradford定量法)
参考文献[2]进行。1)准备BSA标准品的标准曲线,向10管的标准品量(0.2 μg/uL BSA)添加纯水,使最终体积为20 μL。管1是不含蛋白的参照,其他管分别含有0.4、0.8、1.2、1.6、2.0、2.4、2.8、3.2、3.6 μg蛋白;2)将样品稀释一定倍数至测量范围内,每个样品各取20 μL至管中;3)向每管添加180 μL protein assay reagent,混合,室温培养10 min;4)用酶标仪测量595 nm下的吸光度,依据标准曲线计算出样品浓度。
2.1.3.2 定量曲线
Bradford工作液(考马斯亮蓝G-250)和蛋白在酸性条件下结合时,在一定的范围内,蛋白质含量与在595 nm的吸光值成正线性相关关系[2]。R2=0.991 7,呈线性关系。定量曲线见图1。
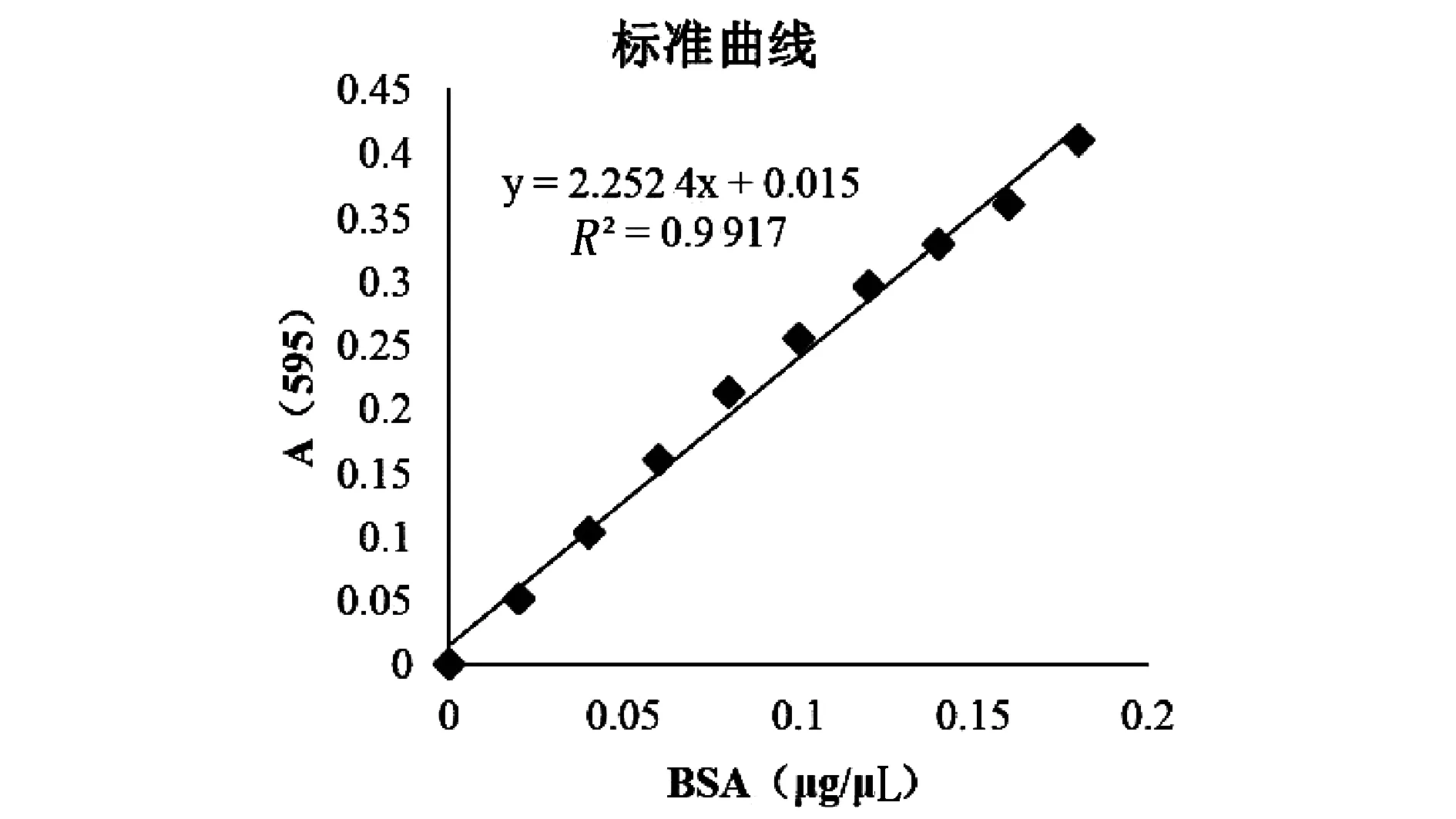
图1 定量曲线
2.1.3.3 定量数据
两组大鼠心肌组织定量数据见表1。

表1 两组大鼠心肌组织定量数据比较
2.1.3.4 SDS电泳蛋白质条带信息
配置12%的SDS聚丙烯酰胺凝胶。每个样品分别与4×loading buffer混合,95 ℃加热5 min。每个样品上样量为30 μg,Marker(97 KDa,66 KDa,43 KDa,31 KDa,20 KDa,14 KDa)上样量10 μg。120 V恒压电泳120 min。电泳结束后,考染液染色2 h,再用脱色液脱色3~5次,每次30 min[2]。结果提示:条带数目繁多。见图2。
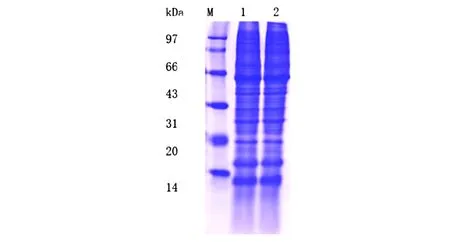
注:M.Marker;1.TMST组;2.CGTA组。图2 蛋白质条带信息
2.2 iTRAQ分析实验方法
大鼠心肌组织iTRAQ分析的基本流程见图3。第一步:取等量蛋白Trypsin酶解每个样品;第二步:用iTRAQ试剂标记肽段;第三步:对混合后的肽段使用强阳离子交换色谱(Strong Cation ExchangeChoematography,SCX)进行预分离;第四步:进行液相串联ESI质谱仪:Q-EXACTIVE (ThermoFisher Scientific,San Jose,CA)分析[2]。
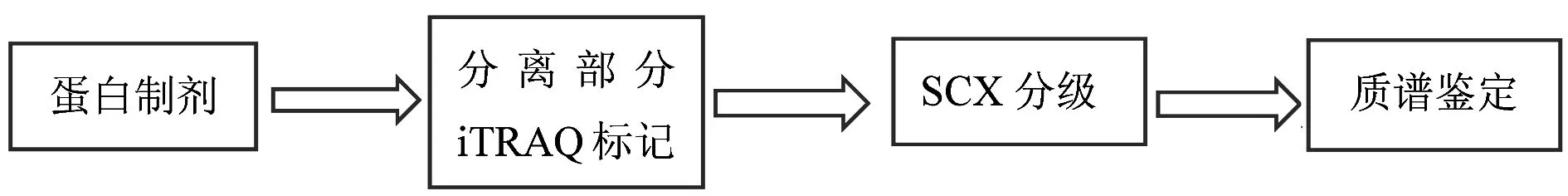
图3 大鼠心肌组织iTRAQ分析的实验流程
2.3 蛋白质分析方法
1)数据库选择:uniprot Rattus(36508sequences);2)Mascot搜索Mascot2.3.02版本;3)蛋白质丰度比分布;对每个蛋白质差异倍数以2为底取对数后作出分布如图4。表达量上调的蛋白居于横坐标0位置的右侧,表达量下调的蛋白居于横坐标0位置的左侧。其中差异倍数大于1.2的点用红色和绿色标出(红色为表达量上调,绿色为表达量下调)[2]。这些红色和绿色的点可能是潜在的差异蛋白。
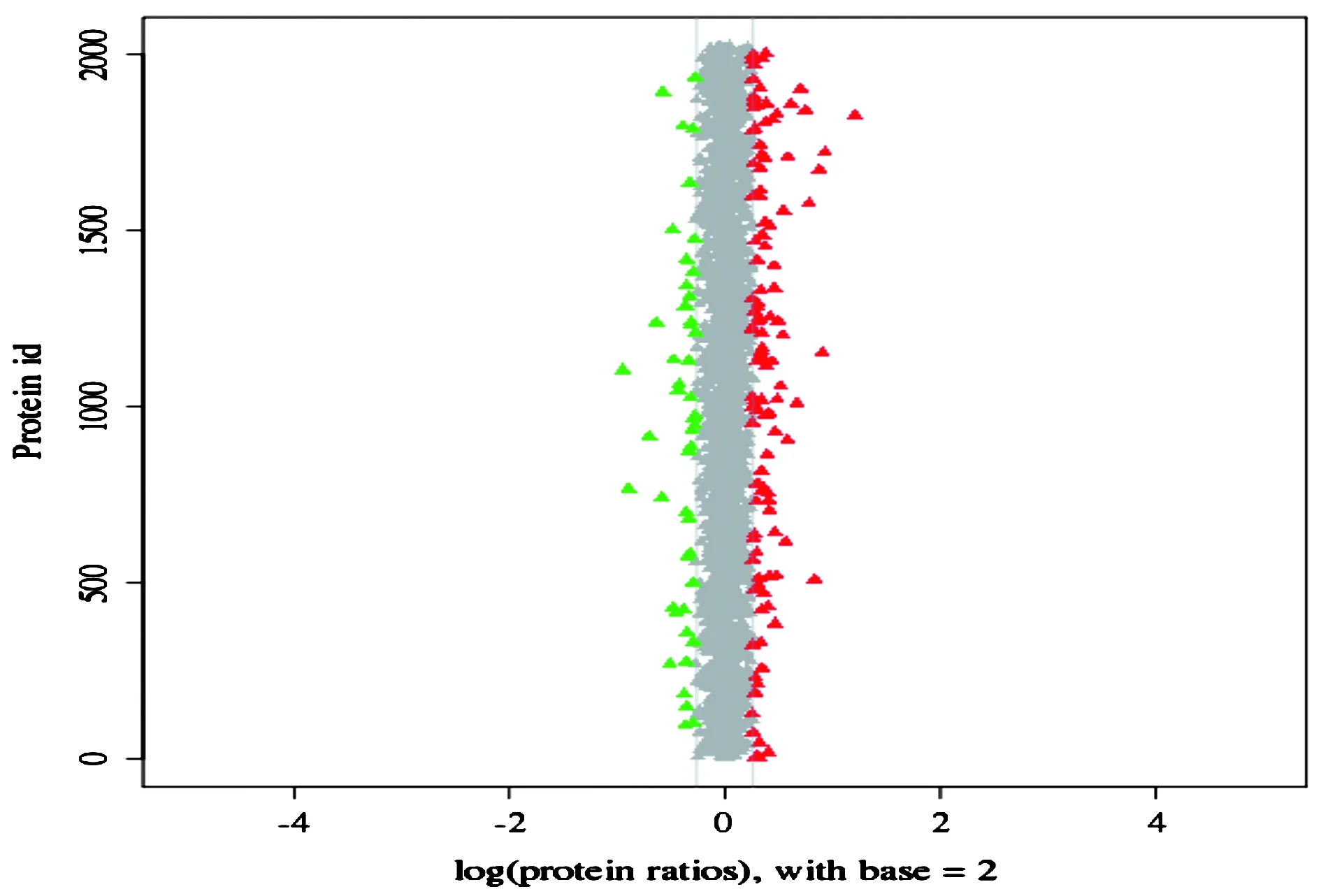
图4 TMST组/ CGTA组蛋白质丰度比较
3 结果
3.1 CGTA组/TMST组心肌标本的差异蛋白Pathway富集分析
CGTA组与 TMST组的差异蛋白Pathway富集分析显示有3条通路(见表2)。3条通路分别是:补体和凝血级联通路(Complement and coagulation cascades)、紧密连接(Tight junction)、TGF-β信号通路(TGF-betasignaling pathway)。
3.2 CGTA组/TMST组心肌标本中差异蛋白的iTRAQ分析
蛋白质组学只对两组共同蛋白作分析,设定富集蛋白比值≥1.2为上调蛋白(见表3和表4),富集蛋白比值≤0.83为下调蛋白。结果显示:CGTA组与TMST组相比较,其中上调的蛋白12种,分别为:凝血酶3(Plastin 3)、纤蛋白5 (Fibulin-5)、半乳凝集素 (Lactadherin)、肌球蛋白11(Myosin-11)、S期激酶相关蛋白1(S-phasekinase-associated protein1)、肌球蛋白8(片段)[Myosin-8 (Fragment)]、丝氨酸/苏氨酸蛋白磷酸酶(Serine/threonine-protein phosphatase 2A)、血管性血友病因子(片段)[Von Willebrand factor (Fragment)]、α2-抗纤溶酶(Protein Serpinf2/alpha-2-antiplasmin、Alpha-2 antiplasmin(α2-AP)) 、肌球蛋白调节轻链(Myosin regulatory light chain RLC-A)、肝素辅助因子2(Heparin cofactor 2)。

表3 富集Pathway蛋白质简表

表4 富集Pathway蛋白质详表
3.3 差异蛋白之间的相互作用研究
将筛选出来的12个差异蛋白,利用string数据库绘制差异蛋白功能联系图得到蛋白之间的相互作用(见图5),其中string可识别的差异蛋白为11个,Myosin-8未能识别。在string绘制的关系网中,肌球蛋白11(myosin-11)与肌球蛋白调节轻链RLC-A(Myosin regulatory light chain RLC-A)之间关系最为密切。
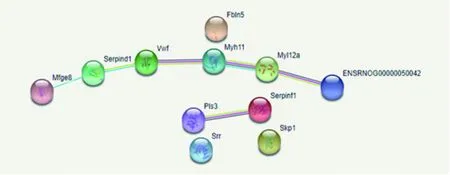
图5 差异蛋白质相互作用网络
4 讨论
左室肥厚是高血压靶器官损害的最重要特征之一,也是心血管事件独立的危险因素,可显著增加心源性猝死、急性心肌梗死、心力衰竭、室性心律失常等心血管事件的发生率和病死率,严重影响高血压病的预后。心肌肥厚是一个多因子、多途径的作用的结果,单一蛋白的改变可以导致心肌肥厚,但是多个蛋白失衡的交互作用,可能是关键性要素,为此本项目在筛选出差异蛋白后,结合蛋白的Pathway通路,从多个蛋白角度出发,试图从整体性层面的失衡来解释左心室肥厚的机制及其药物干预的机制。
4.1 多个差异蛋白参与左心室肥厚的形成
在CGTA组和TMST组之间差异蛋白分析中得到12种上调蛋白,说明予以复方钩藤降压片治疗后12种蛋白表达增加,提示上调蛋白在左心室肥厚形成过程中发挥着重要作用。
血管性血友病因子(von willebrand factor,vWF)是3个主要的止血分子之一[3],主要由内皮细胞合成。血管内皮细胞主要通过释放促凝和抗凝蛋白来调节凝血之间的平衡。vWF水平升高是内皮细胞损伤或激活的标志。内皮细胞受损时,贮存在Weibel-Palade小体中的vWF一部分被释放入血浆中,另一部分则向内皮细胞的基底外侧部排泌,受压力和剪切应力的作用,vWF被大量释放并沉积在血管壁上[4],改变血管结构成分,导致血管壁增厚,内皮依赖的血管舒张功能减弱,血管收缩增强,脉管内血液压力增高[5]。
纤蛋白5(Fibulin-5)是一种细胞外基质糖蛋白,具有维持血管稳定,抑制活性氧簇表达的作用[6-7]。正常情况下,Fibulin-5表达水平较低,在组织缺氧的情况下,Fibulin-5的表达水平会明显升高。Fibulin-5的表达与动脉中内膜厚度增加呈正相关[8]。动物实验发现Fibulin-5广泛分布于血管等富含弹性蛋白的组织,是弹性纤维合成的关键调控蛋白[9]。Fibulin-5基因缺陷的小鼠动脉的弹性纤维排列会发生紊乱、断裂,动脉内膜弹性下降、顺应性丧失、脉压增加,造成靶器官损伤[8]。
半乳凝集素3(Gal-3)是一种参与心肌纤维化的循环标志物,它参与调节细胞生长,抗凋亡,参与血管形成及炎症反应等生物学功能[10]。血清Gal-3水平与心肌纤维化呈显著正相关,是与心肌重构相关的新兴标志物[11]。Gal-3能够刺激纤维母细胞活化,促进心脏肥大细胞、巨噬细胞的浸润,导致血管周围及心肌纤维化,引起心肌肥厚[12]。
磷酸化是蛋白常见的翻译后修饰之一,大多数磷酸化修饰都发生在丝氨酸/苏氨酸位点上。丝氨酸/ 苏氨酸蛋白磷酸酶(PPP2R1)可以被划分为4 大类,包括 PP1、PP2A、PP2B 和 PP2C[13]。丝氨酸/苏氨酸蛋白磷酸酶能够通过调节底物蛋白的磷酸化水平调节整个细胞周期,是细胞周期中负向调节的酶,在细胞的增殖与分化过程中起着重要的作用,其表达或活性异常均可以引起细胞的生物学行为的改变。因此,丝氨酸/苏氨酸蛋白磷酸酶被认为是调节心血管疾病的新靶点[14]。
肌球蛋白调节轻链2 (MYL2)是心肌粗肌丝的主要成分,在心脏的发育与功能方面扮演着重要角色[15]。MYL2主要是通过磷酸化使肌球蛋白与肌动蛋白间的结合力增强,进而调节心肌的收缩功能[16]。MYL2磷酸化减弱将会降低Ca2+敏感性,使得肌钙蛋白无法结合Ca2+被激活,降低了与肌球蛋白结合的几率,从而导致收缩力下降。因此,MYL2磷酸化降低可影响肌球蛋白的结构和功能,影响心肌的收缩力[15]。国外有报道MYL2基因突变与肥厚型心肌病有关,其突变可影响粗肌丝的结构和功能,诱发心肌肥厚,进而导致肥厚型心肌病甚至慢性心力衰竭的发生[17]。
α2-抗纤溶酶(α2-AP)是血浆中主要抗纤溶物质。α2-AP抑制以丝氨酸为活性中心的蛋白酶,如活化的凝血因子X,XI,XII,纤溶系统及激肽系统的蛋白酶。肝脏受损时α2-AP合成减少,纤溶酶的活性会增强[18]。α2-AP表达下调会影响肝纤维化的发生,而心室肥厚也存在心肌纤维化,因此推断α2-抗纤溶酶也可能通过抑制表达导致左心室肥厚的发生[1]。
肝素辅助因子2(HCⅡ)是丝氨酸蛋白酶抑制剂超家族之一,属于生理性抗凝系统的一种新成分。当血管内皮发生损伤时,血浆HCⅡ即可以通过诱导凝血酶与HCⅡ形成复合物,从而使得凝血酶失去了蛋白水解酶的活性。当合并有PC, AT缺乏及凝血因子V等其他危险因素存在时,HCⅡ的缺乏对血栓病的发生可能起到进一步促进的作用[19]。血栓形成,脉管狭窄,血管内压力增高,促使高血压的发生,进而导致心室肌代偿性肥厚。
S期激酶相关蛋白1(Skp1)是普遍存在于真核生物中的一种蛋白质,在真核生物的细胞周期、转录调控、信号传导等细胞进程中发挥关键作用[20]。Skpl可与不同种类蛋白形成复合体,作为多种生物功能的交叉点和限速因子,完成对代谢过程的调控[21]。S期激酶相关蛋白1水平的增高有可能激活萎缩信号通路,降解蛋白质,逆转肥厚心肌的产生。
通过string进行蛋白质相互作用分析,共发现11个节点(nodes)和6条边(edges)。
其中肌球蛋白11(myosin-11)与肌球蛋白调节轻链RLC-A(Myosin regulatory light chain RLC-A)之间关系最为密切。
心肌肌球蛋白是心肌的重要结构蛋白和收缩蛋白,是心肌肌原纤维的主要成分,由重链和轻链组成,具有ATP酶活性。肌球蛋白11是目前已知的以肌球蛋白为基础的运动速度最快的顺行性肌动蛋白,具有显著的ATP酶活性高的特点[22]。肌球蛋白11的长C末端呈α-螺旋体,α-螺旋体在ATP水解时会有结构的变化,已有研究表明肌球蛋白11与动脉内皮损伤的形成有关。精氨酸是肌球蛋白α-螺旋体的一部分,当MYH-11精氨酸的基因发生突变时,就会导致C末端螺旋结构的断裂,引起动脉内层结构紊乱变形,血管顺应性降低[23]。临床研究表明动脉结构紊乱发生动脉夹层的患者可能会导致主动脉瓣关闭不全,心室负荷压力过大,引起左心室肥厚[24]。肌球蛋白调节轻链RLC-A与肌球蛋白11都属于肌球蛋白超级大家族中的蛋白质,其功能多样化,主要是通过催化ATP水解将释放出来的化学能转化为推动肌动蛋白移动的机械能,为肌肉收缩提供动力[25]。肌球蛋白11与肌球蛋白调节轻链RLC-A功能失调在心肌肥厚的发生过程中起重要作用,其磷酸化水平降低可影响肌球蛋白的结构和功能,影响心肌的收缩力,诱发心肌肥厚。
4.2 复方钩藤降压片通过调节通路,干预高血压左心室肥厚的形成
Pathway分析的结果显示,补体和凝血级联、紧密连接通路以及TGF-β信号通路都存在蛋白富集现象,其中涉及差异蛋白数量最多的是补体和凝血级联、紧密连接通路。复方钩藤降压片由钩藤、麦冬和川芎等组成,具有滋阴潜阳、活血通络的功效,大量研究表明复方钩藤降压片在治疗高血压左心室肥厚疗效显著[26]。主要表现在缓解炎症反应,减轻过氧化刺激,抗血小板聚集,减慢心肌纤维化进程,降低血压缓解心室重构等方面。
补体和凝血级联通路属于一种内源性代谢级联[27]。补体系统是血浆中的蛋白水解级联和先天免疫的介质,是针对病原体的非特异性防御机制。补体激活的主要后果是病原体的调理作用,激活后的补体可以调节吞噬细胞和免疫细胞并增强炎症反应[28]。血液凝固是另一系列酶原-丝氨酸蛋白酶转化,最终形成凝血酶。凝血酶是负责将可溶性纤维蛋白原转化为不溶性纤维蛋白凝块的酶,它可以直接作用到凝血过程的最后一步,使血液成凝胶状,失去流动性,从而形成血栓[29]。自发性高血压的患者由于血流生物力学等刺激存在低水平的炎症反应,慢性炎症反应与心室重构病理改变密切相关[26]。复方钩藤降压片以其降血压及抗炎作用而具有靶器官保护优势,成为心血管疾病研究领域的热点[30]。方中钩藤主要依靠钩藤碱和异钩藤碱发挥药效,有着抗血小板聚集、降压、舒张血管、抑制血管平滑肌细胞增殖、保护心肌细胞的作用[5]。现代药理学分析发现,麦冬主要成分为甾体皂苷类。动物实验研究表明,麦冬可以显著提高大鼠对缺氧的耐受力,抑制血栓形成,增强心肌收缩力,改善左心室功能[5]。
紧密连接是肠道机械屏障的重要组成部分,在调节肠黏膜通透性和维持上皮细胞极性中发挥着重要作用,与肠上皮细胞共同构成肠道的选择性屏障[31]。既往研究表明,肠道菌群能将膳食纤维降解成短链脂肪酸(SCFAs),经肠道吸收进入血液循环,作用于心脏等器官,使血压下降[32]。维持肠道微生态平衡可能成为高血压防治的潜在靶点。近年来研究发现中医药对肠道紧密连接蛋白具有一定调控作用,以健脾、理气及清热类方药频率最高[33],而本研究中的复方钩藤降压片包含菊花、石决明、夏枯草、葛根、桑寄生、女贞子等滋阴清热的药,契合了紧密连接通路在肠道系统中发挥屏障作用的机制。中医药作用于紧密连接通路,为通过调节肠道微生态来调节血压提供了新途径,同时也符合“心与小肠相表里”中医理论。
TGF-β信号通路在机体内具有调节细胞功能,如增殖、凋亡、分化和迁移的作用[34]。TGF-β1是转化生长因子β超家族的一员,在心脏纤维化形成的过程中扮演着重要的角色。TGF-β1/ Smads通路主要作用于上皮细胞、内皮细胞、成纤维细胞等不同的细胞,调控不同的机制,促使细胞进入纤维化进程,转变为肌成纤维细胞[35]。有学者[36]在实验研究中以益气活血的中药复方治疗皮肤纤维化小鼠的成纤维细胞,结果显示益气活血汤通过作用于TGF-β1通路能够有效地减少胶原蛋白的产生,治疗纤维化。这在一定程度上提示益气活血法可通过干预TGF-β1/Smads通路,减轻胶原积聚和心室肥大。复方钩藤降压片中的川芎性温,味辛,具有活血行气的功效,主要化学成分为挥发油类物质,能舒张血管平滑肌,降低血压,扩张冠状动脉,同时川芎素水煎剂具有抑制炎性因子表达从而达到抗炎抗增殖的作用,可改善心肌的血氧供应,降低心肌肥大的程度[37]。
5 结论
众所周知,替米沙坦是降低血压,逆转左心室肥厚较理想的药物[38]。本实验以替米沙坦为阳性对照药物,提取心肌组织作定量分析,通过Pathway富集分析筛选出补体凝血级反应、紧密连接、TGF-β三条与之相关的信号通路以及富集于三条通路中的12个差异蛋白。通过对以上相关通路和变化蛋白质生物机制的研判,可认为左心室肥厚发生涉及心肌细胞增殖增生、血管内皮损伤、炎症刺激、血栓形成等多种生物学过程[1]。同时复方钩藤降压片中的药物成分可通过降低血压、减轻过氧化刺激和调节肠道微生态平衡等方面干预左心室肥厚的产生,这为临床上治疗自发性高血压导致的左心室肥厚及未病先防提供了新的思路与方法。

