降钙素原水平鉴别血流感染的研究
(大理州人民医院检验科,大理 671000)
血流感染是临床上较严重的感染性疾病,血培养则是诊断血流感染的重要依据,但研究报道显示血培养的阳性率处于较低的水平[1-2],而且培养周期长,采血时易受到皮肤表面菌群的污染[3]。而血清PCT具有检测快速、较高的敏感度和特异度等优点,近年来已作为诊断细菌感染的一个重要标志物[4-5],但是否可作为血流感染的检测手段,仍有不同争议[6-7]。为探讨PCT水平鉴别血流感染的价值,笔者收集了相关资料进行研究。
1 材料与方法
1.1 临床资料收集
2016年—2018年血培养分离出单一菌株(同一患者在一次住院期间多次分离出同一株菌的只取第一次结果)、在采集血培养的同时检测了血清PCT的患者资料;结合血流感染相关诊断标准[8]以及双套血培养单瓶报阳为污染菌[9-10]的标准确定血流感染病原菌及污染菌,并分为感染组及污染组;同时收集2018年血培养为阴性、在采集血培养的同时检测了血清PCT的患者资料作为阴性对照组(同一患者在一次住院期间只取第一次结果);标本采集时间需在本院使用抗生素之前;去除48h内新生儿、大手术后、严重创伤、烧伤、甲状腺C细胞癌、小细胞肺癌及支气管肺癌患者。
1.2 仪器与试剂采用
BacT/Alert 3D血培养仪及配套血培养瓶进行血培养、Vitek 2 Compact型细菌鉴定药敏分析仪及配套鉴定卡进行质控及菌株鉴定、法国生物梅里埃公司VIDAS全自动荧光定量分析仪与配套原装试剂盒进行PCT校准、质控及样本检测。
1.3 统计学分析采用
SPSS17.0统计软件进行数据统计分析。各组计量资料数据先进行正态分布检验,符合正态分布的以均数±标准差(x±s)表示,再采用单因素方差分析比较;不符合正态分布的采用中位数(M)及四分位数间距(QL-QU)表示集中趋势和离散趋势,组间比较采用非参数检验的两个独立样本检验;性别比较采用交叉表的卡方检验;以P<0.05为差异有统计学意义;感染组与阴性组进行ROC曲线分析,根据曲线下面积确定最佳诊断阈值。
2 结果
2.1 感染组基本资料
按标准共收集到血培养阳性单一菌株701株,确定为血流感染病原菌的共495株,包括革兰阴性菌338株(68.28%)、革兰阳性菌129株(26.06%)及真菌28株(5.66%)。革兰阴性菌具体菌种为大肠埃希菌211株(42.63%)、肺炎克雷伯菌40株(8.08%)、鲍曼不动杆菌17株(3.43%)、马尔他布鲁菌13株(2.63%)、沙门菌群10株(2.02%)、阴沟肠杆菌复合群9株(1.82%)、铜绿假单胞菌7株(1.41%)及其它革兰阴性菌31株(6.26%)。革兰阳性菌具体菌种为金黄色葡萄球菌29株(5.86%)、棒状杆菌属(非白喉棒状杆菌)20株(4.04%)、表皮葡萄球菌16株(3.23%)、草绿色链球菌群15株(3.03%)、屎肠球菌8株(1.62%)、人葡萄球菌人亚种8株(1.62%)、肺炎链球菌7株(1.41%)及其它革兰阳性菌26株(5.25%)。真菌具体菌种为马尔尼菲青霉菌13株(2.63%)、新型隐球菌5株(1.01%)、光滑假丝酵母菌3株(0.61%)、近平滑假丝酵母菌3株(0.61%)及其它真菌4株(0.81%)。感染组男性268例,女性227例;年龄54.58±17.55岁;PCT中位数5.83(0.89~42.93)ng/mL。
2.2 污染组基本资料
701株菌中确定为污染菌的共206株,在此次血培养阳性标本中的比率为29.39%。污染菌以凝固酶阴性葡萄球菌为主,具体菌种为凝固酶阴性葡萄球菌157株(76.21%)、棒状杆菌属(非白喉棒状杆菌)15株(7.28%)、藤黄/里拉微球菌13株(6.31%)、芽孢杆菌属7株(3.40%)、草绿色链球菌群5株(2.43%)、需氧生长革兰阳性杆菌属5株(2.43%)、鹑鸡肠球菌1株(0.49%)、嗜麦芽糖寡养单胞菌1株(0.49%)、鲍曼不动杆菌1株(0.49%)及非发酵革兰阴性杆菌属1株(0.49%)。污染组男性127例,女性79例;年龄53.08±19.43岁;PCT中位数0.27(0.08~1.39)ng/mL。
2.3 阴性组基本资料
阴性组男性1309例,女性919例;年龄54.70±18.30岁;PCT中位数0.22(0.05~1.05)ng/mL。
2.4 三组资料对比分析
结果三组资料的性别及年龄两两比较差异无统计学意义。PCT水平感染组分别与阴性组及污染组比较差异有统计学意义(P<0.05),阴性组与污染组比较差异无统计学意义(P>0.05)。血清PCT阈值为1.37ng/mL时鉴别血流感染与血培养阴性的尤登指数最大,ROC曲线下面积0.82,敏感度70.50%,特异度78.90%,95%可信区间(0.80,0.84),阳性预测值42.61%,阴性预测值92.33%。ROC曲线见图1。不同PCT阈值鉴别血流感染的比较见表1。
3 讨论
本次研究血流感染病原菌以大肠埃希菌占主导地位,其次是肺炎克雷伯菌及金黄色葡萄球菌,与文献报道[1-2]相似。血培养污染菌中以凝固酶阴性葡萄球菌占主导地位,其次是棒状杆菌属(非白喉棒状杆菌),与文献报道[11]一致。结合血流感染相关诊断标准以及双套血培养单瓶报阳为污染菌的标准,提示血流感染中凝固酶阴性葡萄球菌及棒状杆菌属(非白喉棒状杆菌)引起的血流感染也占一定比率,故当血培养检出这些菌种时,一定要结合临床及相关检查结果综合判断。
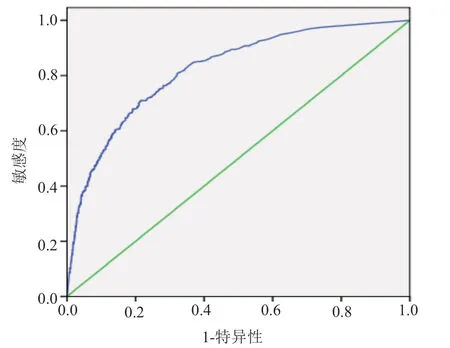
图1 血流感染组与血培养阴性组PCT水平的ROC曲线

表1 不同PCT阈值鉴别血流感染的比较
血流感染是临床上较严重的感染性疾病,研究报道显示血流感染的发生率在不断上升[12-13]。对于血流感染的诊断,临床也急需快速准确的诊断方法。PCT是无激素活性的降钙素前肽物质,正常生理情况下健康人体PCT水平极低,且体内水平稳定。研究[14]表明在细菌感染时,PCT表达明显增多,而在病毒感染、排斥反应、免疫相关性疾病、肿瘤疾病时表达并不高。Christ-Crain等[15]研究认为细菌感染的患者往往PCT>0.5ng/mL,而真菌及其它感染时,PCT<0.5ng/mL,通过PCT检测制定抗生素使用方案使其应用更加合理。PCT应用于血流感染方面的研究,王露霞等[6]认为PCT水平必须结合临床情况进行判读,应避免脱离患者具体病情而进行分析,并应考虑假阳性和假阴性的可能性。Arai等研究认为临床常用生物标志物很难预测血培养结果[17],但PCT与血培养结果有密切关系。本研究发现血流感染组PCT水平分别与阴性组及污染组比较差异有统计学意义,PCT中位数感染组的5.83(0.89~42.93)ng/mL显著高于阴性组的0.22(0.05~1.05)ng/mL,故认为血流感染时PCT水平是显著升高的,而阴性组与污染组比较差异无统计学意义,所以可结合PCT水平初步鉴别血流感染菌或污染菌。本研究中当血清PCT阈值为1.37ng/mL时鉴别血流感染与血培养阴性的尤登指数最大,ROC曲线下面积0.82,敏感度70.50%,特异度78.90%,95%可信区间(0.80,0.84),说明以此阈值鉴别血流感染有一定准确性。刘厚强等[18]认为PCT最佳阈值为1.25ng/mL时的ROC曲线下面积为0.77,敏感度61.90%,特异度68.70%,另有研究[19]认为PCT最佳阈值为0.7ng/mL时ROC曲线下面积为0.86,敏感度与特异度分别为76%、86%,与本研究结果存在一定差异。这可能与研究时入组的条件、病例的数量、PCT的检测方法及线性范围、病人感染程度等有关系。
通过不同PCT阈值鉴别血流感染的比较发现,PCT阈值从0.05逐渐升高至10.07ng/mL时,其阳性预测值为22.42%~58.49%,阴性预测值为97.89%~88.42%,阳性预测值虽在升高,但仍未达到很高的水平,特异度却可升高至92.9%,相反阴性预测值虽下降,却都处于很高的水平。王露霞等[6]认为血培养采血不规范、患者局部感染未导致血源散播或非感染因素诱导的PCT升高是导致PCT对血培养阳性预测值偏低的主要原因。PCT阈值接近正常时,阴性预测值可达到97.89%,所以有研究[6]认为极低的PCT水平可用于排除血流感染,但仍有少数病例发生血流感染时PCT并未升高,遇到这类病例时结合临床及血培养结果更为重要。随着PCT阈值的增高,可获得很高的特异度,提示临床排除非感染因素后,应高度怀疑血流感染,可在恰当的采集时机增加血培养采集套数提高血培养检出率。
综上所述,笔者认为PCT水平在鉴别血流感染方面有一定的准确性,可作为初步鉴别血流感染或血培养污染的方法,但也要结合临床及血培养结果综合判定。

