CYP3A4和CYP1A2及CYP2E1快速免疫印迹检测方法的建立*
何俊奇, 杨畅, 陆定艳, 李靖, 刘欢, 王永林, 刘亭**
(1.贵州医科大学 贵州省药物制剂重点实验室 & 省部共建药用植物功效与利用国家重点实验室, 贵州 贵阳 550004; 2.贵州医科大学 药学院, 贵州 贵阳 550025)
细胞色素P450酶(cytochrome P450,CYP450),又称混合功能氧化酶(mixed function oxidase)和单加氧酶(monooxygenase),是人体的主要药物代谢酶之一,参与了超过90%的药物代谢过程,主要存在于肝组织中[1-3]。CYP450包括多种酶,如CYP3A4、CYP1A2、CYP2E1、CYP2C11、CYP2D6及CYP2C19等,其中CYP3A4、CYP1A2及CYP2E1作为最为重要的几种药物代谢酶,对其蛋白表达情况的检测更是在药物代谢研究中作为非常常见的检测步骤[4-6]。免疫印迹法(Western blot)作为蛋白检测中的定性与半定量方法,在蛋白表达的检测过程中最为常见[7],其原理就是将总蛋白按照分子量的大小进行凝胶电泳分离,然后将目的蛋白转移到比如聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)或者碳酸纤维素膜(notrocelluose filter membrane,NC)上,然后用特异性的抗原与其结合,从而对蛋白的表达进行检测研究[8-10]。CYP450的Western blot检测时间较长,一般需要12 h以上[11-12]。因此本文对Western blot实验中最耗时的“封闭和抗体孵育”步骤加以优化,以期提高检测效率。此外,CYP3A4、CYP1A2及CYP2E1大多在肝脏高表达,如富含于肝脏匀浆、S9及肝微粒体,也是代谢实验中常见的检测样品。HepG2细胞是目前常用的药物吸收、分布、代谢、排泄(absorption,distribution,metabolism and excretion of drugs,ADME)模型细胞,监测细胞中CYP450的表达水平,可推测其在体内的代谢机理[13-16]。美国Millipore公司的SNAP i.d.2.0 Western blot快速孵育仪是一种利用真空抽压的方式加速蛋白抗原抗体结合的仪器,能够有效缩短抗体的孵育时间[17]。因此,本文选择了HepG2细胞总蛋白、大鼠肝脏匀浆、S9及肝微粒体等代表性样品,选用Western blot快速孵育仪来建立CYP3A4、CYP1A2和CYP2E1快速免疫印迹检测方法。
1 材料与方法
1.1 材料
1.1.1实验动物及细胞 6只SPF级健康Sprague-Dawley雄性大鼠,体质量200~250 g,购自长沙天勤生物技术有限公司。人肝癌细胞HepG2购于上海中乔新舟生物科技有限公司。
1.1.2主要试剂 十二烷基硫酸钠聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophresis,SDS-PAGE)制备试剂盒、磷酸盐缓冲溶液(phosphate buffer saline,PBS)、三羟甲基氨基甲烷(Tris)、甘氨酸、牛血清白蛋白、吐温-20、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(北京索莱宝),改良杜氏伊格尔培养基(dulbecco’s modified eagle medium,DMEM)、胎牛血清(美国Thermo),SDS-PAGE免染胶制备试剂盒(美国Bio-rad),兔抗CYP3A4抗体、兔抗CYP2E1抗体、鼠抗CYP1A2抗体、辣根过氧化氢酶标记的山羊抗兔抗体及山羊抗小鼠(英国Abcam),预染蛋白marker(上海优宁维),放射免疫沉淀试验(radio immunoprecipitation assay,RIPA)裂解液、超敏化学发光(enhanced chemiluminescence,ECL)试剂盒(上海碧云天)。
1.1.3主要仪器 SNAP i.d. 2.0 Western blot快速孵育仪(美国Millipore),Trans-Blot Turbo蛋白快速转膜仪、Mini-PROTEAN Tetra C型垂直电泳槽及PowerPac Basic型电泳仪(美国Bio-rad),fresco 17冷冻高速离心机(美国Thermo),Syngene G:BOX凝胶成像系统(英国Syngene)。
1.2 方法
1.2.1HepG2细胞样品总蛋白的制备 人肝癌细胞HepG2用含10%胎牛血清的DMEM培养基,于37 ℃的5%CO2培养箱中培养。取细胞汇合度约90%的HepG2细胞,倒掉培养液,加4 ℃预冷的PBS磷酸盐缓冲液3 mL洗涤细胞,弃洗液,重复洗涤2次。置于冰上加裂解液800 μL裂解,裂解完毕后将细胞液移入1.5 mL离心管中,涡混30 s,置于冰上反应5~10 min,12 000 r/min离心10 min(离心机提前预冷至4 ℃),取上清液根据BCA试剂盒测定蛋白浓度后-20 ℃冷藏备用。
1.2.2大鼠肝组织匀浆蛋白、S9及微粒体的制备 大鼠喂养7 d脱颈处死,取肝脏浸泡于0.25 mol/L蔗糖溶液,洗去多余的血后于离心管中剪碎,加蔗糖溶液500 μL匀浆,再加蔗糖溶液补齐至4 mL,混匀后得大鼠肝组织匀浆蛋白样品;取制备好的大鼠肝组织匀浆蛋白,9 000 r/min离心15 min(离心机提前预冷至4 ℃),取上清液19 000 r/min离心20 min,取上清即得大鼠肝S9样品;取制备好的的大鼠肝组织匀浆蛋白,于9 000 r/min离心15 min(离心机提前预冷至4 ℃),取上清液16 000 r/min离心30 min,重复操作1次,上清液按1 mL加88 mmol/L CaCl20.1 mL 混合置于冰上静止5 min(静置振摇1次/min),16 000 r/min离心60 min,弃上清液,0.1 mol/L pH 7.4的Tris溶液洗涤沉淀,加Tris缓冲液5 mL重新混悬,即得大鼠肝微粒体。所有样品-20 ℃冷藏备用。
1.2.3蛋白浓度测定 分别取待测蛋白样品10 μL,标准品0 、2 、4 、6 、8 、12 、16 及20 μL加到96孔板中,PBS稀释液补至20 μL,各检测3个复孔;各孔加 BCA工作液200 μL,37 ℃静置反应30 min;酶标仪监测在562 nm处的吸光度,根据标准曲线和使用的样品体积计算样品的蛋白浓度。
1.2.4Western blot检测 (1)以CYP3A4为对象,优化摇床封闭孵育条件,制备10%的SDS-PAGE常规凝胶和免染胶。取30 μg蛋白样品与预染Marker上样,80 V恒压20 min,电压调至120 V,继续电泳70 min;电泳结束后,由下往上按照滤纸、PVDF膜、胶及滤纸的顺利搭建转膜“三明治”,并置于快速转膜仪中转膜;转膜结束后,封闭孵育及分组见表1。(2)优化CYP3A4、CYP1A2及CYP2E1的Western blot快速孵育仪封闭孵育条件:制备10%的SDS-PAGE常规凝胶,同前述进行电泳分离,快速转膜仪转膜30 min,封闭孵育及分组见表2。抗体孵育完毕后,在PVDF膜上加 ECL发光混合液1 mL,室温反应1 min后放入凝胶成像仪器成像。
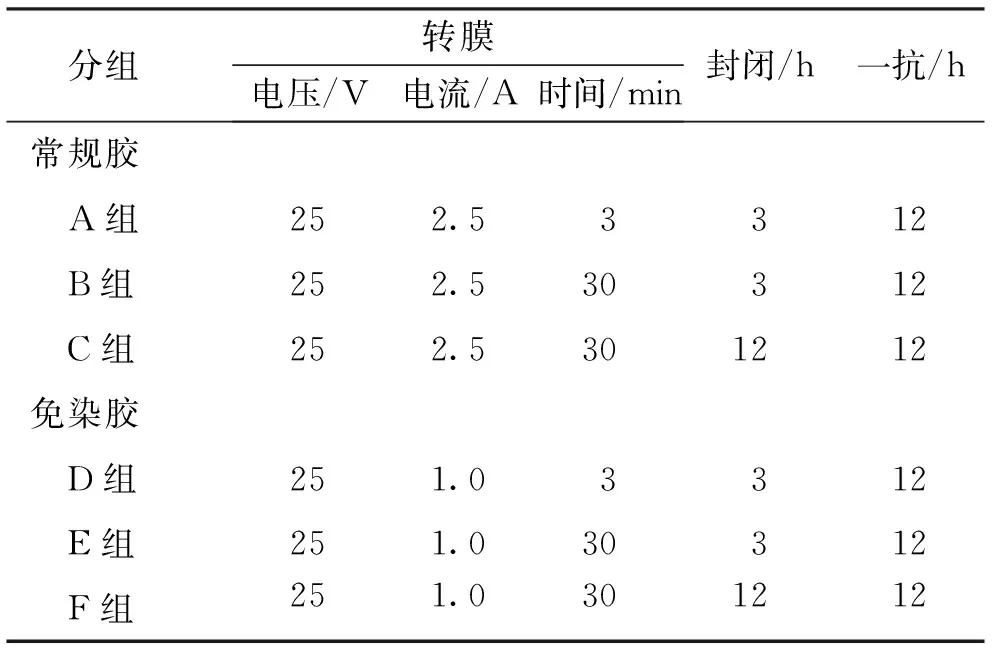
表1 摇床封闭孵育CYP3A4检测条件Tab.1 CYP3A4 detection conditions of shaking incubation
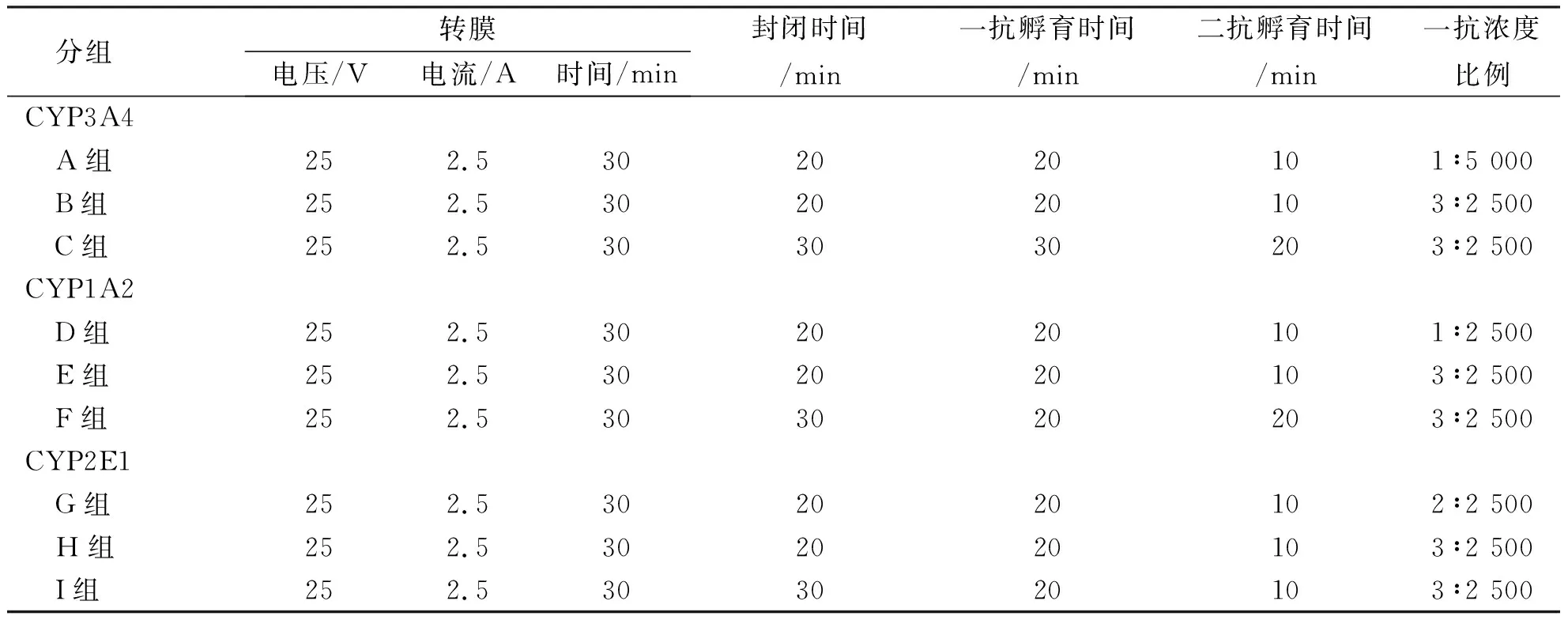
表2 Western blot快速孵育仪孵育CYP3A4、CYP1A2及CYP2E1检测条件Tab.2 CYP3A4, CYP1A2 and CYP2E1detection conditions of Western blot rapid incubator
1.3 统计学分析
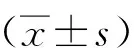
2 结果
2.1 CYP3A4摇床封闭孵育检测条件优化
Western blot结果显示,与A、B、D、E、F组相比,C组的检测结果背景干净且条带表达均一;HepG2样品检测中,C组检测灵敏度高于A、B、D、E及F组(P>0.05);组织匀浆样品检测中,C组检测灵敏度高于A、B、E及F组(P<0.05或P<0.01),条带均一性高于A、B组;S9样品检测中,C组检测灵敏度高于A、B、D及E组(P<0.05或P<0.01),条带均一性高于A、B组;肝微粒体样品的检测中,C组检测灵敏度高于A、B、D、E及F组(P<0.05或P<0.01),条带均一性高于A、B组。见图1。

注:与B组比较,(1)P<0.05,(2)P<0.01,(3)P<0.001。图1 不同条件下CYP3A4蛋白的检测结果Fig.1 CYP3A4 detection results under different conditions
2.2 CYP3A4、1A2及2E1 Western blot快速孵育仪孵育检测条件的优化
选择2.1中优化的电泳条件对样品蛋白进行分离、转膜后,用Western blot快速孵育仪进行封闭和抗体孵育条件的筛选。CYP3A4结果显示,HepG2、组织匀浆及S9样品检测中C组检测灵敏度均高于A、B组(P<0.05或P<0.01),肝微粒体样品检测中C组检测灵敏度高于B组(P<0.001),且上述4种样品中C组背景均较A、B组干净;CYP1A2结果显示,HepG2、组织匀浆和S9样品中,F组检测灵敏度与D、E组比较差异无统计学意义(P>0.05),肝微粒体中F组检测灵敏度低于D组(P<0.05),但F组条带均一性均高于D、E组、且背景也较D、E组干净;CYP2E1结果显示,HepG2样品检测中I组检测灵敏度高于与G、H组、但差异无统计学意义(P>0.05),组织匀浆样品检测中I组检测灵敏度高于G组(P<0.01),S9样品检测中I组检测灵敏度高于G、H组(P<0.01),肝微粒体样品的检测中I组检测灵敏度高于G组(P<0.05),且上述4种样品中I组条带均一性及背景均较G、H组干净。见图2。
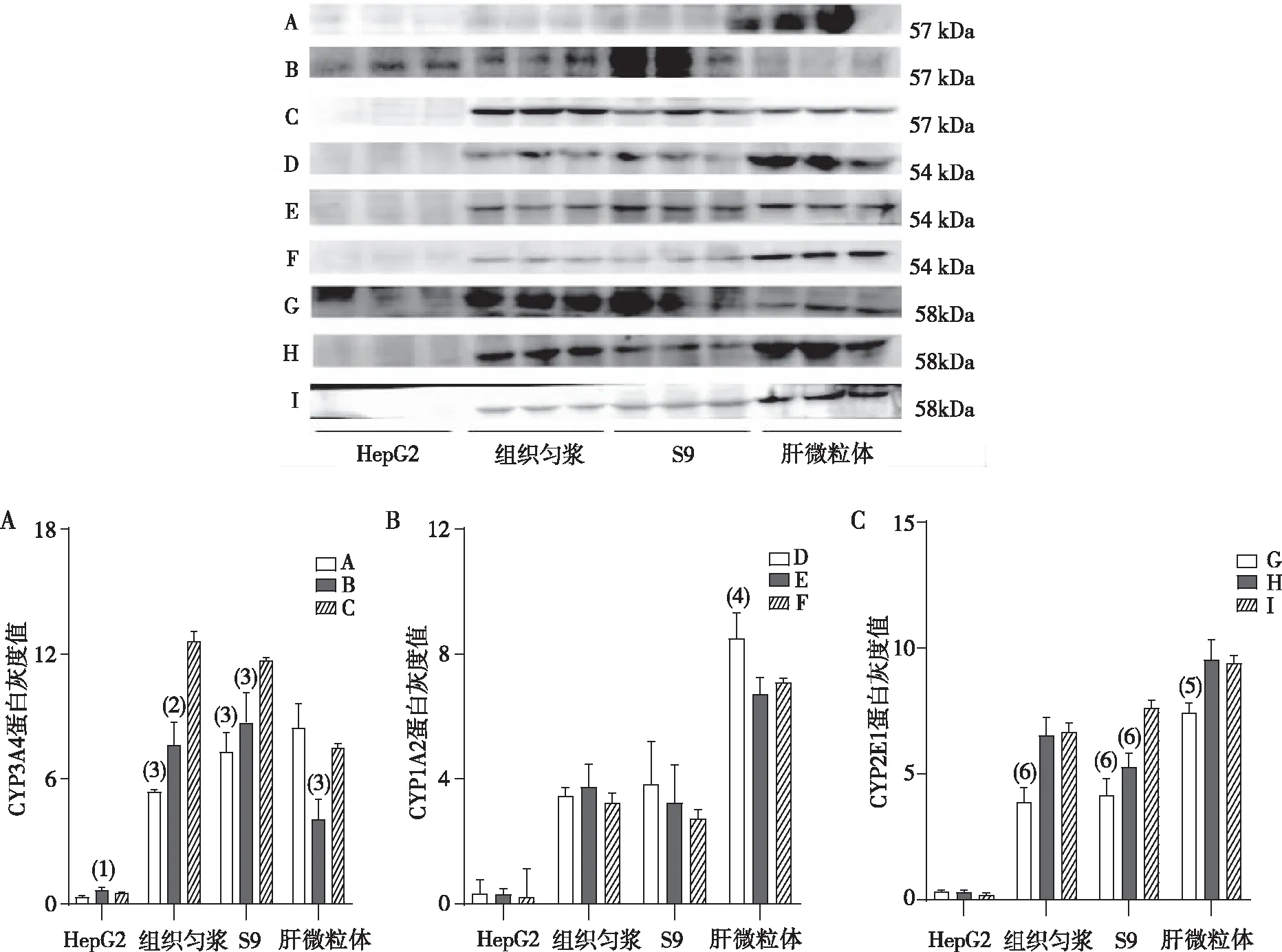
注:与C组比较,(1)P<0.05,(2)P<0.01,(3)P<0.001;与F组比较,(4)P<0.05;与I组比较,(5)P<0.05,(6)P<0.01。图2 不同快速孵育条件下CYP3A4、CYP2E1和CYP1A2蛋白检测结果Fig.2 CYP3A4, CYP2E1 and CYP1A2 detection results under different rapid incubation conditions
3 讨论
Western blot检测作为一种常用的蛋白检测技术,在CYP450蛋白检测中运用非常广泛,但是目前对于该方法的优化中大多是对洗脱时间及曝光时间进行优化,或者通过改变转膜的时间与膜的孔径来提高检测效率,并没有对于孵育方式及时间进行优化的先例[18]。CYP3A4、CYP1A2及CYP2E1作为CYP蛋白家族中的重要成员,也是实验中对于药物代谢较为常见的CYP450酶[19],因此本文选择其作为检测的对象[20-22],建立CYP3A4、CYP1A2及CYP2E1快速Western blot检测方法。
本研究以CYP3A4为检测对象,使用HepG2细胞总蛋白,大鼠肝组织的匀浆、S9及肝微粒体等样品,对Western blot中分离胶类型、转膜电压与时间、封闭时间及抗体孵育时间等常规条件进行对比,筛选出了较为优化的检测条件。结果表明使用常规的SDS-PAGE凝胶和快速转膜30 min便可达到较好的分离和转膜效果。因此,在以Western blot快速孵育仪进行快速检测条件优化时,选用了较为经济的常规SDS-PAGE凝胶进行电泳分离,并采用了30 min快速转膜条件。对快速封闭孵育条件优化实验的结果表明,CYP3A4最佳快速检测条件是一抗(3 ∶2 500)快速孵育仪孵育30 min,二抗孵育20 min;CYP2E1最佳快速检测条件是快速孵育仪封闭30 min、一抗(3 ∶2 500)孵育20 min、二抗孵育10 min;CYP1A2蛋白快速检测条件是以快速孵育仪封闭30 min、一抗(3 ∶2 500)孵育20 min、二抗孵育20 min。
在Western blot条带图中,可以明显看到CYP3A4、CYP1A2及CYP2E1在微粒体中的丰度高于S9和匀浆中的量,这是因为大多数CYP酶存在于微粒体膜上[23-25];而在HepG2组中,CYP3A4、CYP1A2和CYP2E1蛋白条带的信号较弱,这与HepG2细胞中这3种CYP酶表达量极低相关[26]。说明实验结果符合理论预期,也从侧面证明了本文开发的方法的可靠性。
综上所述,本文首先以CYP3A4为例,优化其常规Western blot检测的孵育方式,然后再利用Western blot快速孵育仪对CYP3A4、CYP1A2和CYP2E1的孵育方式进行了优化。对比摇床孵育结果可以看出,优化的Western blot快速孵育条件在条带一致性和背景等检测效果上与常规摇床孵育的方式差异不大,但是极大缩短了检测时间(12 h缩短至1 h),提升了实验效率。

