电针对膝骨关节炎软骨细胞中AQP3表达影响*
虞记华,李月霞,陈 波,张 驰,胥方元△
(1.西南医科大学附属医院,四川 泸州 646000; 2.西南医科大学,四川 泸州 646000)
骨关节炎(Osteoarthritis,OA)是一类以病程长、病情反复为特点的临床最常见的慢性退行性关节疾病[1],是老年人致残主要原因之一[2]。目前,OA发病机制尚未完全清楚,现普遍认为在生物性和机械性因素共同作用下,关节软骨合成及分解代谢失去平衡,导致关节软骨细胞凋亡、细胞外基质及软骨下骨退变[3-4]。水通道蛋白(Aquaporins,AQP)是一种跨膜蛋白,对细胞能量平衡和水稳态起着至关重要的作用[5]。其中AQP3主要功能是控制水和甘油、尿素等的小分子运输[6],可以增加细胞膜对水的通透性[7]。关节病变破坏可以上调软骨AQP mRNA表达,促使软骨细胞过度吸水肿胀后破裂、死亡[8]。电针作为一种重要的非药物治疗方法,可有效抑制软骨细胞凋亡,延缓膝骨关节炎进展,临床上被广泛运用[9]。因此,通过检测关节软骨相关因子的表达水平,可以了解OA疾病发展情况及治疗可能的作用机制。本研究电针刺激“血海”“阴陵泉”“犊鼻”“足三里”“阳陵泉”“梁丘”等常用穴位,对3组实验兔关节软骨形态学变化、苏木精-伊红(Hematoxylin-eosin staining,HE)染色及AQP3免疫组织化学(免疫组化)表达量进行统计分析,探索电针治疗在OA中的可能作用机制。现报告如下。
1 材料与方法
1.1 实验动物
5月龄健康新西兰大耳兔36只,雌雄不限,体质量(2.20±0.25)kg,由西南医科大学动物实验中心提供。实验动物使用许可证号为SYXK(川)2013-065。本研究经西南医科大学动物实验伦理审查批准。
1.2 主要实验试剂及仪器
兔抗人AQP3多克隆抗体试剂盒(武汉博士德生物技术有限公司,BA1559);1寸汉医针灸针(北京汉医医疗器械公司);G6805-电针治疗型低频电针治疗仪(苏州医药用品有限公司);BMJ-B病理组织包埋机(中微电子仪器公司,中国常州);LEICA RM-2235切片机(德国LEICA公司);HFsafe 1200/C型生物安全柜(上海力申科学仪器有限公司);TK-218IV型恒温摊片烤片机 (中国泰维医疗科技有限责任公司);DK-8AD 型电热恒温水槽(上海恒科技术有限公司);S Spot M20-35S 型显微成像仪(日本OLYMPUS公司);OLYMPUS CH-20型光学显微镜(日本OLYMPUS公司);LEICA DM-4000B型荧光显微分析系统(德国LEICA公司)。
1.3 实验方法
1.3.1 分组及处理方法 将36只兔分为对照组、模型组及电针组,每组12只。对照组不做干预,笼中正常饲养。采用石膏固定法,将模型组、电针组实验兔的左膝关节伸直位固定6周建立模型。6周后解除石膏固定,模型组兔同电针组相同绑于治疗台20 min,不采取措施。电针组穴位参照《实验针灸学》中“常用实验动物针灸穴位”的相关规定定位选取左下肢血海、阴陵泉、犊鼻、足三里、阳陵泉和梁丘等穴位直刺0.3~0.5 cm进针;治疗选用疏波,频率2 Hz,电流为1~2 mA,20 min/d,治疗14 d[10]。
1.3.2 组织切片制作 实验结束后,对3组实验兔进行以下处理:采用颈椎脱臼法处死所用实验兔;取左股骨内髁软骨制成0.5 cm×0.5 cm×0.5 cm大小标本;甲醛固定;硝酸脱钙;石蜡包埋,切片;切片HE染色;切片AQP3免疫组化。
1.4 检测项目
1.4.1 观察项目 参考Mankin评分标准[11]观察软骨病理切片大体形态及软骨细胞HE染色情况及光学显微镜(光镜)观察免疫组化切片AQP3免疫反应情况。
1.4.2 采用的方法 3组软骨病理切片大体形态及软骨细胞HE染色情况均参考Mankin评分标准从软骨结构、软骨细胞情况、HE染色和潮线完整性等方面评估记录结果。免疫组化切片AQP3免疫反应情况通过观察AQP3反应部位,随机选取每张切片的5个400倍的高倍镜视野,观察细胞质颗粒棕黄着色的阳性细胞。统计每个视野里的阳性细胞数量和细胞总数量,以细胞分数=视野内的阳性细胞数/细胞总数×100%作为AQP3的表达量。每张切片采用2个不同的观察者的计算值均数分别计算阳性细胞数量和细胞总数,从而误差率控制在5%范围以内。
1.5 统计学处理
采用SPSS17.0软件进行统计学分析。定量资料采用均数±标准差表示,3组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1 软骨病理切片大体形态观察
对照组:关节腔见少量透明清澈的关节液,未见明显关节积液,可见蓝白色光滑且明亮的关节软骨,表面无裂纹、无赘生物。模型组:大部分关节腔内明显积液,黏稠、浑浊,软骨偏暗黄甚至米黄色,光泽度较低,表面粗糙,有裂隙、裂纹、糜烂及溃疡形成,关节负重面、软骨下方骨质外漏,骨赘形成,滑膜增生伴粘连。电针组:大部分软骨变薄,稍淡黄色,表面不平整,散在点状充血,偶见糜烂,关节内少量关节积液伴滑膜增生。光泽度、滑膜水肿及关节积液情况电针组介于对照组与模型组之间,电针组与模型组比较(t=3.377,P=0.003),差异具有统计学意义(P<0.01),见表1。
表1 3组实验兔的软骨病理切片大体形态Mankin评分结果比较
2.2 光镜下HE染色结果
对照组:关节软骨表面平整光滑、结构清晰、厚薄均匀,基质着染均匀。软骨细胞大小一致、排列整齐、潮线完整、无簇聚软骨细胞。模型组:软骨表层溃烂甚至缺失,厚度明显变薄,出现较薄的钙化层,基质染色明显减退,核浓缩,细胞数量大量减少,可见大量不规则形状的大胞体软骨细胞簇聚,潮线非常紊乱。电针组:关节软骨表面较规则,略薄、较粗糙,偶见较小裂隙,软骨细胞排列较整齐,数明显增多,饱满、核浓缩,细胞偶见破裂,厚度明显增厚,染色轻度减退,潮线轻度紊乱。见图1。

图1 3组HE染色结果(100×,400×)
电针组关节软骨细胞HE染色软骨结构(t=2.315,P=0.030)、软骨细胞(t=2.236,P=0.035)、HE染色(t=0.56,P=0.048)、潮线完整性(t=2.7,P=0.028)Mankin评分结果与模型组比较,差异均有统计学意义(P<0.05)。见表2。
2.3 光镜下AQP3表达的免疫组化测定
对照组为正常软骨细胞,可见关节软骨细胞质中少量表达的棕黄色AQP3阳性细胞。模型组为退变软骨细胞,可见关节软骨细胞质中大量表达的的棕黄色AQP3阳性细胞,表明AQP3表达明显增强。电针组可见关节软骨细胞质中少量表达的棕黄色AQP3阳性细胞,细胞分数介于对照组和模型组之间见图2。
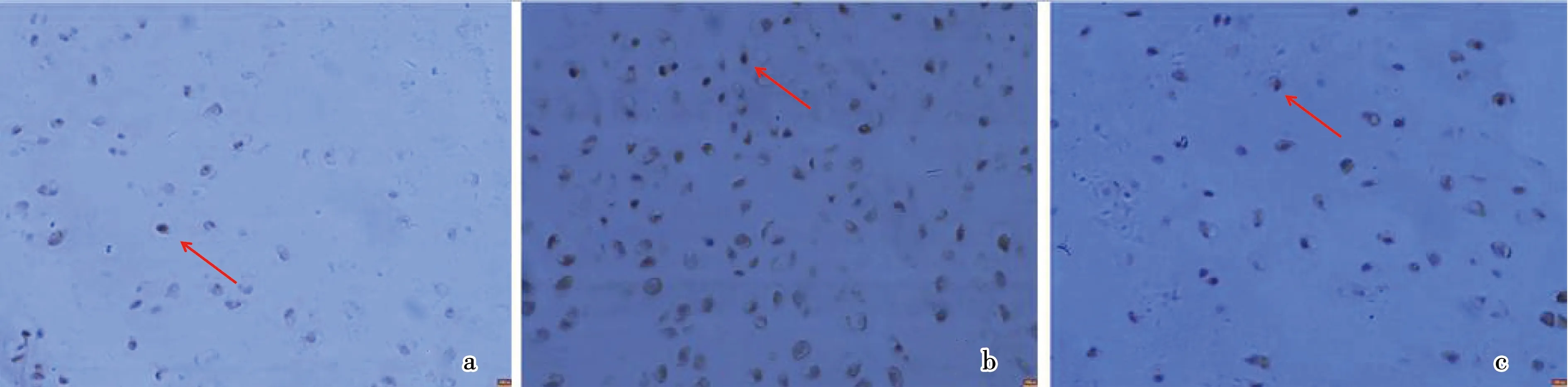
注:a.对照组;b.模型组;c.电针组。图2 3组AQP3染色结果(400×)
表2 3组兔关节软骨细胞HE染色各项Mankin评分结果比较
对照组、模型组和电针组AQP3免疫组化切片阳性细胞百分数组间比较,差异有统计学意义(F=177.70,P<0.01)。电针组与模型组比较进行LSD检验(P<0.01)、对照组与模型组比较(P<0.01),差异均有统计学意义。见表3。
表3 3组实验兔的软骨AQP3免疫组化切片阳性细胞百分数结果比较
3 讨论
OA是一种退行性疾病,严重影响患者的生活质量,加重患者家庭的经济负担[12]。且随着人口老龄化问题日渐突出,OA发病率逐年升高,我国OA的发病率显示女性高于男性,尤其以老年女性患者较为多见[13-14]。因此,探讨其发病原因及发病机制,寻找有效预防及治疗方法尤为重要[15]。
水通道蛋白(Aquaporins,AQP)是由4个亚基组成的跨膜蛋白。每个亚基均含有1个天冬氨酸-脯氨酸-丙氨酸重复串连序列的NPA特征性结构域[16-17]。哺乳动物中已经发现AQP 0~12的13种水通道蛋白[18],在维持细胞能量平衡和水稳态中起着至关重要的作用。AQP3是AQP家族成员,主要功能是控制水和甘油、尿素等的小分子运输,从而增加细胞膜对水的通透性[5-6],其在AQP家族中与关节软骨退行性变性关系最密切[19]。有研究显示,关节病变破坏可以上调软骨AQP mRNA表达,促使软骨细胞过度吸水肿胀后破裂、死亡[7-8]。
正常关节软骨由1%的软骨细胞以及99%的软骨细胞外的基质共同组成。软骨基质除了为软骨细胞提供营养物质,还参与化学反应的底物、传递信号,具有保护软骨细胞的作用。软骨基质由胶原蛋白、蛋白多糖和水组成,正常情况下的软骨基质代谢能维持分解和合成动态平衡。因OA发病过程中软骨基质的分解速度大于合成速度,使得软骨基本结构遭到破坏,结合水丢失,软骨细胞生存的生理环境恶化,AQP3 mRNA高表达,AQP3蛋白增多、活性增强,细胞过度吸水肿胀,最终发生破裂、死亡[20]。有研究表明,低频脉冲超声可以明显抑制AQP3表达,作用机制可能通过改变细胞外基质成分、下调 AQP3 mRNA表达及磷酸化改变AQP3蛋白结构,降低了水跨膜转运,从而减少关节腔积液、减轻周围组织水肿,进而改善OA症状[21]。
通过分析本实验数据模型组关节软骨的病理切片发现大体形态积液明显,关节腔,软骨偏暗黄,光泽度较低、表面粗糙,有裂隙、裂纹、糜烂及溃疡形成,骨赘形成,滑膜增生伴粘连,软骨细胞数明显增多,软骨层明显增厚,潮线轻度紊乱。滑膜等组织出现炎症反应时,会伴有充血、水肿以及炎症介质大量聚集等情况,同时会分泌出多种类型蛋白酶,进而造成软骨代谢发生异常[22-23]。同时软骨基质逐渐分解加剧,关节结构会受到不可逆性损伤,从而表现为相应临床症状,使得 KOA 疾病进展加速[24-25]。电针组关节情况较好,仅出现少量关节内积液与轻度滑膜增生,软骨表面较规则且裂隙少,细胞排列较整齐且AQP3表达减少。因此,可推断电针通过下调AQP3 mRNA表达,降低AQP3含量来调控水的转运,降低了细胞基质的降解,降低了水跨膜转运,减少软骨细胞过度吸水肿胀而发生破裂、死亡,降低关节软骨的破坏,从而保护软骨作用,改善OA症状。
目前治疗国内外尚无特效方法OA,主要以缓解疼痛、改善症状和延缓疾病进展为目的,治疗手段主要有手术和非手术两种。非手术疗法包括西医、中医和中西结合等。而非手术治疗中,电针为中西结合治疗方法,因其疗效确切,治疗安全方便、副作用少等特点,因而具有较强的基础、临床研究价值。同时,本研究也具有一定的局限性:①电针在治疗频率、剂量、时间和波型等尚未有统一标准,参数主要来源于OA动物实验研究数据;②实验中“得气”无法定量,较难精准掌握;③有研究发现,OA发病早期软骨中AQP3蛋白表达主要在软骨上中部及增生区,晚期则在软骨中下部,与正常软骨存在差异,本实验的实验时间较短,仅采用关节晚期的实验数据,无法对整个OA发展过程进行研究。因此,由于OA发病过程中,AQP3蛋白表达存在早中晚期差异,需在后续加大样本量的同时,进一步开展电针在OA不同时期AQP3蛋白表达的研究。同时,OA的发展受到多重因素影响,AQP3作为其中一个调节机制,与其他的调节机制共同作用关系,其上游调控途径尚未明确,尚需进一步研究。
综上所述,电针能够下调关节炎软骨中AQP3蛋白表达,有效缓解膝OA的症状,是一种值得推广的治疗手段。

