地中海贫血患者血浆环状RNA的筛查及结果分析
周献青,张岳,林华,薛雯,陈洁晶,欧明林
中国人民解放军联勤保障部队第九二四医院检验科广西代谢性疾病研究重点实验室,广西 桂林 541002
地中海贫血(thalassmeia,简称地贫)是因珠蛋白基因缺陷导致血红蛋白中相应珠蛋白肽链合成缺失或不足,最终引起溶血性贫血等病理状态[1]。据资料显示,地贫在广西人群中有较高发病率[2],严重威胁人类健康。
环状RNA(circRNA)是近几年来发现的一种新型的内源性非编码RNA,由前体mRNA 下游序列(3'端)与其上游的RNA 序列(5'端)反向剪切形成环形结构[3]。circRNA在真核细胞中具有丰富、保守及稳定的特性,在生物体内调控靶基因的表达、基因转录和蛋白质生成。越来越多的研究证明,circRNA 可通过发挥其在生物学上的功能来参与疾病的发生发展机制,在肿瘤、神经系统、免疫系统等人类多种疾病中具有重要作用,在成为疾病预防、诊断、治疗及预后的新型生物标志物上显示巨大潜力[4-8]。随着测序技术的发展与学者们对circRNA 的认识不断加深,circRNA 与血液疾病的关系也逐渐被发现,影响疾病发生发展,本研究拟通过基因芯片法检测地贫患者外周血中差异表达的circRNA,期望发现地贫诊断的潜在标志物,为疾病诊断方法的建立提供新的思路。
1 资料与方法
1.1 一般资料 选取2018 年1~12 月年桂林第924 医院入院治疗的α-地贫东南亚缺失型患者10 例作为实验组,男性3 例,女性 7 例,年龄(35.5±7)岁,均符合地贫诊断标准。根据配对原则,设置对照组为健康体检合格人群10例,男性5例,女性5例,年龄(31.1±4.0)岁。两组受检者清晨空腹抽取外周血3.5 mL。本研究方案经广西代谢性疾病研究重点实验室伦理委员会批准同意。
1.2 主要试剂与仪器 Trizol (美国Invitrogen公司),PCR 试剂盒(美国Takara公司),RNA酶抑制剂试剂盒 (美 国 Epicentre 公 司),SuperScriptTMⅢ Reverse Transcriptase(美国Invitrogen公司),Primer(中国英骏生物技术有限公司);荧光定量PCR 仪(美国BIO-Rad公司),电泳仪(北京市六一仪器厂),DNA 微阵列扫描仪(美国Agilent 公司),超净工作台(上海上净净化设备有限公司);基因芯片AS-S-CR-H-V2.0 (Arraystar公司)。
1.3 方法
1.3.1 血浆提取 将实验组、对照组血样置于高速离心机中,3 500 r/min,离心5 min。离心后取出,在超净工作台上使用移液枪吸取上层淡黄色血浆500 μL,保存于无菌的EP管中,超低温冰箱保存待用。提取的血浆分两份,一份用作基因芯片法初筛与相关的circRNA,另一份用作荧光定量PCR法验证筛选的circRNA。
1.3.2 基因芯片法筛选差异表达circRNA 通过NanoDrop ND-1000测定样品总RNA样品的纯度和浓度,RNA质控结果见表1。提取实验组、对照组血浆总RNA,利用基因芯片AS-S-CR-H-V2.0 进行标记基因序列杂交。首先,用Rnase R (E picentre,Inc.)消化酶解样品总RNA,去除线性RNA,富集circRNARNA。第二,利用随机引物法扩增样品circRNA 转录cRNA,并进行荧光标记;RNeasy Mini Kit (Qiagen)对标记的cRNAs进行纯化处理;利用NanoDrop ND-1000测量成功标记的cRNA(pmol Cy3/μg cRNA)的浓度比活性。第三,在5 μL 10×阻断剂和1 μL 25×裂解缓冲液中添加1 μg标记cRNA以进行片段处理,60℃孵育30 min,后加入25 μL 2×杂交缓冲进行稀释。第四,吸取50 μL杂交溶液滴加在circRNA 基因芯片载玻片,65℃孵育17 h。最后,对circRNA 基因芯片进行清洗、固定、扫描,提取芯片数据,进行数据分析,寻找实验组与对照组间差异表达的circRNA,通过Fold Change进行筛选circRNA,验证差异倍数较大circRNA。

表1 总RNA的定量和质控结果
1.3.3 荧光定量PCR 验证 提取实验组、对照组血浆总RNA,逆转录合成cDNA。根据上一步筛选差异表达的circRNA,使用Primer 5.0,进行引物设计,见表 2。PCR 反应体系:2×Master Mix 5 μL,10 μmol/L的PCR特异引物F 0.5 μL,10 μmol/L 的PCR特异引物R 0.5 μL,cDNA 2 μL,加水至总体积为 10 μL。按照PCR 操作步骤进行扩增,95℃,10 min;40个PCR循环[95℃,10 s;60℃,60 s(收集荧光)]。为了建立PCR产物的熔解曲线,扩增反应结束后,按95℃,10 s-60℃,60 s-95℃,15 s的顺序加热;并从60℃缓慢加热到99℃(仪器自动进行-Ramp Rate为0.05℃/s)。反应结束后确认扩增曲线和熔解曲线,将阈值手定设定在0.015。

表2 引物序列表
1.4 数据分析 使用R 软件limma 软件包对原始数据进行分位数标准化及数据处理。通过散点图、聚类热图等表现差异表达的circRNA。通过生物信息学Circular RNA Interactome 数据库(https://circinteractome.nia.nih.gov/)对上、下调 circRNA 进行 miRNA 预测。circRNA 验证以管家基因β-actin 作为内参基因,取平均 Ct 值作为该样本最后 Ct 值,计算 2-ΔΔCt值反映验证circRNA表达水平。以管家基因β-actin(不同circRNA 的表达量基本恒定)作为内参,以地贫组circRNA 待测基因的值除以此样品内参的值,最终得到的比值该待测基因相对含量,倍数为地贫组的相对表达量除以对照组的相对表达量。对照组设定是1,上调表达阈值大于1,下调表达阈值大于0小于1。
2 结果
2.1 circRNA筛查数据 通过基因芯片法分析地贫实验组和健康对照组血浆中circRNA的相对表达水平,荧光信号清晰且无边缘化效应,背景强度低,结果可靠。经芯片扫描后,共检测到8 312个circRNA,如果以2.0倍为标准阈值,差异表达84个circRNA,47 个上调表达circRNA(>2.0),37个下调表达circRNA(<-2.0)。表3整理了差异表达前10个上调circRNA,有hsa_circRNA_100790、hsa_circRNA_000367、hsa_circRNA_100789等,以及差异表达前10 个下调circRNA,有hsa_circRNA_001496、 hsa_circRNA_402563、hsa_circRNA_405439等。通过Circular RNA Interactome数据库对差异表达的进行circRNA进行靶miRNA预测。表4整理了部分差异表达的上调和下调circRNA与其靶miRNA。通过图1散点图可知,X轴代表健康对照组,Y轴代表地贫实验组,绿线代表1.5倍变化阈值。在绿线上方说明circRNA上调表达超过1.5倍,在绿线下方说明circRNA下调表达超过1.5倍,存在部分circRNA上调表达超过1.5倍,下调表达超过1.5倍。

表3 地贫患者血浆前10个差异表达的上调和下调的circRNA
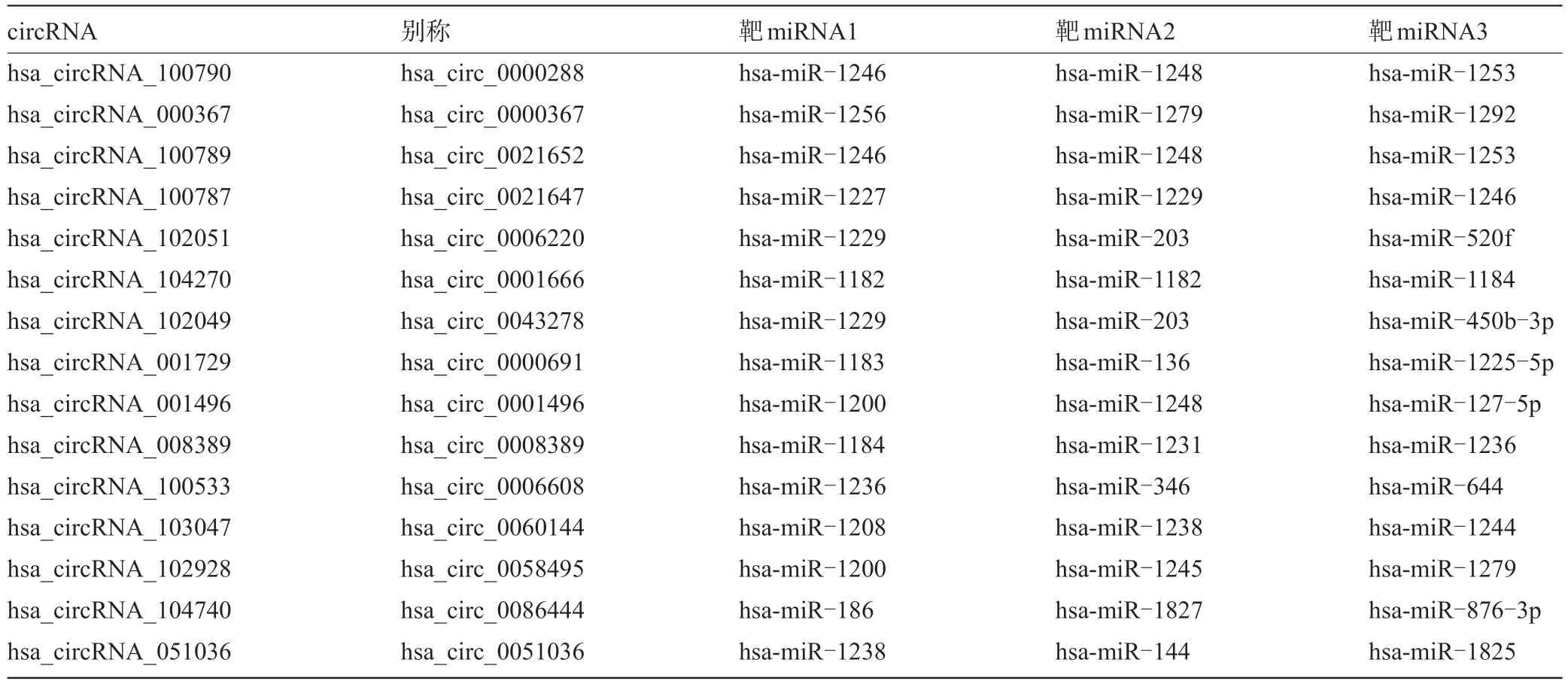
表4 部分差异表达的上/下调circRNA 与其靶miRNA
2.2 circRNA 验证数据 为了进一步研究筛选出来差异表达的circRNA 在地贫患者中的真实表达,随即通过荧光定量PCR 实验对筛选出来的circRNA进行验证。circRNA验证结果见表5,由相对表达量及表达倍数可知,差异表达的上调circRNA 是hsa_circRNA_100790,差异表达的下调circRNA 是 hsa_circRNA_001496,其表达趋势与初筛结果一致。hsa_circRNA_100790与hsa_circRNA_001496熔解曲线见图2,无特异性扩增。
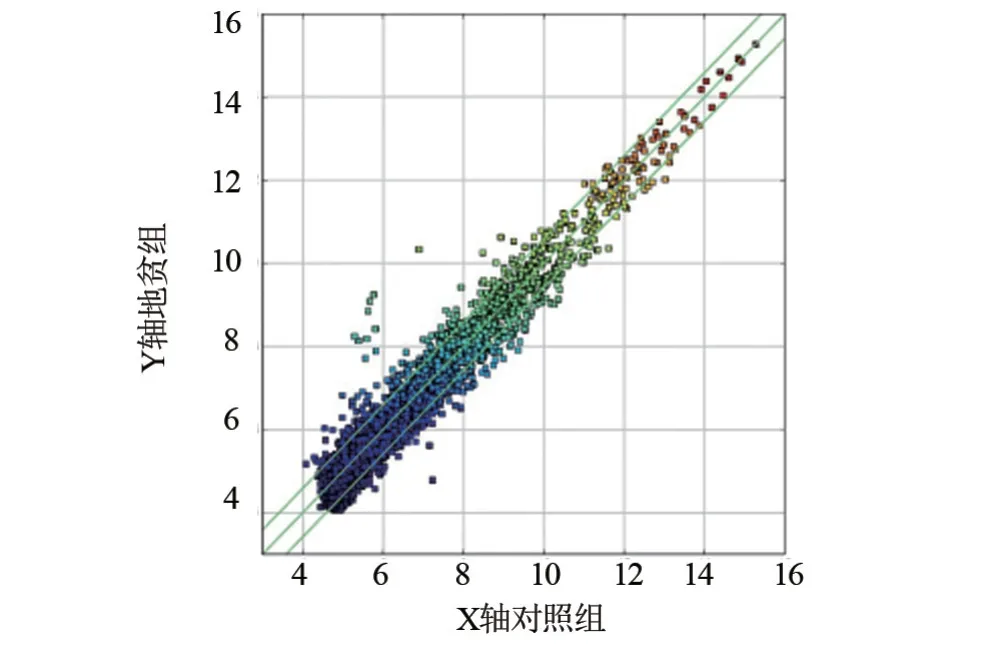
图1 差异表达的circRNA

表5 验证circRNA的相对表达量

图2 hsa_circRNA_100790和hsa_circRNA_001496熔解曲线
3 讨论
cirRNA 作为常见的竞争内源性RNA 的一种,调控靶基因转录和转录后的表达,在哺乳动物体内中广泛存在,影响发育、器官形成、细胞增殖及凋亡等多项生物进程。近年来,随着高通量技术和生物信息学的快速发展,特别是RNA-seq 技术诞生后,人们对circRNA的研究越来越深入,circRNA在作为人类疾病诊断与治疗的生物标记物上显示出巨大的潜能。目前地贫患者circRNA研究尚未见报道。
circRNA可与多个miRNA竞争性结合,充当miRNA 的海绵,从而调节miRNA 靶基因的表达,进而影响生物体的细胞、组织正常发育,参与免疫反应,调控地贫的发生发展过程。目前对于地贫患者中circRNA的功能研究还比较少,可以通过预测与circRNA 结合的miRNA,进而间接推测circRNA 的生物学功能。miRNA在地贫(β型)患者红细胞增生和幼红细胞比例增高发挥重要作用。miR-144/451在成熟红细胞存在高表达[9],过高的表达量常与疾病的发生发展有关。邓妮[10]在地贫(β型)杂交小鼠体内、在地贫(β型)患者的前体红细胞中都观察到了miR-144/451表达量明显升高,把地贫(β型)杂交小鼠体内的miR-144/451敲除时,小鼠的贫血等症状得到明显改善;随后检测了miR-144/451 在小鼠外周血、骨髓以及胚胎肝红细胞中表达趋势,进一步验证了miR-144/451基因表达缺失可以很好改善贫血症状,由此说明miR-144/451调控了地贫(β型)患者体内红细胞的成熟过程,miR-144/451可通过干预红细胞的生成进而达到疾病的治疗及预后目的。SVASTI 等[11]通过荧光定量PCR 也观察到miR-451在地贫(β型)患者纯化红细胞祖细胞培养中的双相上调。地贫(β型)患者中观察到不同胎儿血红蛋白(HbF)水平可能很大程度上受miR-486-3p 调控[12]。γ-珠蛋白的表达水平跟地贫(β型)发展息息相关,红血球细胞中miR-486-3p上调表达,导致BCL11A基因表达减少,γ-珠蛋白基因表达增加;重型地贫(β型)患者中γ-珠蛋白基因持续表达,BCL11A基因相对表达量表达下降[13];在K-562细胞系中,miR-26b调控γ-珠蛋白基因上调表达,基于miR-26b对γ-珠蛋白表达的诱导作用,学者认为miR-26b在未来靶向治疗中有可能将其应用于地贫治疗[14]。在地贫患者的红细胞生成过程中,hsa-miR-503下调表达,甚至缺失,出现贫血特征[15]。
circRNA 广泛存在于的机体各种组织细胞中,具有高度稳定性,对多种疾病调控功能。随着检测技术发展,将更有利于寻找更多的circRNA,并且探明其具体的功能。但目前有关地贫的circRNA 的研究仍处于起步阶段,如孙士鹏等[16]探讨了地贫分子机制及其相关microRNA 表达调控的研究进展等,在疾病发生发展过程中具体的机制仍不是很清楚,因此明确circRNA 的靶基因及其对靶基因的作用对人们深入了解地贫发病机制和预后治疗都有着重要的意义。
综上所述,本研究表明在地贫患者外周血血浆中发现大量差异表达circRNA,circRNA 有可能作为地贫新的生物标志物和精准治疗靶点,可能为未来地贫的疗效评估、预后判断带来新的希望。

