溶藻弧菌PepA蛋白原核表达载体的构建及其乙酰化鉴定
徐洲 范晨龙 丁燏
(1. 广东海洋大学水产学院,湛江 524088;2. 广东省水产经济动物病原生物学及流行病学重点实验室,湛江 524088;3. 广东省水产经济动物病害控制重点实验室,湛江 524088)
溶藻弧菌是一种嗜盐嗜温性革兰氏阴性条件致病菌,广泛生长于海洋及出海口[1-2]。它在pH为6-9,水温为17-35℃时健康生长,其最适生长盐度与海水盐度相差不多,所以在海水中常见[3]。它能使多种鱼、虾、贝表皮发生溃疡、出血及黑斑等,在我国南方尤为严重[4],在人身上表现为与伤口感染和胃肠道疾病相关,且常伴随水样腹泻[5],它不仅影响了水产养殖行业的发展,更危及人类的健康。
作用于肽键上的酶称为肽酶,肽酶在生物体中与很多功能相关,如蛋白质的消化、细胞内蛋白质的循环等[6]。PepA蛋白作为一种亮胺酰胺肽酶,在爱德华氏菌中PepA蛋白结合到esrB启动子区域并在早期负反馈调节T3/T6SSs表达的功能[7],在大肠杆菌中PepA能破坏预先形成的封闭RNA聚合酶-DNA模板复合物,或抑制其在转录起始阶段向下游阶段的进一步行动,所以能抑制carAB操纵子的启动子P1的转录起始,即PepA蛋白就是转录阻遏物[8],PepA蛋白负调控棘突的生物合成,其任何损害都可能影响棘孢菌的菌丝形态和生长[9]。
乙酰化属于蛋白修饰中多种翻译后修饰的一种,在枯草芽孢杆菌多细胞性中起着重要的调节[10]。乙酰化修饰既能提高某些蛋白的功能,也能阻遏某些蛋白的功能,如乙酰化修饰过后的黑穗醋栗果实多糖可以显著提高多糖的自由基清除能力[11],赖氨酸乙酰化能阻遏小鼠精子中的过度蛋白[12]。但目前将乙酰化修饰在弧菌上的研究少之又少。由于溶藻弧菌的多重耐药性很高[13],所以需要新型治疗方法。乙酰化修饰GNAT蛋白后会影响水稻细菌性条斑病菌的毒力[14],能调控PhoP蛋白的活性从而降低鼠伤寒沙门菌的毒力[15],细菌RplB蛋白的乙酰化会影响其核糖体蛋白的功能[16],这些都说明乙酰化修饰会直接或者间接影响细菌的毒力,这为我们研究乙酰化修饰对溶藻弧菌的毒力的影响提供了一定的理论支持。
PepA蛋白在溶藻弧菌的功能及其乙酰化调控尚未见相关报道,本研究拟构建溶藻弧菌 HY9901 PepA蛋白的原核表达载体、优化其表达条件,并分析其是否存在乙酰化调控,旨为探究乙酰化蛋白修饰对溶藻弧菌PepA蛋白功能的影响奠定基础。
1 材料与方法
1.1 材料
溶藻弧菌HY9901保存在广东省水产经济动物病原生物学及流行病学重点实验室。表达载体pET-28a由实验室保存,大肠杆菌BL21(DE3)均购自北京全式金生物公司。细菌基因组提取试剂盒(Easy Pure Plasmid MiniPrep Kit)、质粒提取试剂盒、切胶回收试剂盒购自赛默飞世尔科技有限公司(Thermo Fisher Scientific),一抗是购自Cell Signaling Technology的兔抗乙酰化赖氨酸抗体(Acetylated-Lysine Antibody),二抗是购自科敏生物公司的辣根过氧化物酶标记的羊抗兔IgG(Goat Anti-rabbit IgG/HRP),封闭液是碧云天的 QuickBlock Western,His标签蛋白纯化介质是碧云天公司的 BeyoGold His-tag Purification Resin(耐变性剂型),CobB(0.1 μg/μL)蛋白为前期实验室制备。
1.2 方法
1.2.1pepA基因的克隆与构建pET-28a-PepA表达载体 将HY9901菌种加入200 mL TSB培养基中,当OD600nm达0.8时,使用细菌基因提取试剂盒,按说明书提溶藻弧菌HY9901的DNA。根据NCBI上已公布的溶藻弧菌pepA基因(ID:NC_022349.1)序列分别设计含EcoRI和XhoI酶切位点的正反链引物,正链引物F:CCGGAATTCATGGAGTTCAGTGTAA AAAGTGGC(下划线为EcoRI酶切位点),反链引物R:CCGCTCGAGTTACTCTTCTGTCTCTTGGCCGC(下划线为XhoI酶切位点)。以溶藻弧菌HY9901的DNA为模板链扩增pepA基因,PCR反应体系为95℃ 5 min,95℃ 30 s,53℃ 30 s,72℃ 1.5 min,30个循环,72℃ 10 min。扩增的目的片段用切胶纯化试剂盒回收。pET-28a按照质粒提取试剂盒说明提质粒,用EcoRI和XhoI酶切,将切胶回收的产物与酶切后的pET-28a连接,用T4连接酶在16℃连接3 h后转入大肠杆菌BL21(DE3)感受态中,经无抗性的LB培养基培养1 h再涂布在含kana抗性(100 μg/mL)的平板上,37℃培养过夜,挑取单菌落进行PCR鉴定,鉴定所用引物 序 列 为F:TGCTAGTTATTGCTCAGCGG,R:TAATACGACTCACTATAGGG。鉴定为阳性菌落后经扩大培养送到广东生工生物公司进行测序,保证pET-28a-PepA载体序列的正确性。
1.2.2 PepA蛋白的诱导表达 将含pET-28a-PepA重组质粒的大肠杆菌BL21(DE3)以1%的体积分数接种于含kana(100 μg/mL)抗性的LB培养基中,37℃,200 r/min培养2 h,再加入体积分数为0.5%的IPTG进行诱导,以不含IPTG的pET-28a-PepA、含IPTG的pET-28a、不含IPTG的pET-28a为对照组。37℃,200 r/min摇5 h后离心收集菌液。随后用12 000 r/min离5 min再用1 mL的PBS洗,如此重复3次洗掉残留培养基。采用水煮法提取细菌蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳分析。
1.2.3 PepA蛋白表达条件优化 采用控制变量法,对于不同温度、时间、IPTG浓度条件下重组菌株的表达效果进行比较。当OD600nm达0.4-0.6时开始诱导。
温度:分别在37℃和28℃,IPTG浓度为0.5%摇5 h收集10 mL菌液,然后4℃ 6 000 r/min离心30 min,再用5 mL的PBS吹匀冲洗,如此重复两次。置于冰水混合物中超声波破碎重组细菌,超声波程序设置为:功率300 W,超声开时间5 s,超声关时间8 s,超声破碎20 min至菌液清澈透亮即可。然后分装上清和沉淀,沉淀用8 mol/L尿素在4℃条件下溶解过夜,经过SDS-PAGE后用考马斯亮蓝染色,用Gel-pro Analyzer 分析结果。
时间:在37℃,IPTG浓度为0.5%的条件下,诱导时间设置为1 h、2 h、3 h、4 h、5 h、6 h和7 h。菌液收集、处理及分析如1.2.2的步骤。
IPTG浓度:在37℃,诱导时间为5 h的条件下,IPTG浓度设置为0.1%、0.2%、0.4%、0.6%、0.8%、1.0%和2.0%。菌液收集、处理及分析如1.2.2的步骤。
1.2.4 His-PepA蛋白的纯化 将最优表达条件下诱导的菌株收集、提取蛋白,使用His标签蛋白纯化介质过柱纯化。将蛋白与填料在4℃中孵育过夜,将孵育过夜的蛋白加入纯化柱中,按碧云天公司的His标签蛋白纯化介质使用说明书操作。
1.2.5 Western blot验证PepA蛋白的酰化 验证CobB蛋白能否在体外将PepA蛋白进行去乙酰化。PBS*(去乙酰化酶磷酸缓冲液)反应体系如下:50 mmol/L Na2HPO4(pH 8.0),100 mmol/L NaCl,1 mmol/L MgCl2,2.7 mmol/L KCl及500 μmol/L NAD+;CobB蛋白和 PepA(0.2 μg/μL)蛋白,充分混合,反应总体积为500 μL。把纯化后的融合蛋白E3以300 μL分别加入200 μL PBS*、100 μL NAD+和100 μL PBS*、100 μL CobB和PBS*、100 μL CobB和100 μL NAD+四组中。以加入PBS*的反应作为阴性对照。所有反应体系均置于25℃孵育6 h。待反应完成后,取适量反应体系加入等体积SDS-PAGE电泳蛋白质上样缓冲液终止反应,使用Western blot法检测样品中目的蛋白的乙酰化水平,再用显色液和自动化学发光图像分析系统(TAN 5200)拍照记录。
2 结果
2.1 pepA基因的克隆
挑取菌落经PCR扩增鉴定获得目的条带(图1),电泳后显示的条带大小与PepA ORF大小一致。表明pepA基因克隆成功。
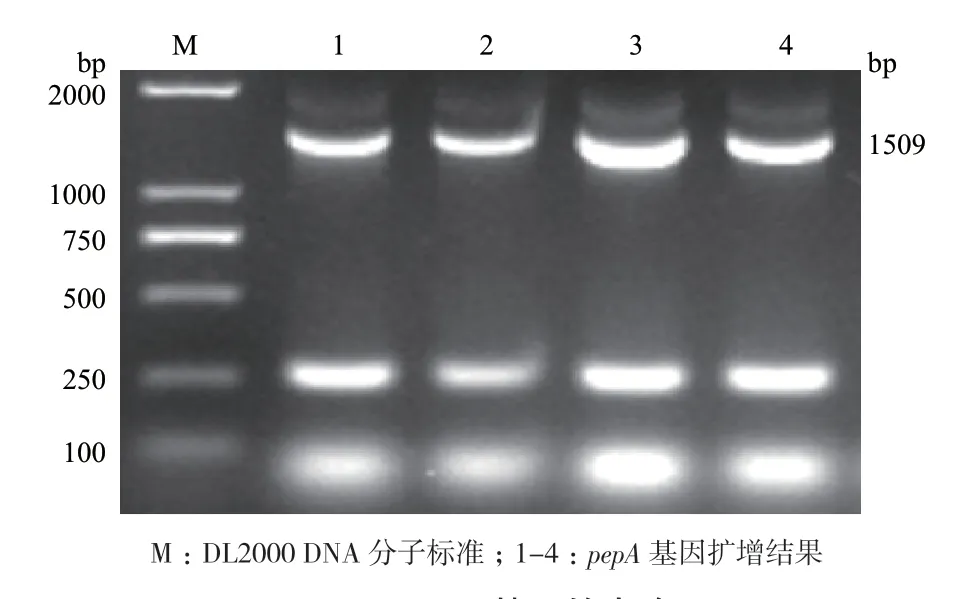
图1 pepA基因的克隆
2.2 重组质粒pET-28a-PepA的构建
重组质粒成功转入大肠杆菌BL21(DE3)中后进行菌落PCR鉴定,条带与预测大小一致(图2),随即送到广州生物生工公司进行测序,结果与预测序列完全一致,证明此载体构建成功。

图2 构建pET-28a-PepA载体
2.3 诱导PepA蛋白表达
将构建成功的重组菌株以37℃、0.5%的IPTG诱导5 h后收集蛋白,结果显示未诱导的pET-28a、诱导过的pET-28a和未诱导的pET-28a-PepA均不表达,而经诱导的重组菌株得到一条60.7 kD的条带(图3),表明pepA基因在表达菌株中成功表达。
2.4 PepA蛋白表达条件优化
2.4.1 温度对重组蛋白表达的影响 温度优化结果表明,PepA蛋白在两个温度条件下融合蛋白、上清和沉淀均有表达,且包涵体表达量均高于上清。在37℃的情况下,融合蛋白、上清和沉淀分别高于在28℃时的(图4)。

图3 PepA蛋白SDS-PAGE电泳分析

图4 温度对PepA蛋白表达的影响
2.4.2 IPTG浓度对重组蛋白的影响 结果表明,PepA在体积分数为0.1%-2%的IPTG诱导下表达量无明显差异,即IPTG浓度对PepA表达量无明显影响(图5)。
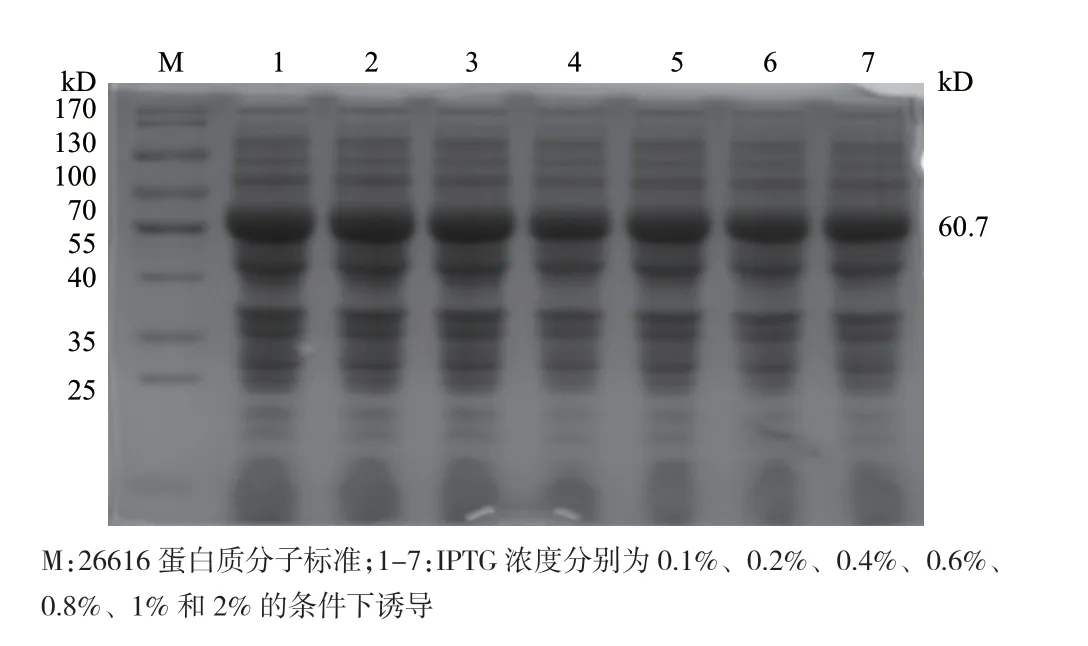
图5 IPTG浓度对PepA蛋白表达的影响
2.4.3 诱导时间对重组蛋白的影响 结果表明,PepA蛋白表达量随诱导时间增加而呈现出先增加后稳定的趋势,即5 h表达量达到最大且不再有明显的增加,即诱导时间5 h为最佳诱导时间(图6)。综上所述,PepA蛋白最佳表达条件为37℃、0.1%的IPTG和诱导5 h。

图6 诱导时间对PepA蛋白表达的影响
2.5 His-PepA蛋白的纯化
融合蛋白经his亲和层析柱纯化后,用SDSPAGE进行分析。结果表明,在第3次洗脱(E3)时成功纯化(图7)。
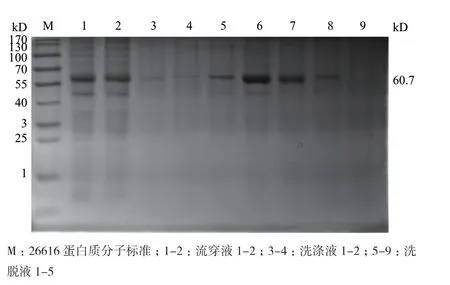
图7 PepA蛋白的纯化
2.6 PepA蛋白的乙酰化鉴定
本研究使用抗乙酰赖氨酸抗体进行了蛋白质印迹分析,以测试PepA的乙酰化水平。结果表明(图8,line 5)PepA蛋白自身存在乙酰化修饰位点,即Pepa蛋白是个乙酰化蛋白。为了进一步证实PepA和CobB之间的关系,对PepA进行了去乙酰作用,并使用抗乙酰赖氨酸抗体对蛋白质的乙酰化水平进行了分析,1-4的条带颜色深浅没有明显差异,表明CobB蛋白不能调控PepA蛋白的乙酰化修饰程度或者对其调控程度很小(图8)。

图8 PepA蛋白的乙酰化鉴定及调控
3 讨论
目前关于乙酰化修饰的研究较多,如对认知障碍功能[17]、癌症相关[18]及肉类品质的影响[19]等研究。目前为止发现了两种蛋白质乙酰化形式:赖氨酸乙酰化和N末端乙酰化[20],N末端乙酰化是公认的主要的细胞调节剂[21],而赖氨酸乙酰化和其他翻译后修饰联合起来可以控制整个细胞信号通路[22]。
目的蛋白的产生量很大程度上受原核表达的不同诱导条件的影响,故进行目的蛋白的原核表达条件优化是必要的。本试验在设置诱导参数时参照溶藻弧菌TolB与dtd基因的原核表达条件优化[23-24],得出在一定范围内IPTG浓度不会增加目的蛋白表达量,这与丁军颖等[25]的IPTG浓度在一定范围内对丁肝抗原蛋白表达量无影响的研究结果有相似之处;而在37℃时目的蛋白表达量高于27℃,这可能是由于大肠杆菌酶活性在37℃较高有关;而目的蛋白表达量随着诱导时间先上升后趋于平稳,在5 h时达到最高,这说明长时间诱导并不能使蛋白表达量一直增高。
“Nε-赖氨酸乙酰化只能通过酶促或者非酶促两个途径完成,而去乙酰化则需要通过去乙酰化酶CObB来完成。迄今为止,大肠杆菌中已鉴定出的去乙酰化酶只有CobB一种,CobB是一种需要NAD+的参与才能调控乙酰化修饰的酶”[26-27]。本试验采用大肠杆菌表达系统验证PepA蛋白是否是去乙酰化蛋白以及去乙酰化CobB蛋白对目的蛋白的乙酰化调控程度。经研究得出CobB不能调控PepA蛋白的乙酰化修饰,说明PepA蛋白不是CobB反应的底物,这可能是赖氨酸上乙酰基团通过CobB以外的其它去乙酰化酶或其它去乙酰化方式移除[28],此猜想还待未来印证。
4 结论
成功构建溶藻弧菌PepA重组表达菌株,其最优诱导表达条件为0.1% IPTG,37℃诱导5 h;经鉴定PepA蛋白是乙酰化蛋白,且在体外不存在去乙酰化。

