β-果糖苷酶抑制子的研究进展
周怀烨 周碧瑶 苏涛
(南京林业大学南方现代林业协同创新中心 南京林业大学生物与环境学院,南京 210037)
高等植物中,源组织是光合同化物的净生产者,库组织是光合同化物的净输入者[1-2]。蔗糖是碳同化产物的初级形式,经筛管复合体从源组织转运至库组织[2]。蔗糖从韧皮部卸载到库细胞中后,通过胞间连丝被细胞内转运途径吸收,参与代谢和合成过程[3],或通过蔗糖转运蛋白(Sucrose transporters)输出到质外体,用于真菌拓殖或是防御相关的响应[3-4]。植物可直接利用的糖大多为单糖,蔗糖需水解才能被植物所利用[5]。蔗糖能够被两种酶水解:一种是蔗糖合成酶(Sucrose synthase,EC2.4.1.13,Susy),将蔗糖和尿苷二磷酸(Uridine diphosphate,UDP)催化转化为底物UDP-葡萄糖和果糖;另一种是蔗糖转化酶(Invertase,EC3.2.1.26,INV),催化蔗糖裂解为葡萄糖和果糖(已糖)[6]。由于Susy的催化反应是可逆的,而INV催化裂解蔗糖是不可逆的。因此,INV在碳的利用和分配中的作用更关键[5]。糖不仅是植物必需的营养物质,也是调控基因表达的关键信号分子。INV通过影响碳源分配和糖信号功能,在稳定植物的源-库平衡,调节生长发育和胁迫适应等方面具有重要作用[7-9]。
根据蛋白质的可溶解度、最适pH值、亚细胞定位和等电点等特性,INV分为中性/碱性胞质类蔗糖转化酶(Cytosolic invertase,CI)和酸性蔗糖转化酶(Acid invertase,AI)[10]。CI是一类非糖基化的蛋白,催化活性的最适pH为6.8-9.0,通常靶向定位在细胞质、线粒体、质体和细胞核,仅特异性作用于蔗糖。AI催化活性的最适pH为4.5-5.5,是糖基化酶,由细胞壁蔗糖转化酶(Cell wall invertase,CWI)和液泡蔗糖转化酶(Vacuolar invertase,VI)构成,VI是可溶性的,CWI是不可溶的。除了水解底物蔗糖,AI还能水解含有β-果糖的其他低聚糖(如棉籽糖和水苏糖),因此又称之为β-果糖苷酶(β-fructosidase)[5,11]。研究表明CWI参与质外体蔗糖的分配,影响库器官的强度,糖信号转导和环境刺激反应[3,9,12-18],而VI主要调节渗透压影响细胞的伸长和扩大[6,19-23]。
早期的研究认为,AI主要受其编码基因在转录和转录后水平的调控。然而,由于AI蛋白具有稳定结构的糖基化修饰,因此,其活性在很大程度上依靠翻译后调控机制[24]。近年来,研究发现这种调控机制主要由一类小分子量(14-23 kD)的抑制蛋白介导。该蛋白靶向定位在质外体或液泡中,能够特异性的抑制CWI或VI,称为β-果糖苷酶抑制子(Cell wall/Vacuolar Inhibitor of β-fructosidases,C/VIFs)。根据近些年的研究报道,本文综述了C/VIF的分子结构和生化特点,编码基因在器官和组织的时空表达特征,在植物发育中的生理学功能以及该框架下的调控机制。
1 C/VIF的理化性质、分子结构和时空表达特征
1.1 C/VIF生化特征和蛋白保守结构
从1994年Pressey和Weil分别报道用柱层析法从番茄果实和烟草悬浮培养细胞中分离出C/VIF蛋白酶,到1998年德国的科学家Greiner首次在烟草中克隆出了Nt-inhl的cDNA,并验证其异体表达的纯化蛋白对AI的体外抑制活性[25-27],这些实验为开启C/VIF蛋白酶的生化特性研究奠定了基础。众多的体内和体外实验揭示C/VIF蛋白主要有以下特征:(1)蛋白分子质量约14-23 kD,具有热稳定性,其氨基酸序列中度保守,在种间和种内变异较大,如烟草的CIF和VIF的蛋白序列同源性只有47%。因此,仅从序列上很难预测蛋白的靶向功能[11]。(2)对烟草NtCIF的蛋白结构模拟和结晶法解析发现,其蛋白结构中有4个不对称的α螺旋,这种特征可维持NtCIF单体(Monomer)结构的完整性,同时也是AI结合的重要区域。此外,4个半胱氨酸(Cysteine,Cys)保守位点,可在分子内形成两个二硫键,利于稳定蛋白结构。因此,在还原剂二硫苏糖醇(Dithiothreitol,DTT)作用下,NtCIF蛋白在凝胶电泳上会有位移现象发生[28]。(3)C/VIF的抑制功能是通过插入AI和底物蔗糖的催化位点之间的裂口,形成复合物来发挥其功能性抑制(图1)。C/VIF这种对AI水解活性的抑制活性会依赖于溶液中的pH值、蔗糖和二价金属离子(如Ca2+、Mg2+和Zn2+等)浓度的改变[26](图1)。
1.2 C/VIF在不同器官和发育阶段的特异性表达
对基因时空表达模式进行分析可为基因的生理功能和体内活性的研究提供重要线索。荧光定量PCR比较C/VIF编码基因在两个甘蔗品种GT28和ROC22茎中的表达差异,结果显示SoInvInh2基因表达量在GT28 中高于ROC22,而CWI在GT28 中的酶活性显著低于ROC22。相关性分析表明该基因表达量与CWI活性呈显著负相关,说明SoInvInh2可能是直接抑制甘蔗茎中CWI活性,改变蔗糖的合成和分解[29]。在澳洲甘蔗茎节间发育和成熟过程中,C/VIF编码基因ShINH1的表达会逐渐显著降低;同时,ShINH1在源叶中的相对表达高于库组织(茎、花和根)[30]。研究发现不同年限铁皮石斛的茎CWI活性与DoInvInh1和3的表达模式负相关,这种相关性随着茎龄的增加更加显著,说明DoInvInh1和3可能调节铁皮石斛茎中的CWI活性,影响多糖的合成前体蔗糖的代谢[31]。
番茄中SolyCIF在花器官中高表达,与红色果实相比,SolyCIF在绿果中的转录水平更高[32]。在大豆中,GmCIF1的转录本在花和种子发育初期具有高表达特征[24]。同样,烟草Nt-inh1的RNA印迹分析表明15周龄烟草的花瓣、子房和雄蕊等性器官中转录水平较高[27]。最新的研究表明,木薯的IbINH转录本在贮藏根中最高,在叶片中的表达最低[33]。然而,在衰老的条件下,烟草Nt-inh1和CWI转录水平的共表达模式会呈下降趋势[27]。因此,不同植物或作物的C/VIF表达模式表明,C/VIF可能在库组织(根、茎和性器官等)转录水平会高一些,在源组织中的转录水平较低,这可能是由于库组织的蔗糖卸载和转运到胞内需要相对较高的AI活性。但是在胁迫条件下,CIF在源叶中会有高度响应。此外,C/VIF在相同器官(如果实和种子)不同发育阶段会随着器官的成熟降低转录本量,说明C/VIF极有可能只参与初期器官的发育的形态建成。
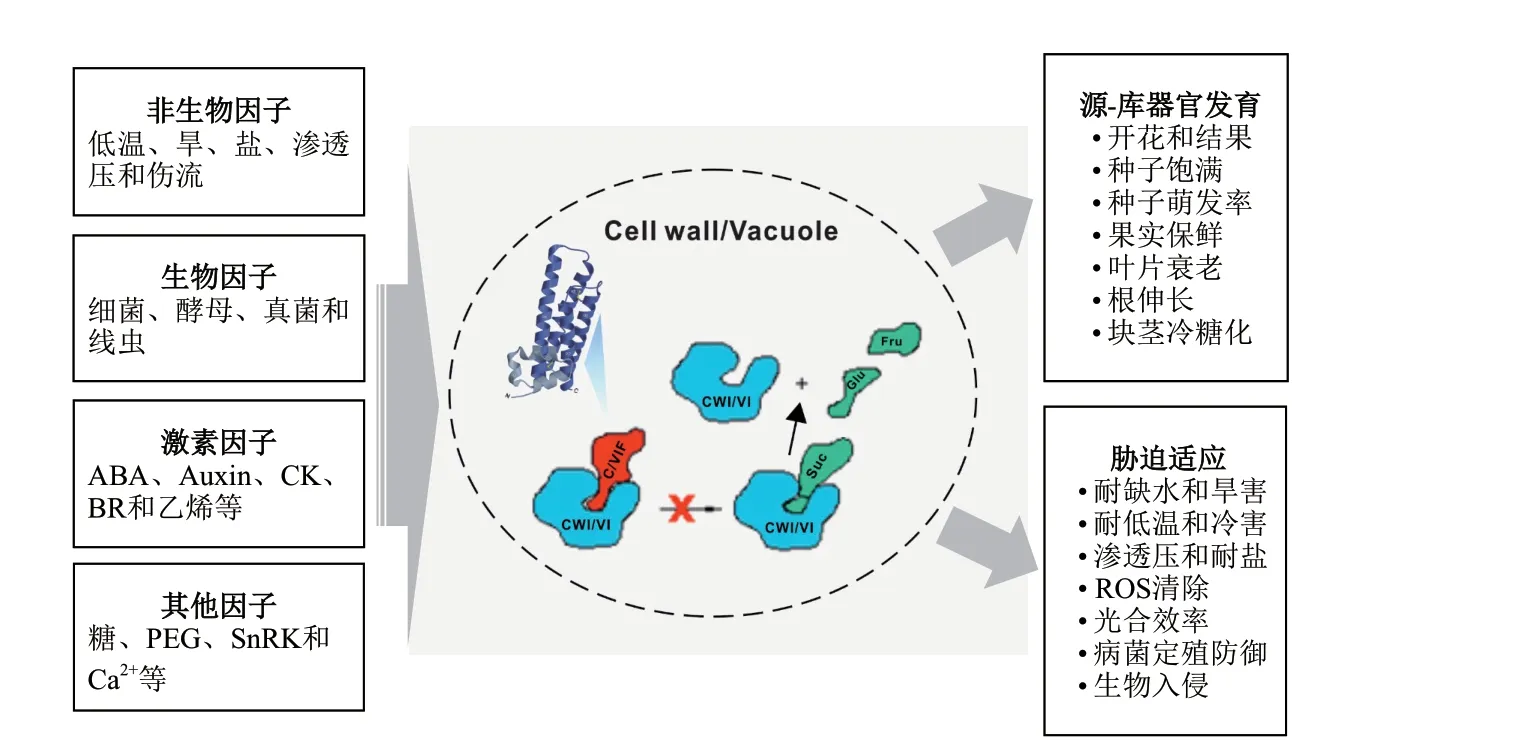
图1 影响C/VIF表达的因素以及C/VIF在植物中的功能
1.3 C/VIF对细胞内/外因子的响应
C/VIF基因表达会受到外界不同环境因子和植物激素因子的调节(图1)。在烟草悬浮细胞中,外加脱落酸(Abscisic acid,ABA)可以显著诱导NtCIF转录本量和蛋白质表达[11]。同样,在拟南芥和大豆叶片中,AtCIF1和GmC/VIF1的表达会对ABA浓度的增加呈现线性响应趋势,说明了C/VIF可能参与ABA诱导衰老的主要组分[24,34]。最新报道显示,杨树根特异表达的PtC/VIF2受ABA处理的诱导[10]。此外,木薯中IbINH的转录本受干旱胁迫和ABA、水杨酸(Salicylic acid,SA)和茉莉酸(Jasmonic acid,JA)等激素的诱导[33]。对康乃馨进行放线菌酮处理,蔗糖从衰老花瓣向邻近器官(如花托和子房)的转移减少[35]。这可能是因为C/VIF阻止蔗糖水解,利于蔗糖装载到韧皮部进行碳的再动员,使枯萎花瓣向邻近器官转移碳水化合物。有意思的是,有研究发现一个疑似C/VIF的编码基因的转录本可以被ABA抑制,推测ABA影响AI的活性是通过调控C/VIF的表达实现的[36]。
C/VIF的表达还受到环境胁迫因子低温和干旱以及伤胁迫的调节和诱导[10,37-39]。在生物胁迫因子中,假单胞菌(Pseudomonas syringaepv. tomato DC3000)侵染拟南芥源叶后,发现AtC/VIF2表达量在24 h和48 h显著下调,而CWI的活性成相反趋势[38]。同样,在灰霉病菌(Botrytis cinerea)侵染拟南芥后,AtC/VIF2的转录本表达受到抑制,而AtCWIN1基因表达量被诱导增加[39]。木本毛果杨根部在病原真菌腐皮镰刀真菌(Fusarium solani)处理之后,PtC/VIF1和PtC/VIF2的转录水平同时下降[10]。这些实验表明C/VIF可能通过抑制AI活性,直接或间接参与蔗糖介导的防御和免疫途径。
马铃薯中研究发现C/VIF对AI的抑制受制于信号分子蔗糖非酵解型蛋白激酶(Sucrose non-fermen-ting1-related protein kinase,SnRK)的调控(图1)。双分子荧光互补实验表明马铃薯的StvacINV1、StInvInh2B与SbSnRK两两相互作用形成蛋白复合物。体外激酶分析和蛋白磷酸化分析显示,SbSnRK1α和β亚基在StInvInh2与StvacINV1的结合过程中起关键发卡作用[40]。有趣的是,C/VIF还能与果聚糖外切水解酶(Fructan exohydrolases,FEHs)形成复合体,FEH有可能通过与C/VIF竞争性结合来微调CWI活性[41]。此外,热激蛋白基因SlHSP17.7在番茄SlCIF1过表达植株中的转录本高度上调,深入研究发现,抑制SlHSP17.7表达显著降低己糖的含量,说明SlHSP17.7可以通过互作SlCIF1来改变番茄果实中的糖代谢过程[42]。
2 C/VIF在植物中的功能性研究
2.1 调控种子、果实的发育和衰老
人口膨胀使人们已经意识到粮食危机和寻求策略提高作物产率的重要性,因此,增加植物源叶中光合产物糖的输出,同时加强这些糖在库组织中的卸载和存储容量(Storage capacity)是植物生长和产量最大化的潜在手段[1]。在库组织中,CWI是蔗糖卸载的关键酶,大量研究证明,CWI通过调节糖代谢和信号作用,促进花器官分化种子和果实的发育[13-14,43-44]。而在库器官成熟过程中,C/VIF作为介导CWI翻译后调控的机制,调节质外体空间蔗糖水解产物容量和信号功能对植物的库器官发育有着重要影响(图1)。
研究发现,在果实特异性表达启动子2A11的作用下,激活番茄内源β-果糖苷酶抑制子SlCIF1的高效表达显著抑制果实中CWI活性并导致花期提前,番茄果实的发育和品质也发生改变[42]。番茄中的质外体INVINH1被发现可以和LIN5(CWI)发生靶向特异性结合。在INVINH1的RNAi植株中,CWI活性和己糖水平被提高,种子和果实变得更饱满;同时发现,在ABA处理条件下,RNAi植株叶片衰老过程被延迟,说明INVINH1和LIN5的互作和共表达可能诱导葡萄糖的信号功能,在子房-果实的器官转换中起到核心作用[45-46]。ABA是诱导某些植物叶片衰老的关键激素[46]。同样,抑制大豆中的GmCIF1表达显著增加了种子的饱满度,种子中的淀粉、可溶性糖和蛋白增加,说明种子成熟过程中淀粉和蛋白质的合成需要沉默GmCIF1,促进蔗糖卸载,释放更多的已糖[24]。淀粉是种子发育过程中碳水化合物的主要储存形式,种子萌发后,淀粉降解为可溶性糖,为细胞呼吸提供养料,为幼苗生长提供能量[47]。对拟南芥AtCIF1的功能缺失突变体cif11的免疫和代谢产物分析发现,CWI活性在种子萌发早期显著上升,已糖含量提高,一些糖转运蛋白基因表达也受到不同程度的诱导升高。在ABA作用下,cif11种子萌发率和野生型相比显著升高。这些证据表明AtCIF1对CWI活性的翻译后调控能够微调蔗糖水解,可能通过产生糖信号功能影响种子萌发和早期幼苗的生长[34]。
研究人员发现番茄中VIF调节VI活性同样也能够影响果实的颜色和口味等质量性状及成熟过程(图1)。调控果实成熟过程主要由一个RIN蛋白调控SlVIF的表达,抑制SlVI的活性,导致色素和乙烯的合成的改变。与野生型果实相比,SlVIF过表达的番茄株系果实成熟较快,开花后35 d的果实中乙烯产量检测增加了60%[48]。该机制的发现对提高果实质量具有重要农业价值。此外,VIF还与果实的储藏和保鲜相关。最新研究发现在梨中,蔗糖主要分布在液泡中,果实贮藏过程中蔗糖丰度的变化与VI活性的变化有关。其中VI编码基因(PbrAc-Inv1)的体内功能检测发现可加速液泡中蔗糖水解,而一个VIF(PbrII5)可与PbrAc-Inv1结合形成失活复合物,下调VI活性,抑制蔗糖分解[49]。然而,作者并没有对VIF和VI互作机制做更深入的研究。
2.2 抑制低温诱导糖化
马铃薯在低温储存条件下,会导致块茎中还原糖的积累,导致淀粉降解,甜度增加,这种现象叫做低温诱导糖化[50]。块茎中还原糖的增加对加工质量和品质有负面影响,因为在油炸过程中还原糖会与游离氨基酸发生反应,产生对人体有毒害的丙烯酰胺,影响口感和颜色以及健康[51]。因此,预防还原糖在马铃薯块茎中的累积对马铃薯加工业具有重要的经济意义。冷糖化过程中还原糖的积累是多种代谢途径相互作用的结果,其中VI催化的蔗糖代谢途径尤为突出。因此,推测通过改变VI酶活可以直接抑制低温诱导糖化现象的发生[51]。因VIF在翻译后调控VI活性,早期的研究发现,在马铃薯中异体表达烟草NtVIF基因可以显著抑制VI的活性,降低块茎的低温诱导糖化现象[51],说明调控VIF具有生物工程意义。目前越来越多的实验,通过利用VIF的翻译后调控机制抑制VI水解活性,即通过过表达特异性VIF蛋白的编码基因,微调蔗糖水解产物,可以显著地减少了还原糖的合成,抑制了冷糖化(图1),提高马铃薯的加工质量[51-52]。
2.3 抗逆适应性
植物在自然环境中常常面临着不同的环境因子(干旱、低温和盐胁迫等),会利用多种分子调控机制改变抗逆适应性用以生存。CWI的活性是多种逆境胁迫因子的信号蛋白,因此,CIF介导对CWI翻译后调控机制可能广泛地参与多种抗逆响应和防御过程[16](图1)。
在甘薯中过表达β-果糖苷酶抑制子IbINH发现植株生长减慢,然而在干旱条件下植株的抗旱性增强。抑制IbINH表达,植株呈现相反的发育性状和抗旱表现。对叶片中糖的代谢产物测定发现,蔗糖和己糖含量显著改变,ABA生物合成基因和非生物胁迫响应相关基因在抗旱的转基因植株中均显著上调[33]。这些结果表明IbINH通过诱导源-库强度和ABA调节途径来介导甘薯的生长和抗旱性。
在低温条件下,番茄中沉默INVINH1的表达,CWI活性升高,耐寒性增强;而过表达INVINH1的转基因番茄植株则与之相反,CWI活性降低,耐寒性减弱。同时,ABA合成基因表达显著上调,但ABA信号基因无明显变化,表明INVINH1通过影响ABA的合成调控番茄对低温胁迫的应答[37]。最新研究发现,通过改变AtCIF1在拟南芥的表达,转基因植株对ABA的敏感性和耐盐性被显著改变,说明通过CIF调控CWI活性变化和ABA响应和耐盐性相关[53]。在气孔开度的机制上,VIF能通过调控VI活性调节气孔开度,以提高植物抗旱性。该机制通过发现拟南芥保卫细胞中VI活性明显高于其他叶表皮细胞,其水解活性可以改变液泡中蔗糖-己糖梯度,引起保卫细胞中的水势变化,调节气孔开度,影响植物的耐旱性[54]。同样,在拟南芥中异源表达烟草NtVIF基因得到的转基因植株,在干旱条件下耐旱性提高,同时伴随着VI活性、气孔导度和电导率下降[55]。
CWI水解蔗糖产生的已糖一方面被质外体的病原微生物吸收用于侵染定殖,另一方面在植物宿主中作为信号分子引发叶片或根组织防御响应和糖免疫过程的发生,如病程相关蛋白基因的诱导,光合作用的下调,以及细胞壁加厚和胼胝体的形成等。就生物胁迫而言,目前已经在多种植物中发现,病原侵染植物宿主会直接诱导CWI的表达和活性提高[56-66],而CWI活性的变化可能和CIF的表达(或活性)直接相关。研究人员推断C/VIF可能通过在质外体中调控CWI活性微调糖稳态间接影响植物对病原微生物的防御过程。通过改变C/VIF的表达影响植物对病原胁迫的抗性和干扰病原微生物的侵染研究目前仅在拟南芥中有少量报道。在假单胞菌侵染拟南芥源叶之后,CWI活性显著增加,AtC/VIF2的表达被抑制,这表明CIF表达变化可能是植物宿主主动产生病原菌防御反应的总要因素[38]。有趣的是,拟南芥根肿病成因发现是由病原真菌P.brassicae感染引起,通过转基因手段提高AtCIF1和AtC/VIF2在拟南芥根部的表达,植株的CWI活性显著降低,对病原真菌的感染指数降低,根瘤症状明显减轻[67]。该研究间接证明CIF调控CWI的活性和植物的抗逆和防御响应高度相关。然而,CIF的病原防御的生理功能和潜力依然有待研究。
3 展望
AI是一类具有信号肽的分泌蛋白,且含有稳定结构的糖基化修饰,加上越来越多的实验发现AI编码基因的表达和活性变化并不一致。因此,AI酶的活性调控在很大程度上依赖于蛋白水平的调节,而这种翻译后调节机制便由小分子蛋白C/VIF介导。通过抑制或增加C/VIF编码基因表达,能够改变AI水解底物蔗糖活性,微调碳素分配,并发挥水解产物己糖的信号功能。虽然C/VIF微调AI活性在稳定植物的源-库代谢平衡,促进生长发育和抗逆适应以及防御响应等方面所具有的重要生理作用,已经在模式植物拟南芥和作物中被广泛报道,目前仍有一些问题需要深入解析。首先C/VIF与果胶甲酯酶抑制子(Pectin methylesterase inhibitors,PMEI)在进化上高度同源,都含有氨基酸序列保守区(4个Cys)和几乎相同的蛋白分子量,但在成熟蛋白结构和靶向功能上完全不同。虽然体外研究发现,改变一个氨基酸残基可以互换C/VIF和PMEI的靶向抑制特异性,但除了重组蛋白的纯化和活性研究,仍然缺乏在序列上有效的方法区分C/VIF和PMEI的体内或体外底物抑制活性。此外,已有报道揭示C/VIF的生理功能和防御微生物胁迫相关,然而,该领域的研究仍然缺少证据揭示何种因子(宿主或微生物),能够诱导C/VIF转录本(或蛋白)变化来改变质外体环境或液泡中的糖稳态,参与防御和免疫过程。目前已有大量的报道揭示C/VIF的生理学重要性,但是木本植物中C/VIF的编码基因和其潜在的功能性研究仍然缺乏,尤其是C/VIF在木本植物微调糖稳态和信号功能对植物生长和发育以及抗逆适应性研究依然是空白。因此,这些问题都有待进一步研究,本综述将为上述热点问题的揭示提供研究方向和理论依据。2013.

