CaSR在宫颈癌C-33A细胞增殖和迁移中的作用研究*
袁辉 张淑敏 王得利 栾海蓉 石屹 徐吉雨
钙敏感受体(calcium sensing receptor,CaSR)是G 蛋白偶联受体超家族中C 家族成员,由1 078个氨基酸组成,包含四个主要区域:细胞外N 末端区域(ECD)、连接ECD 和第一跨膜的富含半胱氨酸结构域螺旋结构、七个跨膜(TM)结构域和细胞内结构域[1-3]。广泛表达于真核和原核细胞,其配体为多价阳离子和多胺等。具有维持机体钙稳态及其他金属离子稳态的功能[4-6]。本研究拟通过观察CaSR 在裸鼠移植瘤模型和C-33A 细胞中的表达情况,通过给予CaSR 激动剂(R568)、CaSR 抑制剂(Calhex231)干预,从而推断CaSR 调控宫颈癌C-33A 细胞增殖和迁移的机制。
1 材料与方法
1.1 实验动物、细胞及分组 30 只5 周龄BALB/c雌性裸鼠(18±2)g 购自常州卡文斯实验动物有限公司。造模采取裸右侧腋下皮下注射C-33A 细胞悬混液(5.5×107个/mL)。按瘤体大小均匀分组:Model(移植瘤模型)组、Model+R568 组和Model+Calhex231 组,每组10 只,体重分别为(22.18±2.03)、(23.99±2.45)、(22.79±2.77)g,三组比较差异无统计学意义(P>0.05)。Model+R568组和Model+Calhex231 组每日分别腹腔注射R568(10 μmoL/kg)和Calhex231(10 μmoL/kg)。SPF 级饲养1 个月,安乐死后主动脉取血并分离取出移植瘤称重。体积(mm3)=0.5×长径×短径2。抑瘤率=(Model 瘤重-Model+R568 组或Model+Calhex231 组瘤重)/Model 瘤重×100%。宫颈癌C-33A 细胞购自上海泽叶生物科技有限公司(货号:AC102117)分为Control 组,R568(5 μmoL) 组,Calhex231(3 μmoL)组。
1.2 ELISA 法测定血清及培养基中MMP2 和MMP9含量 ELISA 测定试剂盒均购自Beyotime 公司,饲养4 周,取待测鼠血清(培养基)后,置于冰盒内。在96 孔酶标板中,设置标准蛋白孔、空白孔、对照孔和待测孔。按照厂家提供说明操作,显色后使用酶标仪,在450 nm 波长条件下检测每个待测孔的OD 值,最后按照标准曲线和公式计算每组待测血清(培养基)中MMP2 和MMP9 浓度。
1.3 Western blot 检测蛋白表达 将研磨碎的瘤组织(C-33A 细胞)置于1.5 mL EP 管中加入0.5 mL RIPA缓冲液裂解,然后在4 ℃条件下离心(13 500 r/min,25 min),收集上清液并在-80 ℃下保存。使用BCA蛋白检测试剂盒(Beyotime,产品编号:P0023)检测每个样品的蛋白质浓度。应用12.5%的SDSPAGE 电泳分离各组蛋白,而后将待测蛋白转移到PVDF 膜上。在室温下,用5%脱脂奶粉封闭2 h,用以下一抗(1︰1 000 稀释,4 ℃)将膜孵育过夜:CaSR、Bax、Bcl-2、E-cadherin、β-catenin 和VEGFR3(Santa Cruz Biotechnology,Dallas,Texas,USA)。用抗鼠/兔IgG 抗体(1︰5 000 稀释,北京蓝博斯特生物有限公司,产品编号:LBI01)室温孵育1 h。采用ECL 法在化学发光仪上显色,应用Image J(v1.8 版本)图像处理软件测量条带灰度值,计算各组的蛋白相对表达量。
1.4 CCK8 检测C-33A 细胞增殖和细胞划痕实验 (1)按照实验步骤分组后,将C-33A 细胞接种于96 孔板(5×103/孔),设立空白对照组,观察细胞状态良好即可加药处理,随后继续培养48 h(37 ℃,5%CO2);取出96 孔板,用预冷PBS 洗涤3 次,把液体甩干后向每孔加入10 μL CCK-8溶液,封板后在37 ℃温箱中孵育60 min,使用酶标仪在450 nm 波长范围检测每个待测孔的OD 值。(2)C-33A 细胞接种于6 孔板中(1×106),无菌条件下,在6 孔板背后画6 条横线,每条线间隔0.5 cm。弃掉培养基,PBS 清洗后用枪头与所画横线成90°角划过,随后PBS 洗涤细胞3 次,分别加入加药处理的培养基,在37 ℃,5%CO2培养箱中培养,在0 h 和24 h 取出6 孔板应用光学显微镜拍照。
1.5 Fluo 4-AM 荧光探针检测细胞内钙变化 将C-33A 细胞接种于24 孔板中(2.5×105/孔),分别加入加药处理的培养基,24 h 后,用灭菌预冷的PBS 清洗3 次。在37 ℃避光条件下,加入HEPES溶液配置的Fluo 4-AM 工作液300 μL。30 min 后,每组选取8~10 个细胞为观察对象,用荧光显微镜(Olympus Ⅸ-70)检测细胞内钙变化,激发波长480~500 nm,发射波长525~530 nm。
1.6 qRT-PCR 检测Bax 和Bcl-2 基因表达 按照厂家提供的操作步骤,使用Trizol(Invitrogen,15596026)从各组C-33A 细胞中提取总RNA。用逆转录试剂盒(TaqMan)以2 μg 的总RNA 合成cDNA。使用SYBR Green PCR 试剂盒(Applied Biosystems,USA)在Light Cycler®480 序列检测系统(Roche Life Science,Germany) 上检测Bax 和Bcl-2 的mRNA 表达水平。以β-actin 为内参,根据待测基因和β-actin 循环数CT 值,按照公式相对值=2-△△CT计算相关表达。Bcl-2 上游引物:5′-CTTCCGTGATGGGGTCAACT-3′,下游引物:5′-AGGTACTCGGTCATCCAGG T-3′;Bax 上游引物:5′-ATGGACGGGTCCGGGGAGCA-3′,下游引物:5′-CCCAGTTGAAGTTGCCGTCA-3′,β-actin上游引物:5′-CCGGCTTCGCGGGCGACG-3′,下游引物:5′-TCCCGGCCAGCCAGGTCC-3′。
1.7 统计学处理 应用SPSS 18.0 软件对实验数据进行统计分析,计量资料用()表示,两组间比较采用t 检验,多组间比较采用方差分析;计数资料以率(%)表示,比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 三组移植瘤瘤重及体积的比较 30 d 后取各组裸鼠瘤组织称重,Model 组移植瘤瘤重 为(345.14±22.33)mg,Model+R568 组为(231.43±21.24)mg,Model+Calhex231 组 为(415.37±30.01)mg,Model+R568 组的移植瘤瘤重低于Model 组,Model+Calhex231 组的移植瘤瘤重高于Model 组,差异均有统计学意义(P<0.05)。Model+R568 组的抑瘤率为(33.1±3.6)%。在饲养5、10、15、20、25、30 d,测量移植瘤体积,与Model 组比较,Model+R568 组显著抑制肿瘤生长而Model+Calhex231 肿瘤体积显著增加(P<0.05),见表1、图1。
表1 三组移植瘤体积的变化情况比较[mm3,()]
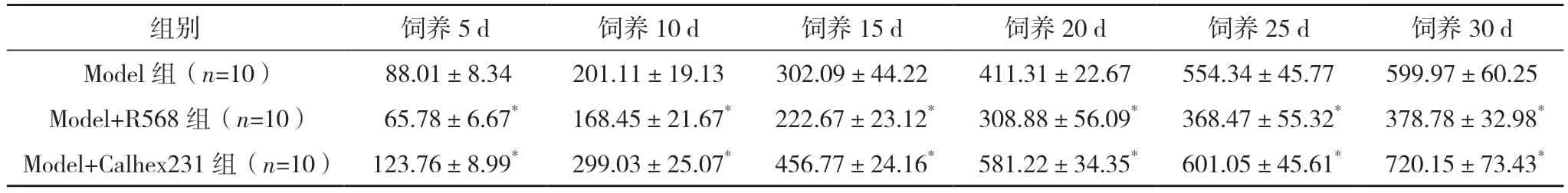
表1 三组移植瘤体积的变化情况比较[mm3,()]
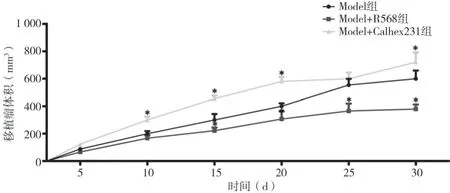
图1 三组移植瘤体积的变化情况比较
2.2 三组裸鼠血清中MMP2 和MMP9 含量比较 Model+R568 组的MMP2 和MMP9 水平均低于Model 组,Model+Calhex231 组的MMP2 和MMP9 水平均高于Model 组,差异均有统计学意义(P<0.05),见表2。
表2 三组裸鼠血清中MMP2和MMP9含量比较[ng/mL,()]
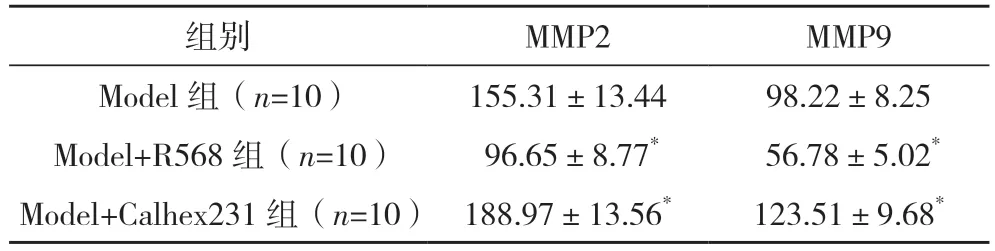
表2 三组裸鼠血清中MMP2和MMP9含量比较[ng/mL,()]
*与Model 组比较,P<0.05。
2.3 三组移植瘤组织中CaSR、E-cadherin 和Bcl-2的表达情况比较 Western blot 测定结果显示,分别以CaSR、E-cadherin 和Bcl-2 与β-actin 的比值为参数,与Model 组比较,Model+R568 组的CaSR 和E-cadherin 蛋白表达均显著增加而Bcl-2 的表达量显著减少,Model+Calhex231 组CaSR 和E-cadherin蛋白表达均显著降低而Bcl-2 的表达量显著增加,差异均有统计学意义(P<0.05),见表3、图2。
2.4 C-33A 细胞在各组增殖和迁移情况比较 将Control 组指标标准化为1 后,与Control 组比较,R568 组细胞活力(0.55±0.04)和迁移速率(0.60±0.17)均显著降低,而Calhex231 组细胞活力(1.38±0.17)和迁移速率(1.42±0.23)均显著增加(P<0.05)。C-33A 细胞迁移统计见图3。
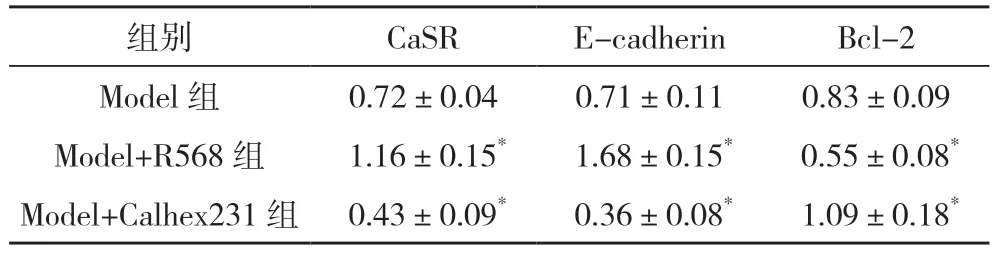
表3 三组移植瘤组织中CaSR、E-cadherin和Bcl-2的表达情况比较(-x±s)
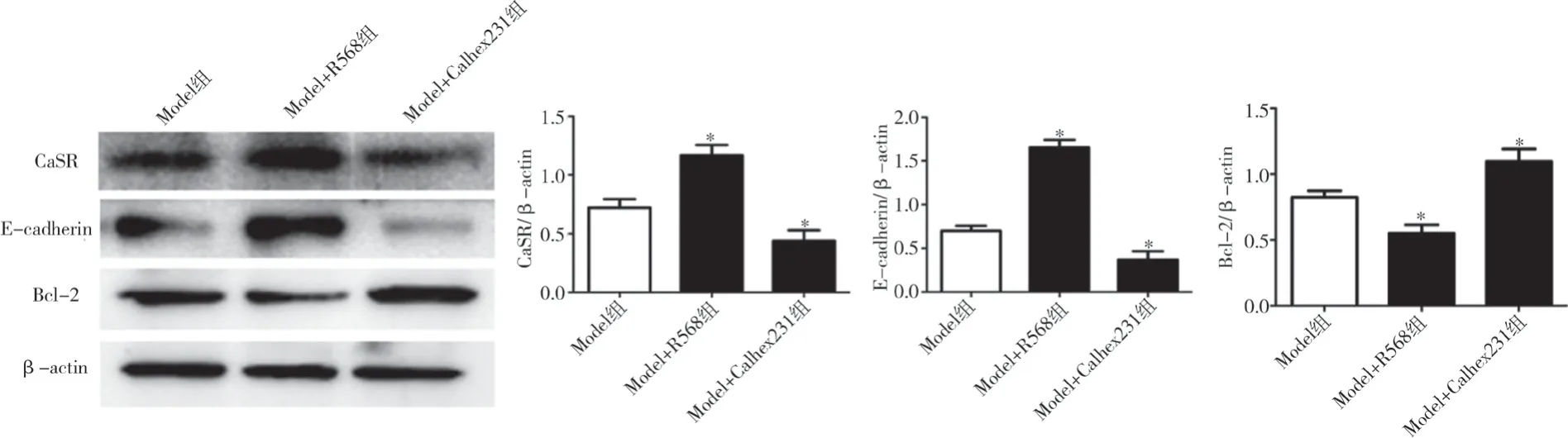
图2 三组移植瘤组织中CaSR、E-cadherin和Bcl-2的表达情况比较

图3 C-33A细胞在三组中的迁移情况比较
2.5 三 组CaSR、Bax、E-cadherin、β-catenin、Bcl-2 和VEGFR3 在C-33A 细胞中的蛋白表达情况比较 分别以CaSR、Bax、E-cadherin、β-catenin、Bcl-2 和VEGFR3 与β-actin 的比值为参数,与Control 组比较,R568 组CaSR、Bax、E-cadherin 和β-catenin 蛋白表达均显著增加而Calhex231 组上述蛋白表达均显著减少,Bcl-2 和VEGFR3 表达趋势与上述结果相反,差异均有统计学意义(P<0.05),见图4、表4。
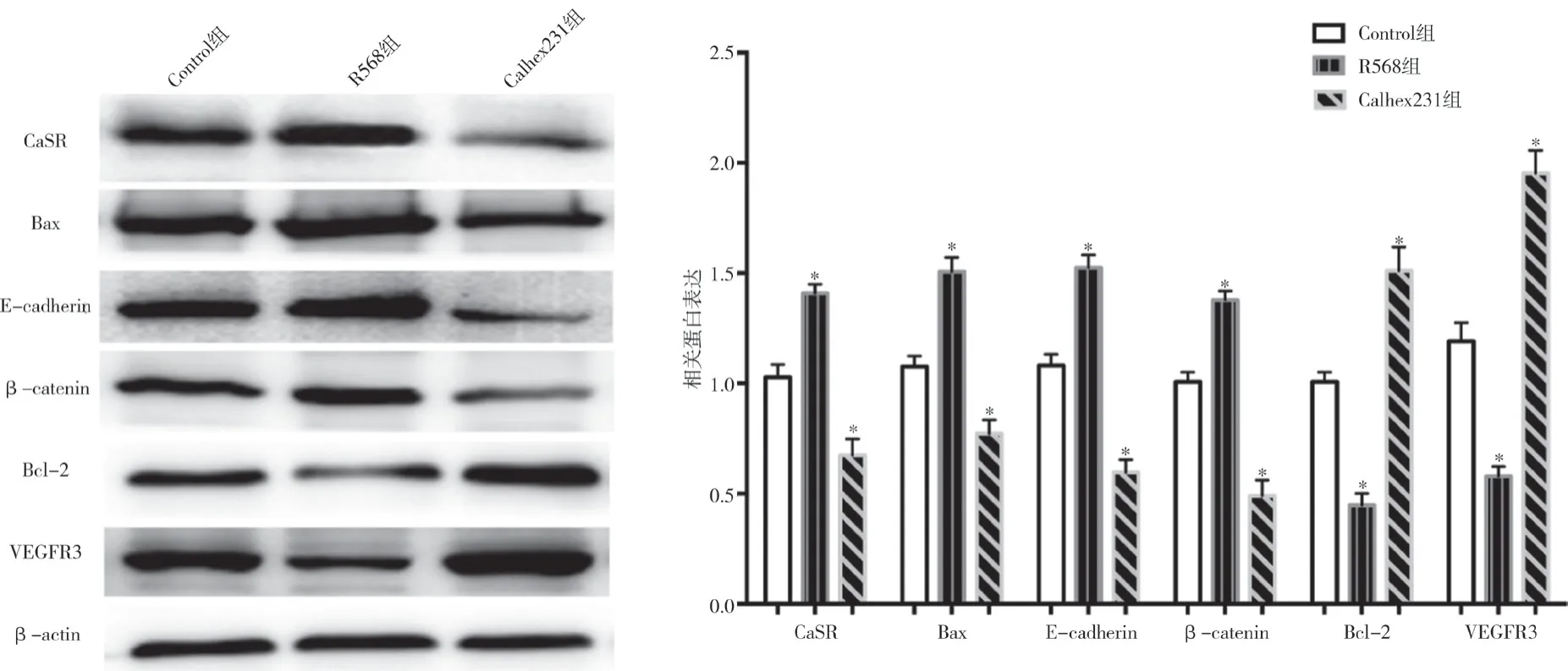
图4 三组CaSR、Bax、E-cadherin、β-catenin、Bcl-2和VEGFR3在C-33A细胞中的蛋白表达情况比较
2.6 三组C-33A 细胞内Ca2+浓度及细胞培养基中MMP2 和MMP9 含量变化情况比较 荧光强度检测结果显示,与Control 组比较,R568 组Ca2+浓度显著增加而Calhex231 组Ca2+浓度显著下降,见表5、图5。ELISA 检测培养基中,与Control 组比较,R568 组MMP2 和MMP9 含量均显著降低而Calhex231 组均显著增加,差异均有统计学意义(P<0.05),见表6。
表4 三组CaSR、Bax、E-cadherin、β-catenin、Bcl-2和VEGFR3在C-33A细胞中的蛋白表达情况比较()

表4 三组CaSR、Bax、E-cadherin、β-catenin、Bcl-2和VEGFR3在C-33A细胞中的蛋白表达情况比较()
*与Control 组比较,P<0.05。
表5 三组C-33A细胞内不同时间点Ca2+浓度比较()

表5 三组C-33A细胞内不同时间点Ca2+浓度比较()

表5(续)
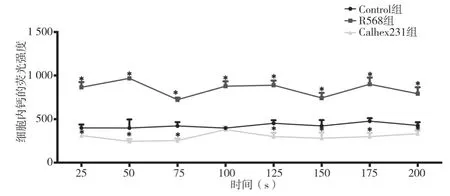
图5 三组C-33A细胞内Ca2+浓度比较
表6 三组C-33A细胞培养基中MMP2和MMP9含量比较[ng/mL,()]

表6 三组C-33A细胞培养基中MMP2和MMP9含量比较[ng/mL,()]
*与Control 组比较,P<0.05。
2.7 三组C-33A 细胞中Bcl-2 和Bax 基因表达情况比较 qRT-PCR 检测显示,与Control 组比较,R568 组Bax 基因表达显著增加而Calhex231 组表达显著减少,Bcl-2 基因表达量与上述结果相反(P<0.05),见表7。
3 讨论
癌症是当今医学最为关注的疾病之一。根据WHO 官方数据统计,2018 年全球新增1 810 万癌症病例,死亡人数达960 万,其中男、女患病比率接近1︰1,死亡比率1︰0.89。可见,女性和男性同样遭受着肿瘤的侵害和困扰[7-9]。宫颈癌是女性最为常见的肿瘤之一,其死亡率在我国一直居高不下。当今医疗策略为早期发现早期治疗效果最好,5 年生存率约65%以上,而晚期和复发性宫颈癌治疗效果极差[10]。宫颈癌目前主要治疗手段仍为化疗和手术治疗,但副作用和手术创伤严重,可见,明确其发病机制和研发有效靶点药物才是关键所在[11]。CaSR 是G 蛋白偶联受体超家族中C 家族成员,在细胞分泌、增殖、分化、趋化、凋亡、基因表达、维持膜电位、离子通道开关、衰老和肿瘤发生发展过程中发挥重要作用[12]。现有文献[12-14]已证实,CaSR 参与心肌缺血再灌注损伤、糖尿病心肌病、心肌梗死和消化道肿瘤等。
表7 三组C-33A细胞中Bcl-2和Bax基因表达情况比较()

表7 三组C-33A细胞中Bcl-2和Bax基因表达情况比较()
*与Control 组比较,P<0.05。
本文为了检验CaSR 表达在宫颈癌发生发展中的作用,笔者制备了C-33A 细胞移植瘤模型。结果显示,R568(CaSR 激动剂)对肿瘤的生长有明显抑制作用。给予裸鼠移植瘤模型组加入Calhex231(CaSR抑制剂)后,移植瘤生长速度明显增加,由此推断CaSR 可能参与此过程。MMP2 和MMP9 为基质金属蛋白酶家族主要成员,其不仅能够破坏基底膜而且能促进肿瘤组织周围血管形成,为肿瘤生长、肿瘤细胞增殖和侵袭提供便利条件[15-16]。ELISA 检测血清和C-33A 细胞培养基结果显示,R568 能够有效降低MMP2 和MMP9 含量水平,而Calhex231 作用相反。CCK-8 细胞活力实验和细胞划痕实验能分别反映细胞的增殖和迁移情况。在实验中,笔者发现R568 有明显抑制C-33A 细胞增殖和迁移的作用。
现有文献报道,当肿瘤细胞中E-cadherin 和β-catenin 蛋白形成复合体后[17-18],能够增加肿瘤细胞黏附性使细胞增殖和迁移减慢;过度的VEGFR3表达能够增加肿瘤周围血管形成,进而供给其充足的生长血运,从而促进其生长和侵袭[19-20]。为明确CaSR 激活后抑制宫颈癌C-33A 细胞增殖和迁移的机制,笔者分别检测了瘤组织和细胞中CaSR、Bax、Bcl-2、E-cadherin、β-catenin 和VEGFR3蛋白表达情况。结果显示,R568 能够上调CaSR、Bax、E-cadherin 和β-catenin 的蛋白表达,下调Bcl-2 和VEGFR3 蛋白表达,Calhex231 有上述相反作用。这一结果和C-33A 细胞中Bcl-2 和Bax 基因表达趋势完全一致。此外,检测C-33A 细胞内Ca2+浓度变化趋势与CaSR 表达也相一致。
综上,据以上实验数据推断如下,CaSR 激活后可增加C-33A 细胞内Ca2+浓度,一方面促进E-cadherin 和β-catenin 蛋白表达并形成复合物,增加肿瘤细胞黏附性从而抑制细胞增殖和迁移;另一方面,抑制VEGFR3 表达能够减少肿瘤周围血管形成,阻止其生长和侵袭。此外,Ca2+浓度升高也可激活促凋亡基因表达诱导C-33A 细胞凋亡,然而,详细分子调控机制还需要后续实验逐一证实。

