影响HSIL宫颈锥切除术后复发的相关性分析
李 静,张 燕,王智宇
子宫颈鳞状上皮内病变(SIL)作为一种较常见女性宫颈病变是子宫颈癌的癌前病变,主要分为低级别子宫颈鳞状上皮内病变(LSIL)和高级别子宫颈鳞状上皮内病变(HSIL),常发生于已婚中年妇女群体,其发病机制为位于宫颈上皮层内的正常细胞逐渐被不同程度异常细胞所代替,从而发展为宫颈浸润癌[1-2]。目前,临床上关于SIL的治疗主要以手术治疗为主,子宫颈锥切术和全子宫切除术为目前临床应用较为广泛的手术方法[3]。由于SIL发病的年轻化趋势,较多患者对手术的要求已从简单的切除病灶开始转向于保护术后生育功能,因此子宫颈锥切术成为目前治疗SIL的主要手段[4]。SIL治疗后复发率各国存在很大差异,文献报道为3.03%~47.30%,其中HSIL为5.00%~25.00%显著高于LSIL[5]。人乳头状瘤病毒(HPV)作为与宫颈癌前病变及宫颈癌感染的重要病毒,被证实和SIL的发生及发展有重要联系,因此可能成为预测HSIL子宫颈锥切术后复发的重要指标[6]。本研究回顾性地分析了我院90例经子宫颈锥切术治疗后HSIL患者临床资料,探讨HPV对HSIL复发风险评估的价值,现将结果报告如下。
1 资料与方法
1.1 一般资料:回顾性分析2017年10月-2019年10月在我院实行子宫锥切术的90例HSIL患者临床资料,按照2组6个月内随访情况将其分为复发组(术后6个月随访期间内出现细胞学异常,且组织学证实有HSIL患者)22例和未复发组(术后6个月随访期间内复查细胞学正常,且经组织学检查无异常)68例,所有患者出院前无手术并发症等明显不良体征,且均被嘱咐参与定期随访。
1.2 纳入标准:①术前均经超声影像学检查,符合《妇产科学》(第8版)[7]对HSIL的诊断;②26~58岁;③均行子宫颈锥切术,且无手术并发症发生;④患者病理资料完整。
1.3 排除标准:①合并心、肝、肾功能异常;②LSIL患者;③未经历性生活女性;④已行全子宫切除术;⑤合并子宫内膜癌、卵巢癌等其他生殖道肿瘤;⑥无法配合参与术后随访患者。
1.4 研究方法:①临床资料整理及收集。比较2组患者年龄、产次、是否绝经、HPV病毒载量、腺体是否累及、切缘是否阳性、随访3个月及6个月高危型HPV阳性情况、是否为可疑浸润癌等临床资料并进行比较;于手术前采用DML2000型HCⅡ基因杂交信号扩大仪对宫颈分泌物中细胞HPV病毒载量进行检测,按照配套的人类乳头瘤病毒-脱氧核糖核酸(HPA-DNA)试剂盒说明书进行裂解、杂交、捕获、信号放大、分析等实验步骤进行操作,并读取相对应的光学单位(RLU);随访3、6个月期间均采用HybriMax医用核酸分子快速杂交仪和配套试剂盒对患者宫颈分泌物进行分型检测,共检测出21种亚型,其中高危型包括HPV-16、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68等16种,检测样本的RLU/界值点(CO)≥1.0即可判定为HPV阳性;切缘阳性的定义为内切缘和外切缘均可见到病灶[8]。②术后随访。90例患者均于术后每个月进行一次实地随访,比较6个月内HPV分型,出现高危型HPV阳性患者建议进行阴道镜检查,对怀疑出现病变部位进行醋酸白实验、碘实验、定位活检、病理学检测,以确定是否为复发。
1.5 观察指标:①比较2组患者年龄、产次、是否绝经、HPV病毒载量、腺体是否累及、切缘是否阳性、随访3个月及6个月高危型HPV阳性情况、是否为可疑浸润癌等临床指标。②将2组有差异信息纳入Logistic回归分析模型,进行量化赋值明确HSIL子宫颈锥切术后复发的危险因素。

2 结果
2.1 影响HSIL患者复发的单因素分析:复发组HPV病毒载量>100、切缘阳性、随访3个月高危型HPV阳性、随访6个月高危型HPV阳性患者比例显著高于未复发组,差异有统计学意义(P<0.05);比较2组年龄、产次、绝经、腺体累及、可疑浸润癌患者比例差异无统计学意义(P>0.05),见表1。
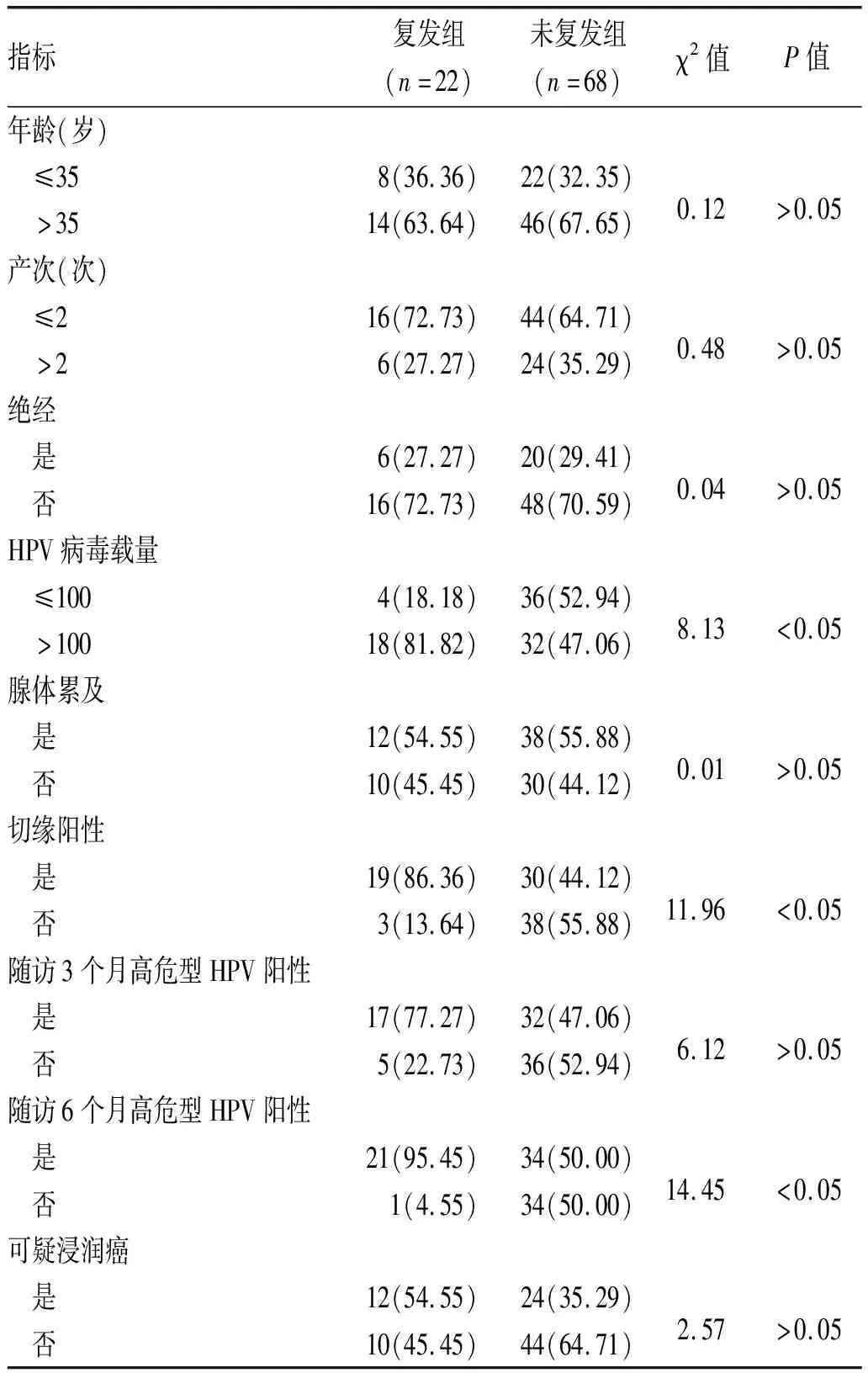
表1 影响HSIL患者复发的单因素分析[n(%)]
2.2 HSIL子宫颈锥切术后复发的多因素Logistic回归分析:将有差异变量纳入Logistic回归分析模型,并进行量化赋值。经Logistic回归分析证实HPV病毒载量>100、切缘阳性、随访3个月高危型HPV阳性、随访6个月高危型HPV阳性是HSIL子宫颈锥切术后复发的危险因素,见表2。

表2 HSIL子宫颈锥切术后复发的多因素Logistic回归分析
3 讨论
有关报道表明,全球每年因宫颈癌死亡人数达到23万,80%发生于发展中国家,并且其发病率以每年3%~5%的速度急剧上升。为此,建立一套较为完整的宫颈疾病普查计划以及时发现并对宫颈癌癌前病变进行治疗成为现代医学的重要课题[9-10]。细胞学检查是HSIL病变进展及复发的主要检测方法,但存在一定的假阴性率,且敏感度不高,可能影响最终检测结果判断[11-12]。而HPV已被证实为导致SIL及宫颈癌发病的重要因素,且不同亚型的HPV感染可能导致宫颈癌发生的风险不同,因此在子宫锥形切除术后随访时进行HPV检验很可能对预测HSIL复发有重要预测价值[13]。
本研究结果显示,2组年龄、产次及绝经、腺体累及、可疑浸润癌患者比例无明显差异,复发组HPV病毒载量>100、切缘阳性、随访3个月高危型HPV阳性、随访6个月高危型HPV阳性患者比例显著高于未复发组,提示HPV病毒载量、切缘阳性率及术后随访期间高危型HPV阳性对预测HSIL术后复发有重要意义。较多研究认为年龄与SIL的发展进程密切相关,原因是随着患者年龄增大,进入绝经期,雌性激素水平下降,宫颈逐渐萎缩,使得患者移行带内移,病变部位也随之移向宫颈管,使得病灶更加隐匿,影响观察及活检取材,且患者免疫功能会随年龄增长而降低,使得患者对生殖道病毒清除能力减弱,较年轻患者更容易再次或持续感染HPV[14]。但本次研究并未显示年龄及绝经状态与复发有明显关系,这可能与病例收集年龄较为集中,年龄差异不足以体现复发差异有关,这也表明,年龄及绝经状态无法作为一种特异性表现来对复发情况进行预测。随着产次增加,宫颈损伤加重,局部免疫状态会随之下降,从而增加复发风险,但本研究也无明显差别,可能是由于本次子宫锥切术均采取超高频电波刀宫颈环切术,对子宫颈组织的创伤较小,不影响患者免疫功能,从而能在一定程度上减少复发发生。随着SIL病理分级升高,病灶呈跳跃性、多中心等生物学生长特性,病变累积象限增多,甚至导致腺体累及,使得病灶范围更大,复发率增高,但本研究也显示无明显差异,这可能与可疑浸润癌患者比例较少有关[15]。
目前大多数临床研究认为HPV载量的增加会促进宫颈癌癌前病变的进展,从而增加复发发生风险。虽然通过子宫锥切手术能清除大部分的HPV病毒,但仅仅根据患者术前相关检查及最终手术范围的选择可能由于视野受限、免疫低下等原因无法完全清除感染HPV的子宫颈病变。当HPV病毒负荷量较高时,可能导致术后残留的HPV感染病灶仍然存在,最终危及周围组织从而复发及进展[16]。关于切缘阳性的定义,目前尚无统一标准。本研究将内、外切缘均受累及定义为切缘阳性,而子宫颈锥切术后切缘阳性的发生可提示手术对病灶切除的不完整,残留在边缘的病灶可能持续存在,甚至进展为浸润性癌[17]。因此临床对于切缘阳性的处理通常根据患者年龄、生育要求及病变程度对下一步治疗方案进行个性化制定。这与郭云霄[18]等的研究相符。
本研究在对患者进行3、6个月随访中检测出16种高危型HPV,其中呈阳性的主要为HPV-16、18、31、33、58、59等6种亚型,这提示HPV-16、18、31、33、58、59等高危型HPV亚型对预测子宫锥切术后HSIL复发有重要预测价值。HPV感染是子宫颈癌前病变及发病进展的必要因素,一过性HPV感染不能说明子宫颈癌前病变的发生风险增高,但同一HPV亚型持续性感染会大大增加子宫颈癌前病变风险[19]。张阳[20]等的研究表明HPV-16、18亚型致癌潜力最强,其在HSIL及宫颈癌患者中被发现感染的发生率为70%~80%,而其术后转阴水平则直接影响未来复发的发生率。HPV分型检测是基于分子生物学基础上的客观性检测,具有统一标准,且不受术后宫颈解剖学改变的影响,较传统的细胞学检测有更高的敏感性。在患者随访时进行相关亚型的阳性率检查,可尽早发现复发潜在风险,从而帮助医师尽早做出应对方案。这与李宁[21]等的研究相一致。

