白喉菌株主要抗原基因遗传稳定性及相应抗原蛋白结构确证的研究
顾 琴, 姬秋彦, 梁疆莉, 高 娜, 李婧妍, 蔡路奎, 史 荔, 孙明波, 马 艳
(中国医学科学院 北京协和医学院医学生物学研究所联合实验室,云南 昆明 650118)
白喉(diphtheria)是一种急性上呼吸道传染病,由革兰阳性白喉棒状杆菌(Corynebacteriumdiphtheria)引起[1], 主要侵犯咽部形成灰白色假膜, 能产生强烈的外毒素, 通过血液循环将毒素扩散, 引起多种器官病变[2]。白喉一直是严重危害广大少年儿童身体健康的主要传染病之一[3], 起病急、进展快, 严重者可出现急性喉梗阻、神经麻痹、中毒性心肌炎、中毒性肾病等并发症而危及生命[4]。接种疫苗是预防白喉最有效、最经济的防控手段。白喉疫苗在研制及生产过程中,原始菌种需经多次传代,建立种子库,工作种子批菌种也需多次传代制备成疫苗。在此过程中,菌种可能会发生变异,从而引起生物学性状的改变。因此,研究菌种的遗传稳定性对于疫苗抗原的稳定性及疫苗的免疫效果有重要影响[5]。之前大多采用一代测序技术对菌种进行核酸序列测序分析基因突变,但一代测序成本高、通量低、无法大规模进行,因此出现了第二代测序技术(next generation sequencing, NGS),NGS具有高通量、高速度、高分辨率和低成本等特点[6-7]。前期使用NGS对百日咳疫苗用菌株进行了遗传稳定性研究,取得较好的结果[8]。在此基础上,本研究采用NGS监测白喉棒状杆菌在传代建库及生产过程中白喉毒素结构基因的突变情况,并采用蛋白免疫印迹技术确证相关蛋白,为疫苗的质量研究提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 白喉棒状杆菌(Corynebacteriumdiphtheria)PW8株CMCC38007购自中国食品药品检定研究院。
1.1.2 培养基 马丁培养基、菌种培养基(2.59% N.Z amine)、产毒培养基(3.33% N.Z amine),均由中国医学科学院北京协和医学院医学生物学研究所溶液组提供。
1.1.3 试剂与仪器 E.Z.N.A.Bacterial DNA Kit(货号E139650)购自美国Omega公司;白喉抗毒素国家参考品(批号0048,一抗)购自中国食品药品检定研究院;辣根酶标记兔抗马IgG(货号PAB9272,二抗)购自Abnova公司。10 L细菌发酵罐(C10-3,德国赛多利斯公司);GelDoc XR Biorad凝胶成像系统(XRS,Bio-RAD公司);SDS电泳仪(P25T,Bio-RAD公司);半干转膜仪(TURBO,Bio-RAD公司)。
1.2 方法
1.2.1 菌种的传代和制备 将白喉棒状杆菌PW8株原始菌种接种至马丁培养基连续传3代,制备主代种子库(P3);主代种子在马丁培养基连续传4代,制备工作种子库(P7);工作种子接种于菌种培养基连续传4代,制备疫苗代次(P12);疫苗代次再在产毒培养基上连续传3代的第3代V3代次(P15)。以上各代次分别留样待检测。
1.2.2 二代测序分析白喉毒素基因稳定性 ①细菌基因组DNA的提取:采用E.Z.N.A.Bacterial DNA Kit分别提取白喉棒状杆菌PW8株主代种子、工作种子、疫苗代次和V3代次的白喉毒素基因组DNA。②DNA测序:将提取的DNA样品送上海源序公司构建DNA文库,并进行白喉棒状杆菌毒素基因二代测序。③序列分析:以Q30的值表示测序质量,质量值越高代表碱基被测错的概率越小,测序可靠性越高。再将测序结果与GenBank中登录的相应序列(基因库登录号为DT:CP003216.1)进行比对,并分析主要抗原序列的碱基突变情况及突变率,特别是与结构和免疫原性相关的重要位点的突变率。
1.2.3 菌株抗原结构确证分析 ①DT结构预测:二代测序后的碱基序列通过DNAMAN软件翻译成蛋白质,再利用Phyre 2 软件预测出白喉毒素结构,该预测结构与文献发表的白喉毒素结构模型进行比对。②蛋白免疫印迹检测:将2018001、2018002、2018003共三批白喉纯化液经电泳后转至PVDF膜上,再与白喉抗毒素国家参考品(1∶400)室温反应1.5 h,PBS-T洗4次;再与辣根酶标记的兔抗马IgG(1∶30 000)室温反应1 h,PBS-T洗4次,加1 mL BeyoECL Plus显色液后于Dynamica凝胶成像系统显色。
2 结果与分析
2.1 主要碱基位点突变率分析
2.1.1 各代次测序可靠性分析 白喉棒状杆菌主代代次和工作代次平均测序长度为150 bp,疫苗代次和V3代次平均测序长度为300 bp;总碱基数均值为7 647×106;Q30值为88.28%~93.96%,见表1。表明本次二代测序结果可靠性较高。

表1 白喉棒状杆菌各代次菌株二代测序数据结果
2.1.2 抗原基因主要位点的突变率分析 白喉棒状杆菌主要抗原全基因序列主代代次最高突变率为A580C 0.46%、A868C 0.46%,这2个位点均位于3个结构区域中的T区(α-螺旋区),属于白喉毒素B肽链,不是主要抗原区域,这2个位点其他代次突变率分别为工作代次A580T 0.47%、A868C 0.39%,疫苗代次A580G 0.43%、A868C 0.32%,V3代次A580C 0.45%、A868C 0.18%;工作代次最高突变率为A580T 0.47%,位于3个结构区域中的T区(α-螺旋区),属于白喉毒素B肽链,不是主要抗原区域,该位点其他代次突变率分别为主代代次A580C 0.46%、疫苗代次A580G 0.43%、V3代次A580C 0.45%;疫苗代次最高突变率为T507G 0.64%,位于3个结构区域中的C区(催化区),属于白喉毒素A肽链,是主要抗原区域,但突变率较低,该位点其他代次突变率分别为主代代次T507G 0.16%、工作代次T507G 0.37%、V3代次T507G 0.49%;V3代次最高突变率为T507G 0.49%,位于3个结构区域中的C区(催化区),属于白喉毒素A肽链,是主要抗原区域,但突变率较低,该位点其他代次突变率分别为主代代次T507G 0.16%、工作代次T507G 0.37%、疫苗代次T507G 0.64%,以上最高突变位点突变率均小于1%,见图1。能影响白喉毒素进入细胞和催化活性的36个碱基位点中,442碱基位点的各代次均比其他位点偏高(0.41%),其他位点均小于0.45%,见图2。
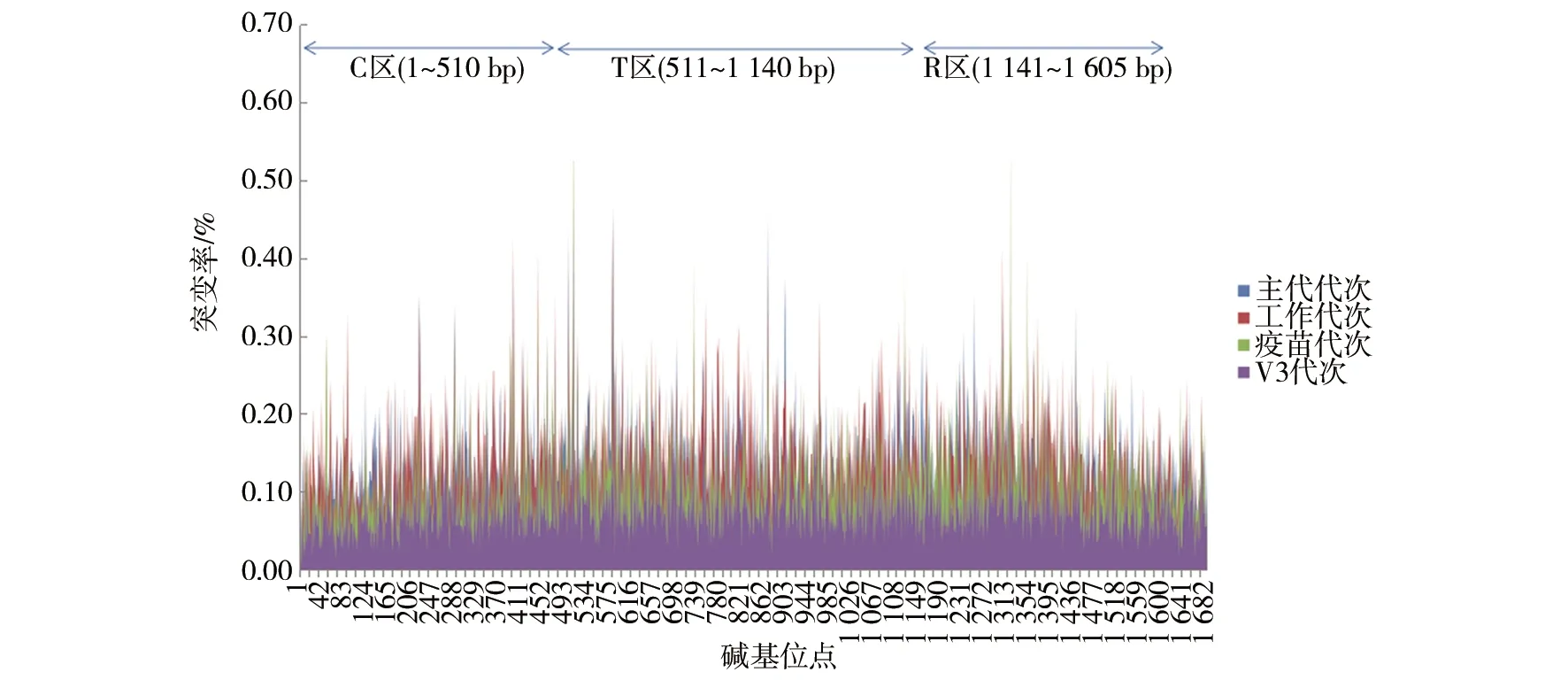
图1 白喉棒状杆菌各代次主要抗原碱基位点突变率

图2 白喉棒状杆菌各代次36个碱基位点突变率
2.2 抗原蛋白结构确证分析
2.2.1 结构预测确证分析 预测结构(图3A)与文献发表的白喉毒素结构模型(图3B)[9]比对分析后发现,两个结构模型均呈现出3个功能区:①C区(催化区):碱基位点为1~510 bp,以α+β-折叠为特征,属于A肽链,有毒性,可使细胞内延伸因子-2(EF-2)失活;②R区(受体区):碱基位点为1 141~1 605 bp,β-胶管状受体区,位于B肽链C末端;③T区(α-螺旋区):碱基位点为511~1 140 bp,中心α-螺旋区,位于B亚单位,酸性条件下介导插入纸质双分子层,帮助A亚基的C区进入细胞质基质。对比后显示:预测模型与文献发表结构模型一致,初步说明白喉毒素蛋白结构正确。
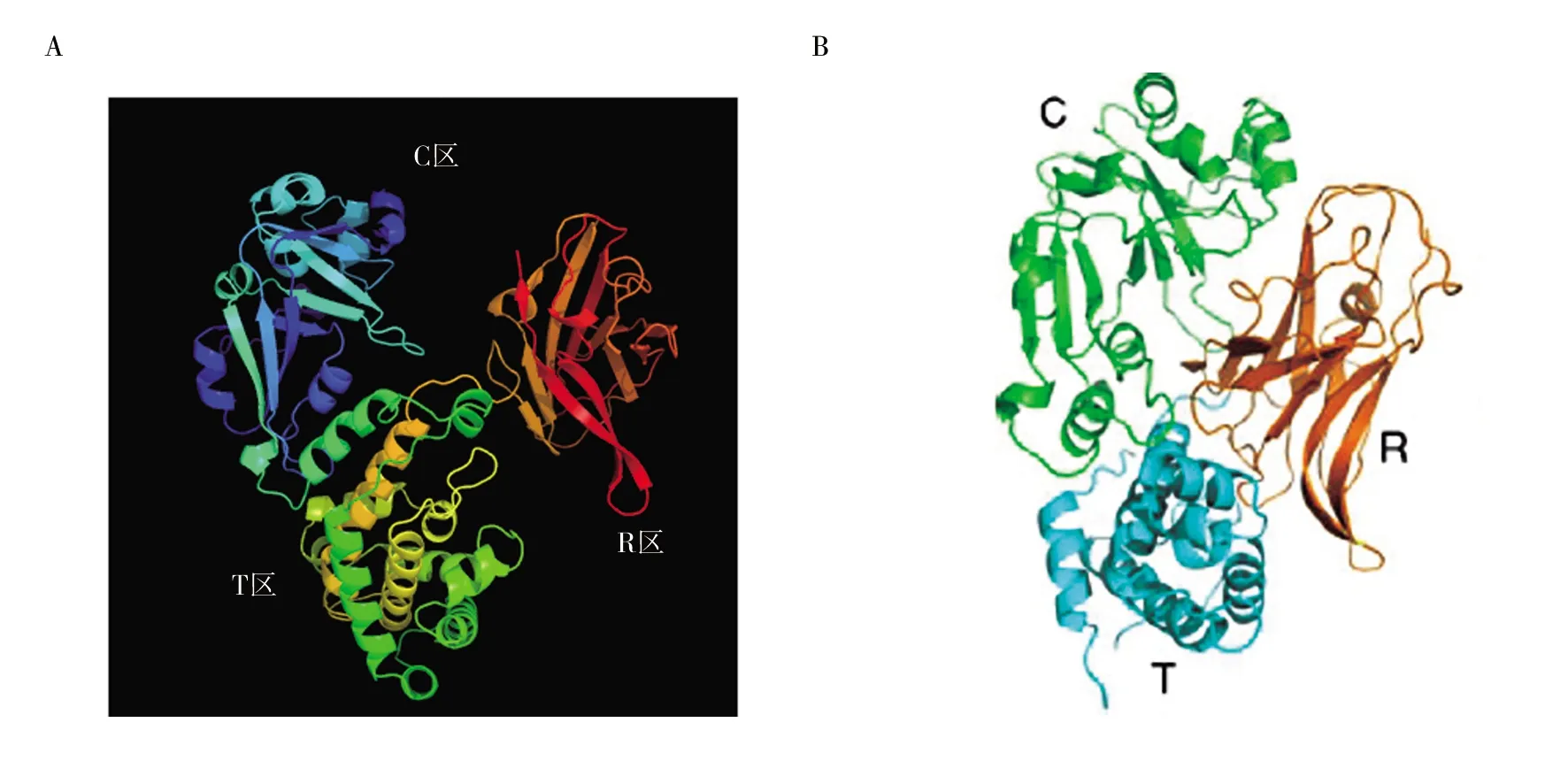
图3 白喉毒素测序预测结构与文献发表结构比较
2.2.2 蛋白免疫印迹(WB)试验结构确证分析 三批白喉毒素纯化液蛋白WB试验中,均在约58 kD处出现印迹条带,蛋白大小与预期一致,且无杂条带印迹,结果见图4。根据一抗是针对白喉毒素的抗体,说明此条带是白喉毒素蛋白,且纯度较高。

图4 白喉毒素蛋白免疫印迹
3 讨 论
本研究对建立的白喉棒状杆菌的主代种子(P3)、工作种子(P7)和疫苗代次(P12)及疫苗代次继续传3代的第3代V3代次(P15),共4个代次菌体的白喉毒素抗原序列进行二代测序,检测该菌株在传代过程中主要抗原基因的突变情况,分析菌种的遗传稳定性。
白喉毒素包含3个结构区:C区(催化区)碱基位点为1~510 bp,属于A肽链,以α+β-折叠为特征;T区(α-螺旋区)碱基位点为511~1 140 bp,位于B肽链;R区(受体区)碱基位点为1 141~1 605 bp均位于B肽链。B肽链C端与细胞表面受体结合,促使白喉毒素(diphtheria toxin,DT)内吞,急速酸化,低pH引起DT结构的改变,并导致空泡型ATP酶质子泵运行,改变结构后的DT在B亚单位的辅助下,插入细胞膜,形成跨膜离子通道,使A亚单位进入细胞质,在细胞质中DT-A在核内体胞浆中进行重折叠,还原二硫键,之后被释放到细胞质中。在细胞质中DT-A催化ADP-核糖由辅酶(NAD)向延伸因子2的转化,由此使蛋白质的合成失活和阻塞,最终使细胞死亡[10]。主要抗原全基因序列主代代次、工作代次最高突变率在白喉毒素B肽链的T区,不是主要抗原区域,疫苗代次、V3代次最高突变率在白喉毒素A肽链的C区,是主要抗原区域,但突变率较低,均小于1%。目前被广泛研究的能影响白喉毒素进入细胞和催化活性的氨基酸位点为21(His)、50(Try)、54(Tyr)、65(Tyr)、143(Glu)、148(Glu)、150(Try)、308(Pro)、349(Glu)、352(Asp)、365(Ile)、508(Ser)[11-16],相对应的碱基位点为61、62、63,148、149、150,160、161、162,193、194、195,427、428、429,442、443、444,448、449、450,922、923、924,1 045、1 046、1 047,1 054、1 055、1 056,1 093、1 094、1 095,1 522、1 523、1 524。这36个碱基发生改变会使相应的氨基酸也发生改变,从而使白喉A肽链的催化活性失活或阻断跨膜过程。其中922、923、924,1 522、1 523、1 524位点碱基与突变株型别相关。因此二代测序结果中,针对这12个氨基酸相对应的36个碱基进行了比对分析后发现,442碱基位点的各代次均比其他位点偏高(0.41%),可能由于碱基偏好性引起,其他位点均小于0.45%。大量事实表明, 细菌在亿万年的进化过程中, 基因组通常是保持相对稳定的,以此来实现种系的繁衍, 但同时也需要一定的变异性来适应环境的变化,即自然突变,自然突变率很低,且无规律性[17-18]。也有研究表明,疫苗菌毒株在合理的生产工艺过程中,一般无基因突变,若不合理的生产工艺,则会造成极高突变率出现[19]。研究中该36个碱基位点及抗原全基因组中,突变率均保持较低水平,且同一个位点不同代次的碱基突变呈不规律性,突变率没有出现随菌株传代代次增加突变率逐渐增高趋势,均呈不规律性,说明传代过程中该36个碱基位点及抗原全基因组遗传较为稳定,也说明了该菌株的低突变率是与菌种本身特性有关。
预测蛋白结构与文献结构比对后显示,预测蛋白二级结构与文献发表结构一致,初步说明白喉毒素蛋白结构正确。蛋白免疫印迹试验能够特异性结合相应的抗体,说明本品白喉毒素蛋白的结构正确。
本研究二代测序结果显示,不同代次的白喉棒状杆菌主要抗原基因突变率较低,特别是主要抗原位点中与催化活性相关的碱基突变率较低,这与之前一代测序结果一致[20];预测结构模型与文献发表结构模型一致,蛋白免疫印迹试验也显示蛋白结构正确。说明建立的白喉棒状杆菌PW8株的主要抗原基因序列在传代过程中,主代、工作代、疫苗代及疫苗后3代的突变率均保持较低的突变水平,遗传较稳定,相对应的蛋白结构正确,为后续进行疫苗研制提供参考。

