一株新分离的猪流行性腹泻病毒变异株的评估
方超,张智明,李建华,何世民
(哈药集团生物疫苗有限公司,哈尔滨150069)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是猪的一种以腹泻、呕吐、后期脱水以至死亡为临床症状,由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的急性、高度传染性肠道疾病。哺乳仔猪的死亡率高是本病的典型特征,死亡率可达到50%~100%,是危害养猪业的一种重要疾病[1-5]。2010年冬季以来,猪流行性腹泻出现变异株,导致PEDV CV777株疫苗免疫效果不理想,不能对免疫猪提供良好的保护,因此,开发猪流行性腹泻变异株疫苗有着十分迫切的现实意义[6-10]。
1 材 料
Vero细胞、MDBK细胞和PK-15细胞,由哈药集团生物疫苗有限公司研发中心传代保存;猪流行性腹泻ZF株F1代,由哈尔滨兽医研究所惠赠;DMEM细胞培养液,购自GIBCO公司;胎牛血清,购自CLARK公司;胰酶,购自GIBCO公司;PBS溶液,由哈药集团生物疫苗有限公司研发中心配制保存;中和抗体效价≥1∶32的猪流行性腹泻阳性血清,由哈药集团生物疫苗有限公司研发中心制备、标定和保存;4~6周龄PEDV血清中和抗体阴性的断奶仔猪3头;牛病毒性腹泻病毒荧光抗体和猪瘟病毒荧光抗体,由哈尔滨兽医研究所惠赠;病毒基因组DNA/RNA提取试剂盒,购自天根生化科技(北京)有限公司;引物由生工生物工程(上海)股份有限公司合成;其他试剂均为国产分析纯。
2 方法
2.1 病毒培养和传代
2.1.1 细胞的复苏与传代
将冻存的Vero细胞从液氮中取出后,立即置于37℃水浴中快速融化。待细胞完全解冻后,1 000 r·min-1离心5 min,弃去上清液,用吸管吸取新配置的细胞培养液,将沉淀轻轻悬起并分散均匀后转至含有10 mL细胞培养液的细胞培养瓶中,置37℃培养箱中培养36~48 h,观察细胞的生长情况,根据细胞的生长复苏状态,可在复苏后24 h进行1次换液。待细胞形成单层后弃去培养液,用无菌PBS溶液轻轻清洗细胞表面2次后,加入0.25%的胰酶短暂消化后弃去胰酶,用适量的细胞培养液轻轻吹打分散均匀,然后按照1∶3~1∶5比例进行传代,置37℃培养箱中培养。
2.1.2 PEDV的接种与收获
待细胞形成单层后,弃去培养液,用无菌PBS轻轻清洗表面2次后,按照2%的接种比例接种含有终浓度为10μg·mL-1胰酶的PEDV ZF株,置37℃培养箱中吸附1 h,期间每隔15 min轻轻晃动1次,最后补加含有终浓度为10μg·mL-1胰酶的无血清DMEM细胞培养液,同时设相同条件的不接毒Vero细胞作为空白对照,置37℃培养箱中培养48~72 h,逐日观察细胞病变(CPE)情况,待细胞病变达到80%以上时,收获培养物,-20℃冻融2次后,备用。按照相同的方法将PEDV ZF株从F1代连续继代15次,各代次病毒在收获后,均-20℃冻融2次后,备用。
2.1.3 病毒含量的测定
将细胞悬液按每孔100μL的量接入96孔细胞培养板,37℃、5%CO2条件下培养48~72 h,待细胞形成单层后,弃去细胞培养液,备用。将收获的病毒液用含有终浓度为10μg·mL-1胰酶的无血清DMEM细胞培养液进行10×的倍比稀释,取10-4、10-5、10-6、10-74个稀释度,每个稀释度接种96孔细胞培养板6孔,每孔100μL。同时设正常细胞对照6孔。置37℃、5%CO2培养箱中培养4~5 d,逐日观察细胞病变。按Reed-Muench法计算病毒的TCID50。正常细胞对照孔应不产生CPE。
2.2 病毒鉴定
2.2.1 血清学鉴定
将PEDV病毒液,按照2.1.3病毒含量的测定结果,用含终浓度为10μg·mL-1胰酶的DMEM无血清培养液稀释成200 TCID50/0.1 mL,分别与等量的猪流行性腹泻阳性血清、阴性血清混合,置37℃水浴作用1 h后,加入96孔细胞培养板中形成细胞单层的6个孔内,同时设正常细胞对照,置37℃、5%CO2培养箱中培养5 d,观察细胞是否出现病变。
2.2.2 分子生物学鉴定
引物的设计与合成。参照中华人民共和国国家标准《猪流行性腹泻病毒RT-PCR诊断技术》(GB/T 34757—2017)中的聚合酶链式反应进行引物合成及PCR检验,扩增315 bp长的片段,引物由生工生物工程(上海)股份有限公司合成。上游引物为5"-TAT⁃GGCTTGCATCACTCTTA-3",下游引物为5"-TT⁃GACTGAACGAACCAACACG-3",按照试剂盒提供的提取核酸的步骤进行操作,将上述提取的核酸进行RT-PCR扩增反应。反转录(20μL体系):模板8.0 mL,通用引物1.0μL,5×Buffer 4.0μL,RNA酶抑制剂1.0μL,DTT 1.0μL,M-MLV 1.0μL,无RNA酶水3.0μL。反转录反应条件:将模板与反转录通用引物混合,置70℃水浴5 min,冰浴后迅速冷却,加入反转录体系的其他试剂,置42℃反转录1 h,然后再95℃终止反应,即得。PCR扩增反应体系(25μL):10×PCR Buffer 2.5μL,dNTP 2.0μL,上游引物1.0μL,下游引物1.0μL,灭菌去离子水17.0μL,DNA模板1.0μL,Taq酶0.5μL。PCR扩增反应条件:95℃预变性5 min;94℃变性30 s,52.5℃退火30 s,72℃延伸30 s,30个循环;72℃延伸10 min;4℃终止循环。将PCR产物于1%琼脂糖凝胶中电泳,在电压5~10 V·cm-1条件下作用30 min,同时与DL 2000 DNA Marker进行比较,即可得出试验结果。
2.3 病毒的纯净性检测
根据《中国兽药典》(2015版,三部)的规定,疫苗的制备过程中需要对毒种的纯净性进行检验。检测的外源病毒主要包括牛病毒性腹泻/黏膜病病毒(BVDV)、猪细小病毒(PPV)、猪伪狂犬病毒(PRV)、猪瘟病毒(CSFV)、猪繁殖于呼吸综合征病毒(PRRSV)、猪圆环病毒Ⅰ型(PCV-1)和Ⅱ型(PCV-2),其中BVDV、CSFV采用中国兽医药品监察所提供的间接免疫荧光法(IFA)进行检测,其余4种病毒使用PCR或RT-PCR方法进行检测。
2.3.1 间接免疫荧光法检测
取最后一次传代收获的PEDV病毒液,用猪流行性腹泻阳性血清中和后,分别接种已经形成单层的MDBK细胞和PK15细胞,37℃培养至少14 d(中间应至少传代1次),并设相应的细胞作为空白对照和BVDV阳性、CSFV阳性对照。最后一次传代的细胞单层培养5 d左右,按照BVDV、CSFV荧光抗体检测说明进行荧光抗体检查。
2.3.2 PCR或RT-PCR法检测
取2.2.2中提取的核酸进行PCR或RT-PCR检测。参照中华人民共和国国家标准《伪狂犬病诊断技术》(GB/T 18641—2002)中的聚合酶链式反应进行引物合成及PCR检验,扩增217 bp长的片段,上游引物为5"-CAGGAGGACGAGCTGGGGCT-3",下游引物为5"-CAGGAGGACGAGCTGGGGCT-3",退火温度56℃;参照中华人民共和国出入境检验检疫行业标准《猪细小病毒病聚合酶链反应操作规程》(SN/T 1874—2007)中的聚合酶链式反应进行引物合成及PCR检验,扩增445 bp长的片段,上游引物为5"-CAGAATCAGCAACCTCAC-3",下游引物为5"-TG⁃GTCTCTTCTGTGGTAGG-3",退火温度为47.9℃;参照中华人民共和国国家标准《猪繁殖和呼吸综合征诊断方法》(GB/T 18090—2008)中的聚合酶链式反应进行引物合成及PCR检验,扩增372 bp长的片段,上游引物为5"-GCGGATCCATGCCAAATAA⁃CAAC-3",下游引物为5"-AGCTCGAGTCATGCT⁃GAGGGTGA-3",退火温度51℃;参照中华人民共和国国家标准《猪圆环病毒聚合酶链反应试验方法》(GB/T 21674—2008)中的聚合酶链式反应进行引物合成及PCR检验,PCV-1型652 bp,PCV-2型1 154 bp长的片段,P1 5"-CCGCGGGCTGGCTGAACTT-3",P2 5"-CTCGGCTATGCGCTCCAAAATG-3",P3 5"-ACCCCCGCCACCGCTACC-3",退火温度62℃。引物由生工生物工程(上海)股份有限公司合成。
2.4 无菌检验与支原体检验
根据《中国兽药典》对病毒液进行无菌检验和支原体检验。
2.5 病毒的遗传稳定性测定
在疫苗的制备过程中,病毒的遗传稳定性非常重要,因此对PEDV进行了遗传稳定性检测。取2.1.2中连续培养传代的PEDV ZF株F6代、F11代和F16代病毒液,按照2.2.2中所述的核酸提取以及反转录方法进行核酸提取和反转录,对反转录的cDNA进行病毒的遗传稳定性分析。由于PEDV S蛋白是重要的免疫原性蛋白,因此选择S基因的部分序列进行。参照李衡[11]的研究结果合成扩增PEDV S部分基因的引物,上游引物为5"-GGTAAGTTGCTAGTGCG⁃TAA-3",下游引物为5"-CAGGGTCATCACAATA⁃AAGAA-3",目的片段大小为1 461 bp,引物由生工生物工程(上海)股份有限公司合成。PCR扩增反应体系(25μL):10×PCR Buffer 2.5μL,dNTP 2.0μL,上游引物1.0μL,下游引物1.0μL,灭菌去离子水17.0μL,DNA模板1.0μL,Taq酶0.5μL。PCR扩增反应条件:95℃预变性5 min;94℃变性30 s,51℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min;4℃终止循环。将PCR产物于1%琼脂糖凝胶中电泳,在电压5~10 V·cm-1条件下作用30 min,在凝胶成像系统下观察并切割目的片段,直接送往生工生物工程(上海)股份有限公司进行测序,测序的结果用DNA Stars软件进行分析。
2.6 病毒致病力的测定
取最后一次传代收获的PEDV病毒液,根据病毒含量测定的结果稀释到1×106.0TCID50·mL-1,备用,进行病毒致病力的测定。用4~6周龄的PEDV血清抗体阴性的断奶仔猪2头,每头猪经口服2.0 mL备好的PEDV病毒液。同时另设1头猪作为不接毒空白对照,相同条件隔离饲养。试验开始后观察14 d,每天就试验猪的精神状态、采食量、腹泻情况、死亡等临床症状进行观察和记录。
3 结果与分析
3.1 病毒培养和传代的结果
PEDV ZF株接种Vero细胞后,在24 h左右Vero细胞出现膨大、变圆等轻微的细胞病变,随着接毒时间的延长,病变逐渐明显,表现为细胞变圆、膨大、出现空泡以及细胞脱落,最终使得细胞单层裂解。待细胞病变达到80%及以上时,收获培养物;相同条件培养的对照细胞仅出现细胞颗粒增多等细胞老化的现象,结果见图1。
3.2 病毒含量的测定结果
将PEDV ZF株F1代在Vero细胞上连续传代15次,每个代次均进行病毒含量的测定,测定结果见表1。由表1可知,PEDV ZF株在连续传代的过程中,对细胞的适应性稳定,各个代次的病毒含量无明显差异。

图1 PEDV的细胞培养结果
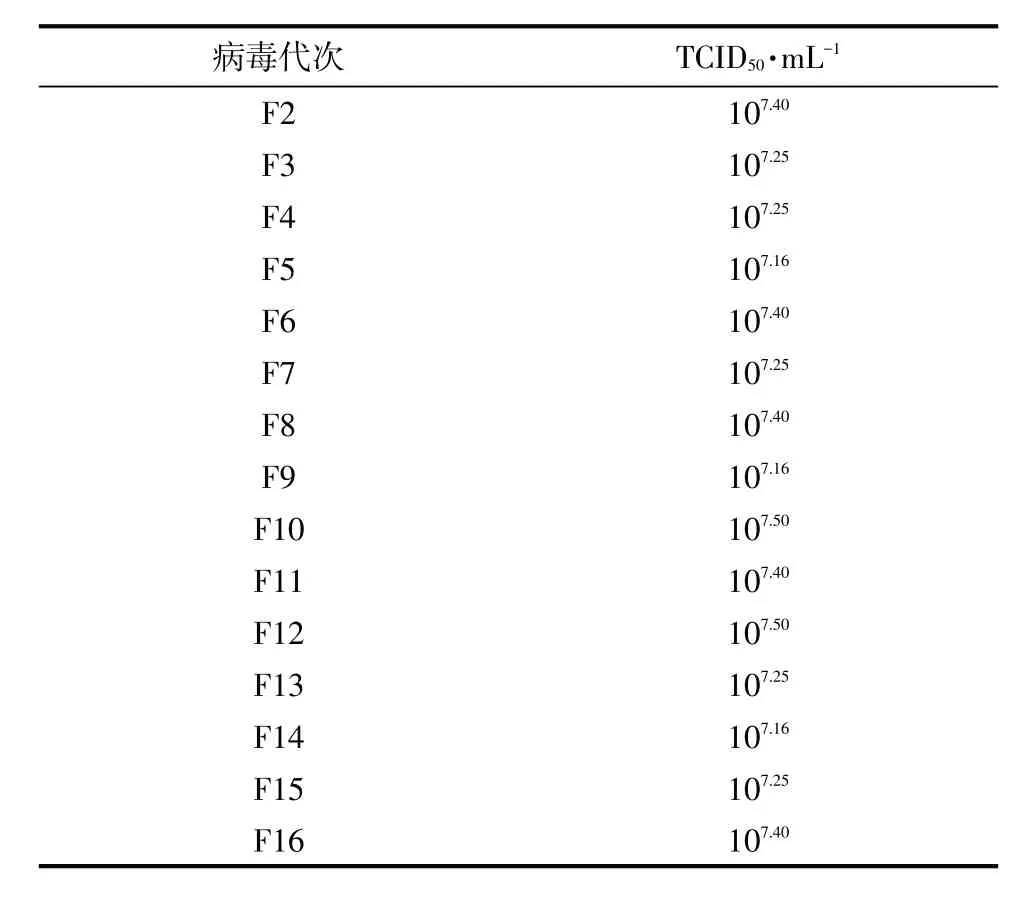
表1 PEDV ZF株不同培养代次病毒含量测定结果
3.3 病毒鉴定
3.3.1 病毒的血清学鉴定结果
取最后一次传代收获的PEDV病毒液,进行病毒的血清学鉴定。结果表明该代次PEDV ZF株可被猪流行性腹泻病毒阳性血清完全中和,接种的Vero细胞观察5 d不产生细胞病变,病毒特异,结果见表2。

表2 血清学鉴定结果
3.3.2 病毒的RT-PCR鉴定结果
取最后一次传代收获的PEDV病毒液,进行PEDV的RT-PCR法鉴定,结果见图2。结果表明PCR能扩增出片段大小为315 bp左右的条带,与引物设计扩增目的条带的大小一致。
3.4 病毒的纯净性鉴定结果
3.4.1 间接免疫荧光法检测结果
取最后一次传代收获的PEDV病毒液,用猪流行性腹泻阳性血清中和后,分别接种已经形成单层的MDBK细胞和PK15细胞,进行外源病毒BVDV和CSFV的检测。结果表明,PEDV病毒液中BVDV、CSFV两种外源病毒检测结果均为阴性,结果见图3和图4。

图2 PEDV RT-PCR鉴定结果

图3 BVDV间接免疫荧光检测结果

图4 CSFV间接免疫荧光检测结果
3.4.2 PCR或RT-PCR法检测结果
取最后一次传代收获的PEDV病毒液提取的核酸,进行病毒液中PRV、PPV、PRRSV和PCV的PCR或RT-PCR检测。结果表明,在PEDV病毒液中,PRV、PPV、PRRSV和PCV的检测结果均为阴性,结果见图5。

图5 PEDV外源病毒检测结果
3.5 PEDV病毒液无菌检验及支原体检验结果
取最后一次传代收获的PEDV病毒液按照《中国兽药典》要求进行无菌检验及支原体检验。结果见表3和表4。结果表明PEDV病毒液没有被细菌、霉菌、支原体等污染。
3.6 病毒的遗传稳定性测定结果
分别取PEDV ZF株培养收获的F6代、F11代和F16代病毒液,进行PEDV S蛋白部分基因的扩增,结果见图6。

表3 无菌检验结果

表4 支原体检验结果
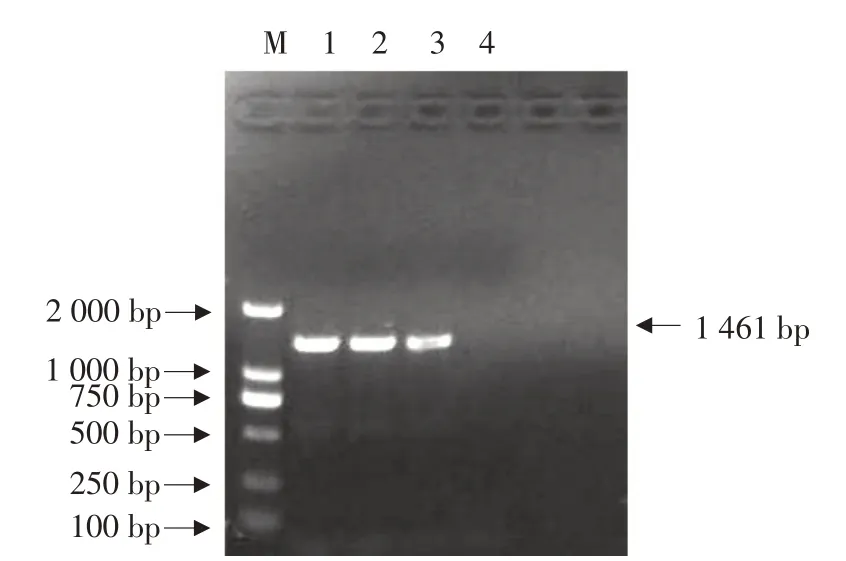
图6 PEDV S蛋白部分基因的扩增结果
将扩增的片段经胶回收后送生工生物工程(上海)股份有限公司进行测序。将测序结果用DNA Star软件包MegAlign的Clustal W进行比对,结果PEDV ZF株F6代、F11代和F16代的S蛋白部分基因的同源性在99.8%以上,病毒的遗传稳定性良好。结果见图7。
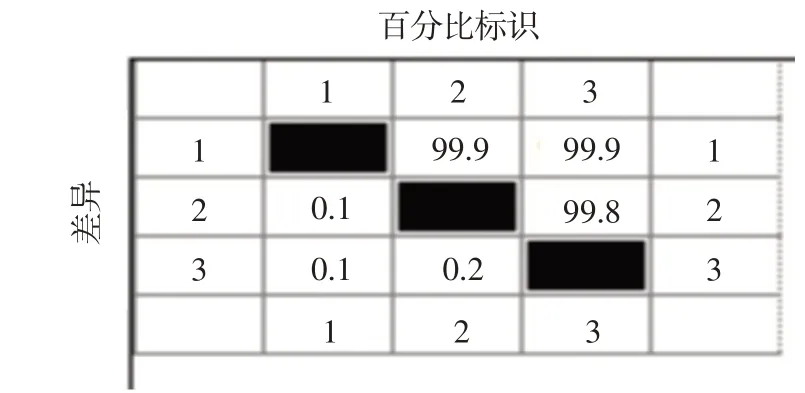
图7 PEDV ZF株不同代次S蛋白部分基因序列比对结果
3.7 病毒致病力的测定结果
取最后一次传代收获的PEDV病毒液对4~6周龄的PEDV血清抗体阴性的断奶仔猪进行攻毒,进行病毒致病力的测定,并在攻读后每天对试验猪的精神状态、采食量、腹泻情况、死亡等临床症状进行观察和记录。结果攻毒的2头猪在24 h后出现轻微的腹泻、精神不振以及食欲减退等症状。随着时间的延长,攻毒的2头猪临床症状加重,出现水样腹泻、肛门及后肢粪便污染严重、四肢无力、站立不稳以及被毛粗糙、没有光泽等症状,7 d内有1头猪出现死亡,对死亡猪进行解剖,发现肠壁变薄、变透亮、出血,肠道内充满气体并含大量黄色内容物,见图8。未攻毒对照仔猪食欲正常,精神状态良好。
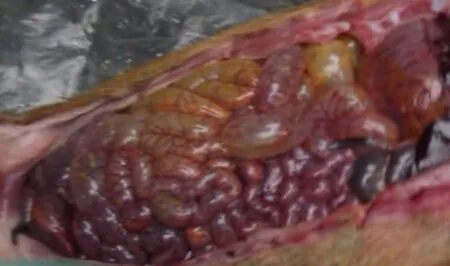
图8 攻毒猪剖检结果
4 结论
为了能更好地应对由PEDV变异株感染引起的猪流行性腹泻,本试验对已经分离鉴定的PEDV变异株进行细胞适应性、病毒含量、纯净性、遗传稳定性及致病力的检验,证明该毒株的细胞适应性好、病毒含量高、病毒纯净、遗传稳定以及致病力良好,可以作为制备预防PEDV变异株灭活疫苗的候选疫苗株,为后期疫苗的制备做好铺垫。

