组蛋白修饰在破骨细胞分化中的作用
谢保平 黄立慧 钟佳宁*
1.赣南医学院心脑血管疾病防治教育部重点实验室,江西 赣州 341000 2.赣南医学院第一附属医院,江西 赣州 341000
破骨细胞(osteoclast,OC)是骨骼中唯一具有骨吸收功能的多核巨细胞[1]。OC通过分泌酸性水解酶和蛋白水解酶来溶解骨骼中的矿物质和细胞外基质,常作为骨代谢疾病临床治疗和药物研发的靶细胞[2-3]。组蛋白修饰是调节OC分化最重要的表观遗传调控方式之一[2]。组蛋白修饰是指组蛋白在酶作用下发生甲基化、乙酰化、磷酸化、腺苷酸化和泛素化等修饰的过程。近年来,越来越多的研究表明组蛋白修饰在骨代谢疾病的发生和发展,以及OC分化中扮演了重要的角色[4-5]。本文对组蛋白修饰在OC分化中扮演的角色进行综述,为组蛋白修饰抑制剂在骨代谢相关疾病中的研发和临床运用提供指导。
1 破骨细胞生物学特性
骨量保持动态平衡的状态是OC和成骨细胞(osteoblast,OB)严格调控的结果,OB和骨细胞 (osteocyte,OS)分泌的M-CSF和RANKL是促进OC分化的必须因子[6]。OC是来源于造血干细胞的巨型多核细胞,是骨骼中唯一具有骨吸收功能的细胞[7]。成熟的OC通常具有3个以上细胞核、锯齿状褶皱膜边缘和伪足,当OC的褶皱膜边缘与骨骼接触时,褶皱膜吸附在骨骼表面,OC释放蛋白水解酶溶解矿物质和细胞外基质,从而形成骨吸收陷窝[8]。从多能干细胞到特异性终末分化细胞的发展涉及多种基因表达和细胞因子的精确调控,从而调控OC按照特定的时空顺序分化[2](图1)。早期用于科学研究的OC来源于新生鼠的头盖骨中,该分离方法具有操作简单和成本低的特点,但是分离纯度限制了OC分化和功能的研究。目前,用于体外诱导OC分化的体系包括RAW264.7[9]、骨髓间巨噬细胞(BMMs)[10]、造血干细胞、成骨细胞和骨髓单核细胞共培养[11]和CD14+PBMCs[12]。
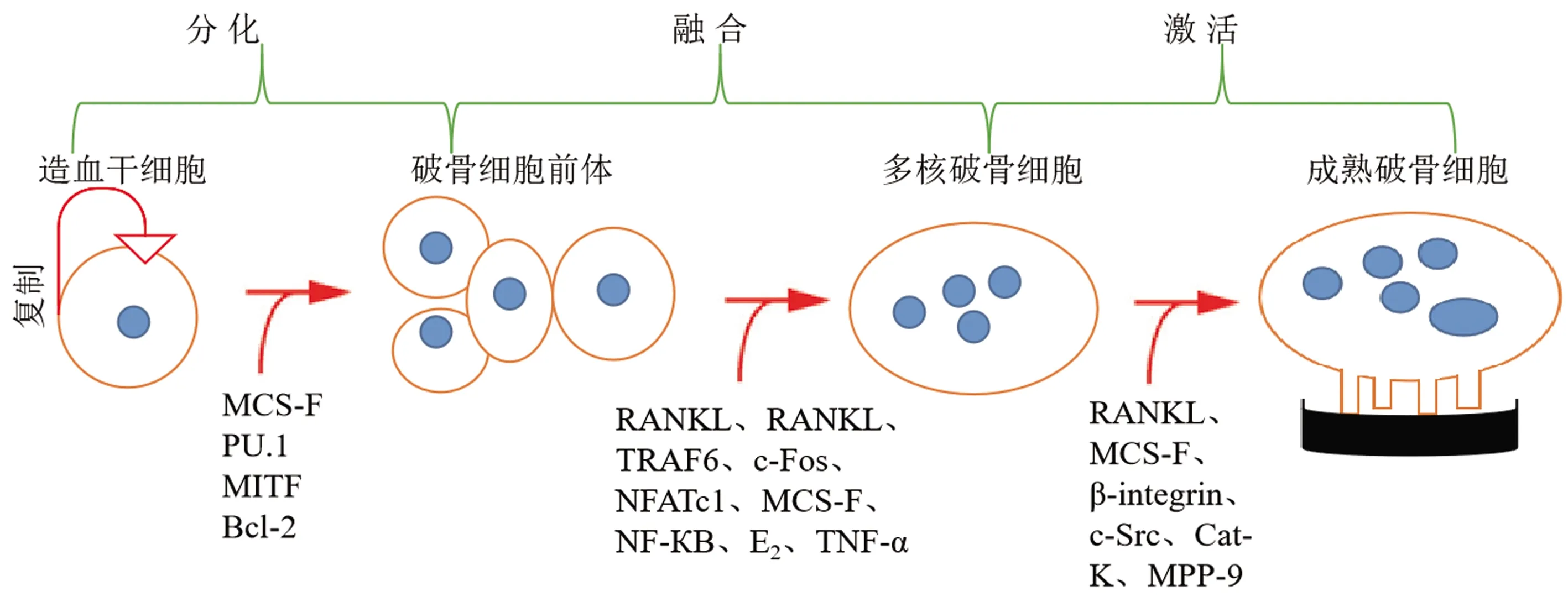
图1 破骨细胞分化和激活的示意图Fig.1 Schematic diagram of osteoclast differentiation and activation
2 组蛋白修饰与OC分化
组蛋白是细胞核内序列高度保守的蛋白质,包括H1、H3、H2A、H2B和H4等5种。组蛋白修饰通过影响染色质的结构和松弛程度,调控基因转录和翻译,从而影响相关疾病的发展[13-14]。
2.1 组蛋白乙酰化与OC分化
组蛋白乙酰化常发生在组蛋白尾部赖氨酸氨基端,主要包括H3K9、H3K14、H3K18、H3K23、H4K5、H4K8、H4K12和H4K16 等修饰位点[15]。组蛋白乙酰化是在组蛋白乙酰化酶 (histone acetyltransferases,HATs)作用发生下的,HATs包括HAT1、PCAF/Gcn5、MYST、p300/CBP和Rtt109 等5个亚族[16]。乙酰基与组蛋白赖氨酸残基上的正电荷结合,降低组蛋白和DNA之间的相互作用,从而调控基因的表达[17]。
2.2 组蛋白去乙酰化与OC分化
组蛋白去乙酰化修饰主要是受去乙酰化酶(histone deacetylase,HDAC)调控。人类基因组中有18个HDAC,根据它们的酶活性和在细胞内的位置,可将它们划分为4个不同的类别:I类HDAC(HDAC1-3,8)、Ⅱ类HDAC(HDAC 4-7、9、10)、Ⅲ类HDAC(Sirtuins1-7)和IV类(HDAC11)等[21]。
2.2.1I类HDAC与OC分化:I类HDAC主要位于细胞核内,它们都含有第I类HDACs特有的催化结构域。Kim 等[22]研究表明HDAC1作为OC分化中的抑制因子,通过募集到OC相关基因Nfatc1和Oscar的启动子,抑制OC分化。Pham 等[23]研究发现敲除HDAC3基因显著抑制OC分化和OC相关基因Nfatc1、Ctsk和Dc-stamp的表达。有文献报道HDAC8在OC分化早期表达低,在OC分化晚期表达增加,提示HDAC8可能是OC分化的促进因子[24]。
2.2.2Ⅱ类HDAC与OC分化:Ⅱ类HDAC主要包括:HDAC4、HDAC5、HDAC6、HDAC7、HDAC9、HDAC10等6种。有文献报道HDAC5在OC分化后期表达,且在OC融合前后表达量最高,与HDAC4类似,shRNA沉默HDAC5可导致OC数量增加,OC分化相关基因表达和骨吸收显著上调[25]。Wein等[26]报道HDAC5敲除的小鼠在2~3个月鼠龄时小梁骨密度降低。Jin等[27]研究表明HDAC7在OC分化末期表达量较低,且降低HDAC7含量显著促进OC分化,且在RANKL作用下,HDAC7抑制β-catenin和cyclin D1表达,提示HDAC7是OC分化的负性调节子。
2.2.3Ⅲ类HDAC和IV类HDAC与OC分化:Ⅲ类HDAC和IV类HDAC主要包括:Sirt1、Sirt2、Sirt3、Sirt4、Sirt5、Sirt6、Sirt7和HDAC11等8种。研究表明Sirt1通过RANKL信号通路抑制OC的分化,且抑制Sirt1表达显著增加OC数目和活性,上调FOX蛋白乙酰化水平[28]。Jing等[29]报道Sirt2对OC分化具有促进作用。Huh等[30]研究发现Sirt3敲除的小鼠OC数量显著增加,骨质减少和骨密度降低,且Sirt3的表达依赖于转录激活因子PGC-1β和核受体ERRα,Sirt3敲除的小鼠AMPK磷酸化水平显著降低,提示Sirt3通过AMPK-PGC-1β轴负性调控OC分化和功能。Yan等[31]研究表明在BMMs分化为OC的过程中,Sirt1的表达显著下调,miR-506的表达显著上调,生物信息学预测结果和双荧光素酶报告基因检测提示miR-506靶向结合Sirt1 3'-UTR,提示去乙酰化酶可作为MiRNA的作用靶点调控OC的分化。Blixt等[25]证实HDAC Ⅱ和IV类在OC分化过程中有差异表达,用shRNA沉默HADC4、5、9、10和11的表达,促进OC的分化和成熟,增加骨吸收活性,上调OC相关基因c-Fos、Nfatc1、Dc-stamp和Cathepsin k的表达,提示Ⅱ和IV类HDAC蛋白可能是破骨细胞分化的负性调节因子。综上,不同的HDAC对OC分化产生不同的影响和作用机制。
2.3 组蛋白去乙酰化酶抑制剂与OC分化
组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors,HDACi)是一种具有抗骨质疏松症和关节炎作用的小分子化合物(如表1)。Kim等[32]研究表明I类HDACi MS-275通过抑制c-Fos蛋白的表达抑制OC分化,促进OB形成,动物实验证实MS-275对IL-1介导的小鼠颅骨骨丢失具有保护作用,提示MS-275通过调节OC和OB功能平衡发挥抗骨质疏松作用。Cantley等[33]用微计算机断层扫描和组织学分析技术检测橄榄油、HDACi MS-275和1179.4b处理小鼠牙周炎中牙槽骨的变化,与对照组相比,1179.4b显著减少骨丢失,骨体积增加3.4%,且比MS-275更有效。Guo等[36]研究发现HDACi CI-994显著抑制OC分化和骨吸收活性,下调ACP5、CTSK、NFATc1、c-Fos、DC-STAMP 和 V-ATPase-d2基因的表达,以及NF-κB亚基IκBα和 p65的磷酸化水平,提示CI-994通过NF-κB和下游c-Fos/NFATc1信号通路调节OC分化。
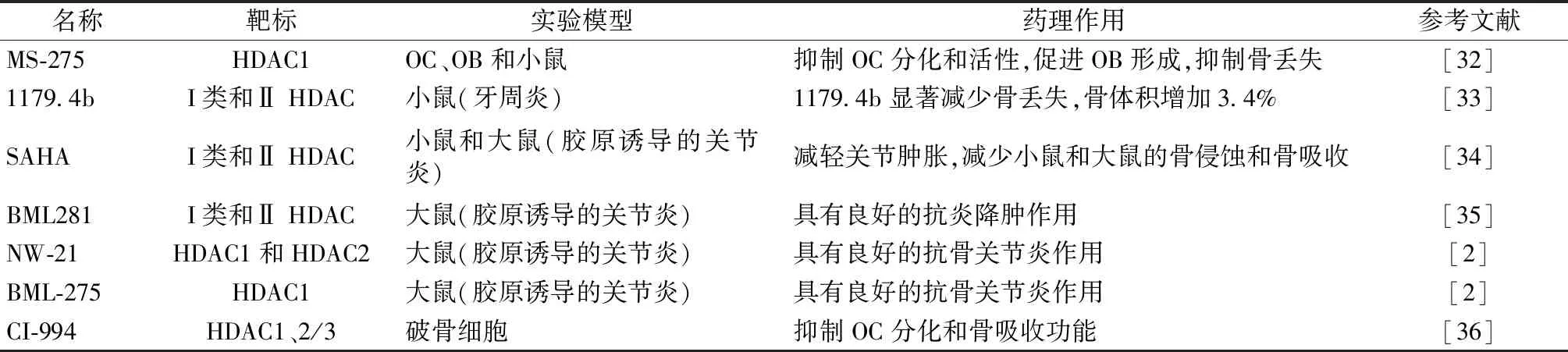
表1 HADCi与OC分化Table 1 HADCi and osteoclast differentiation
2.4 组蛋白甲基化与OC分化
组蛋白甲基化常发生在组蛋白末端赖氨酸和精氨酸残基上,包括H3K9、H3K27、H4K20、H3K4、H3K36、H3K79和H3R17等位点,且H3K9、H3K27和H4K20的甲基化常与基因转录抑制有关,而H3K4、H3K36、H3K79和H3R17的甲基化则与基因转录激活密切相关[37-38]。
组蛋白甲基化转移酶包括SET、PRMT和DOT1家族等3个亚群,越来越多的证据表明组蛋白甲基化参与OC分化的调控[39]。Das等[40]研究发现组蛋白甲基化调节子PTIP通过促进OC分化来维持骨髓完整性和正常造血功能。Gao等[41]报道H3K79甲基转移酶DOT1L是组蛋白甲基化重要的调控因子,在OC分化过程中,DOT1L表达和H3K79甲基化水平显著上调,沉默或抑制DOT1L活性显著促进OC分化,增加去卵巢小鼠骨表面OC面积和骨丢失水平,提示DOT1L是介导的OC分化的新靶点。Kim等[42]报道H3K27me1对于MMP-9依赖性H3 N末端蛋白水解至关重要。Fang等[43]报道组蛋白甲基转移酶EZH2通过下调OC形成的负调控因子IRF8来促进OC分化。
2.5 组蛋白去甲基化与OC分化
组蛋白去甲基化是在去甲基酶的作用下脱去甲基的一种修饰方式,去甲基酶包括KDMs 和JMJD家族。近年来,有研究表明组蛋白去甲基化修饰在骨代谢疾病的调控具有重要的地位[44],特别是在OC分化领域(如表2)。Lee等[45]研究发现,Kdm3C敲除导致小鼠在诱发实验性牙周炎或牙髓暴露后牙槽骨破坏增加,且从Kdm3C 敲除小鼠中分离的BMMs增强了OC的形成,KDM3C的耗尽促进暴露于Pg LPS的细胞中p65的磷酸化和核易位加速,提示Kdm3C通过NF-κB信号通路促进OC分化。Liu等[46]报道在OC分化过程中,Jmjd7的表达显著下调,且沉默Jmjd7的表达,可促进OC相关基因c-fos、Dc-stamp、CtsK、Acp5和Nfatc1的表达,以及骨吸收活性,提示Jmjd7可能作为调节OC分化和溶骨活性的负调控因子。
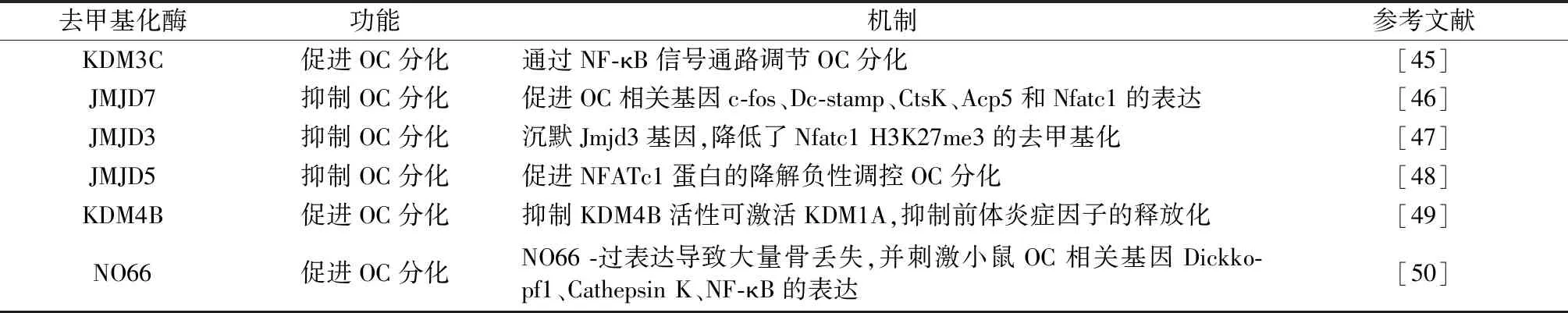
表2 组蛋白去甲基化酶与OC分化Table 2 Histone demethylase and osteoclast differentiation
2.6 其他组蛋白修饰与OC分化
其他组蛋白修饰在OC分化领域的研究相对较少。Obri等[51]证实PTH通过Smurf2调节HDAC4泛素化促进RANKL表达,从而促进OC分化,其中Smurf2是泛素化调节因子。Kaneki等[52]发现TNF显著上调OB前体和原代成骨细胞中Smurf1和Smurf2的表达,增加了内源性Runx2蛋白的降解,其中Runx2是一种OB特异性转录因子,提示组蛋白泛素化在骨代谢疾病中扮演了重要的角色。
3 小结
骨稳态取决于OC和OB功能的平衡,这种紧密耦合过程的失衡会导致骨代谢疾病。 因此,探寻调节OC分化的机制对于骨代谢疾病的防治至关重要。组蛋白修饰通过调节OC分化关键因子和信号通路影响OC分化过程,并发生在OC分化和成熟的全过程,特别是在OC分化关键信号通路RANKL[53]和NF-κB[36]上,故针对组蛋白修饰小分子抑制剂抗骨代谢疾病的药物研发将成为新的热点。

