混合盐胁迫对急性子萌发生理活性的影响
邵玫钰 孙静漪 王辉 吴越程 季天智 陈灿宇 袁强 睢宁
浙江中医药大学药学院 杭州 310053
急性子为凤仙花科植物凤仙花(Impatiens balsamina L.)的干燥成熟种子,具有破血、软坚、消积的作用,临床上多用于癥瘕痞块、经闭、噎膈等症[1]。现代临床治疗食管癌吞咽困难常以芍药甘草汤为主方,其中正是以威灵仙、急性子等软坚散结[2]。凤仙花为常见的园林花卉,在我国各地庭院广泛栽培,急性子具有较强的土壤适应性和抗逆性,栽培管理方便[3-4],但目前土壤盐碱化现象日益严重,对植物生长造成较严重的影响。本研究探讨不同混合盐胁迫对急性子种子萌发生理活性的影响,确定急性子能够生长的盐浓度,为急性子在盐碱土壤中栽培提供理论依据。
种子是植物体中含水量最低的器官,为种子提供水分是植物生长的第一步,种子萌发过程中的水分情况、生理生化指标与其生命征象密切相关[5]。混合盐对植物有水分胁迫和离子毒性,而水分胁迫与种子萌发过程中的呼吸作用也有密切关系[6],从而影响种子萌发。种子是种子植物所特有的延存器官,急性子为凤仙花的干燥成熟种子,了解急性子萌发过程中的生理生化变化,就能更好地提高其萌发率和田间出苗整齐度[7]。
盐类是植物生长代谢过程中的必需物质,但是过量的盐分会改变细胞的渗透势,影响植物对水分的吸收,从而造成植物体的生理干旱,降低植物生物量的积累[8]。盐胁迫是影响种子生长、降低产量的主要环境问题之一[5],因此本实验以急性子为研究对象,考察不同浓度混合盐胁迫对种子萌发生理活性的影响,阐明急性子的耐盐机制,为今后急性子栽培的土壤选择、范围扩展以及科学栽培提供依据。
1 材料和方法
1.1 实验材料和试剂 急性子为凤仙花科植物凤仙花(Impatiens balsamina L.)的干燥成熟种子,购于浙江磐安。无水乙醇购于天津市科密欧化学试剂有限公司(批号:20160414);硫酸购于西陇科学股份有限公司(批号:1610091);葡萄糖购于上海强顺化学试剂有限公司(批号:20141211);间苯二酚购于上海麦克林生化科技有限公司(批号:C10102717);牛血清蛋白购于浙江天杭生物科技股份有限公司 (批号:20161207);蒽酮购于上海展云化工有限公司(批号:160115);四唑氮蓝购于杭州昊天生物技术有限公司(批号:3068B512); 植 物丙二醛 (malondialdehyde,MDA)检测试剂盒购于南京建成生物工程所(批号:20171103)。
1.2 主要仪器 AR224CN电子天平购于奥豪斯仪器(上海)有限公司;KQ2200DA型数控超声波清洗器购于昆山市超声仪器有限公司;Synergy H1多功能酶标仪为美国博腾公司产品;Spectrumlab 22PC紫外分光光度计为上海棱光技术有限公司产品。
1.3 方法
1.3.1 种子处理及发芽 采用培养皿发芽法。挑选大小相近、饱满、无虫蛀的急性子,次氯酸钠消毒后,播种于垫有2层定性滤纸的培养皿中,设置不同的浓度梯度,每个浓度梯度100粒种子,3次重复。氯化钠、硫酸钠、碳酸氢钠3种盐等摩尔混合,根据添加混合盐的量不同,设置对照组(0%)、轻度组(0.3%)、中度组(0.6%)、重度组(0.9%)分别进行盐胁迫处理。将培养皿放入组培室,在25℃、80%湿度条件下发芽12d,期间每天观察并记录急性子的萌发情况,并计算发芽率、发芽势、发芽指数等指标。相关指标的计算公式如下:发芽率(%)=(正常发芽的种子数/供试种子总数)×100%;相对发芽率(%)=(处理组发芽率/对照组发芽率)×100%;发芽势 (%)=(第6天正常发芽种子数/供试种子总数)×100%;发芽指数(Gi)=∑Gt/Dt,式中Gt为不同培养时间(t)的发芽种子数,Dt为相应的培养时间;相对盐害率(%)=(对照组发芽率-处理组发芽率)/对照组发芽率×100%。
1.3.2 急性子生理生化指标的测定 称取籽粒饱满、无病虫害的目标种子5g,进行消毒灭菌处理后,分别放入对照组、轻度组、中度组和重度组盐溶液中,置于25℃的培养箱,拍照并记录第0、2、4、6、8天种子萌发的形态变化,测量其含水量,参照《植物生理学实验》的方法测定过氧化物酶(peroxidase,POD)活性[9]145、超氧化物的方法歧化酶 (superoxide dismutase,SOD)活性[9]142,采用羟胺氧化法测定超氧阴离子产生速率[9]137,用植物MDA检测试剂盒测定MDA含量,采用双缩脲法测定可溶性蛋白含量,采用蒽酮比色法测定可溶性糖含量[10]。
1.4 统计学分析 运用Microsoft Excel进行计算及绘图,采用 SPSS 17.0统计软件进行统计学分析。计量资料若符合正态分布且满足方差齐性,以±s表示。多组间均数比较采用两因素方差分析,组间两两比较采用邓肯新复极差法(sum of squares due to regression,SSR)法。各组指标的相关性采用Pearson简单相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 各组急性子发芽情况比较 混合盐处理对急性子发芽的影响显著,其中中度、重度盐处理与对照处理相比,显著降低急性子的发芽率、发芽势、发芽指数(P<0.01),且显著提高相对盐害率(P<0.01);轻度盐处理相较对照组,仅显著减低发芽势和发芽指数(P<0.01),对发芽率和相对盐害率影响不显著(P>0.05)。不同盐处理之间比较,发芽率和相对盐害率差异达到极显著水平(P<0.01),随着盐害水平的增加,发芽率显著降低,相对盐害率显著提高。在发芽指数方面,中度组和重度组与轻度组相比,降低程度分别达到显著(P<0.05)和极显著水平(P<0.01)。 不同盐分处理之间比较,发芽势差异无统计学意义(P>0.05)。由此可见轻度混合盐对急性子萌发无显著影响,高浓度混合盐的相对盐害率高达97.30%,对急性子萌发有明显的抑制作用,且随着浓度的增高,对种子萌发抑制作用增强。见表1。
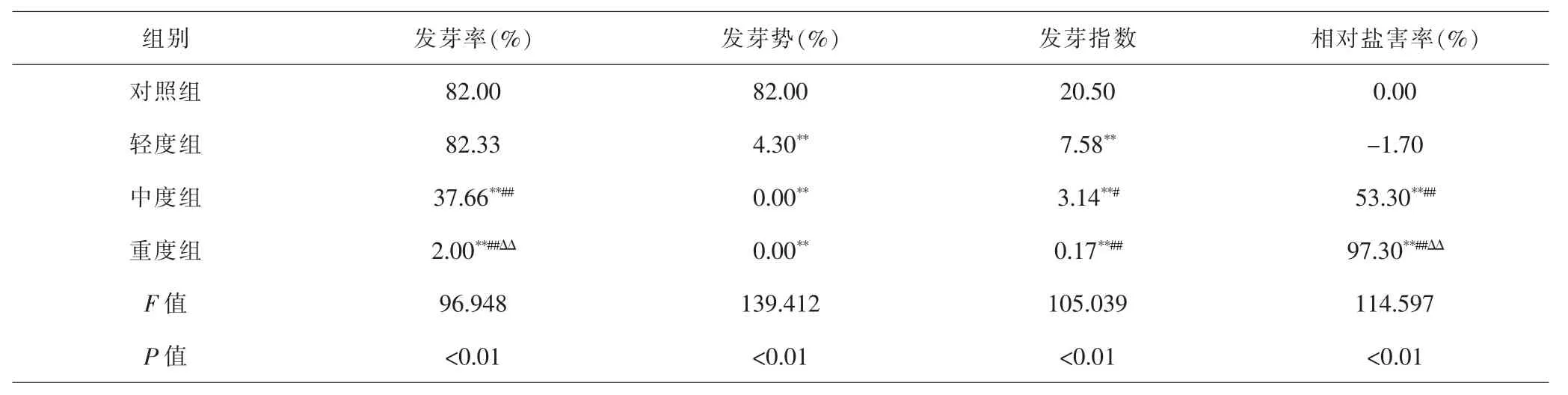
表1 不同混合盐处理下急性子发芽情况比较Tab.1 Comparison of seeds of Impatientis balsamina L.germination under different mixed salt concentration treatments
2.2 各组急性子总芽长比较 混合盐处理对急性子总芽长影响显著,除第2天的轻度组与对照组比较总芽长降低显著(P<0.05),其他各处理组与相同时点对照组相比,总芽长降低极显著(P<0.01)。同一时点内,各组间总体比较差异极显著(P<0.01),但轻、中、重度组盐分处理两两比较,除第6天外,总芽长无显著性差异(P>0.05)。第6天时,中度组、重度组与轻度组相比,总芽长显著降低(P<0.05)。同一组内,随着处理时间的延长,总芽长显著增加(P<0.01)。可见混合盐对急性子总芽长有一定抑制作用。见表2。
表2 不同混合盐处理下急性子总芽长比较(±s,cm)Tab.2 Comparison of the total bud length of Impatientis balsamina L..under different mixed salt concentration treatments(±s,cm)

表2 不同混合盐处理下急性子总芽长比较(±s,cm)Tab.2 Comparison of the total bud length of Impatientis balsamina L..under different mixed salt concentration treatments(±s,cm)
注:与对照组比较,*P<0.05,**P<0.01;与轻度组比较,#P<0.05Note:Compared with control group,*P<0.05,**P<0.01; compared with mild group,#P<0.05
总芽长F值 P值第2天 第4天 第6天 第8天对照组 0.417±0.029 3.067±0.764 8.133±0.551 9.067±2.768 28.652 <0.01轻度组 0.367±0.029* 1.067±0.252** 1.367±0.252** 2.800±0.229** 80.170 <0.01中度组 0.317±0.029** 0.683±0.029** 0.600±0.050**# 0.883±0.257** 10.656 <0.01重度组 0.317±0.029** 0.483±0.029** 0.550±0.087**# 0.433±0.029** 13.094 <0.01 F值 11.000 31.149 434.324 24.129 P 值 <0.01 <0.01 <0.01 <0.01组别
2.3 各组急性子萌发过程含水量比较 种子萌发过程中含水量的变化反映了种子的吸水能力。混合盐处理对急性子含水量影响显著(P<0.01)。第2天时,中度组和重度组与对照组相比,降低程度分别达到显著(P<0.05)和极显著水平(P<0.01),但轻度组与对照组相比,没有统计学差异(P>0.05)。此后几天,各处理组与对照组相比,降低程度均达到极显著性水平(P<0.01);其中第8天时,中度组、重度组与轻度组相比,也显著降低(P<0.01),但中、重度组之间无统计学差异(P>0.05)。而随着处理时间的延长,急性子萌发过程中含水量不断升高,除重度组外,其余各组含水量随着时间延长均显著增加(P<0.01)。萌发第8天时,对照组急性子含水量接近90%,而中、重度组种子含水量仍然只有40%~50%。萌发过程中对照组处理平均含水量为61.19%,中、重度组平均含水量分别为44.27%、42.48%,可见高浓度对急性子吸水能力有显著抑制作用。见表3。
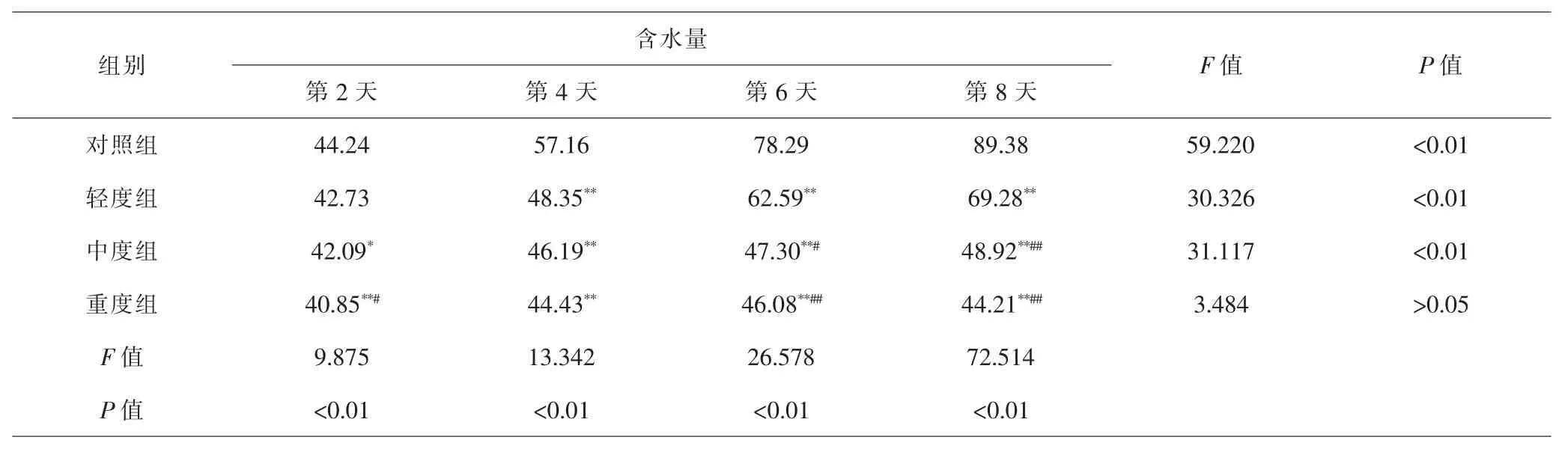
表3 各组急性子萌发过程中的含水量比较(%)Tab.3 Comparison of water content during Impatientis balsamina L.germination in each group(%)
2.4 各组急性子POD活性比较 混合盐处理对急性子POD活性的影响显著,不同浓度混合盐处理下急性子POD活性总体呈现上升的趋势。第4、8天盐浓度各处理组间POD活性差异显著(P<0.05),第6天POD活性差异极显著(P<0.01)。不同处理时间比较,同一组内POD活性呈降低趋势,其中对照组差异有统计学意义 (P<0.01),其余各组差异均无统计学意义 (P>0.05)。见表4。对照组与轻度组萌发过程中平均POD活性分别为0.060U·g-1和0.056U·g-1,差异无统计学意义(P>0.05);而重度组平均POD活性最高,为0.115U·g-1,与对照组相比升高了0.055U·g-1。由此可见,低浓度对急性子POD活性影响不显著,高浓度混合盐显著升高急性子POD活性。
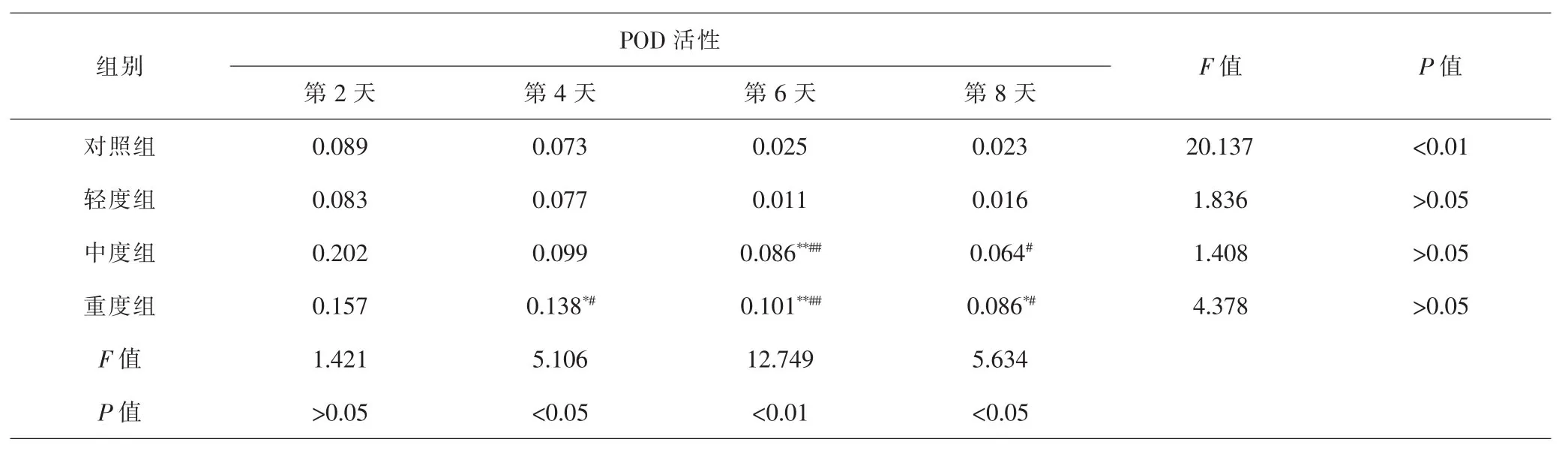
表4 各组急性子POD活性比较(U·g-1)Tab.4 Comparison of Impatientis balsamina L.POD activity in each group(U·g-1)
2.5 各组急性子SOD活性比较 不同浓度混合盐胁迫下,SOD活性总体呈上升趋势,但总体比较混合盐浓度对急性子SOD活性影响不显著(P>0.05)。但第4天时,中度组与对照组比较,SOD活性显著升高(P<0.05);第6、8天中,与对照组比较,重度组SOD活性也显著升高(P<0.05);轻度组与对照组比较均无统计学差异(P>0.05)。但随着处理时间延长,各组SOD活性变化不显著(P>0.05)。见表5。萌发过程中平均SOD活性水平最低的是对照组,为132.169U·g-1;而0.9%浓度处理组平均SOD活性可达144.685U·g-1。由此可见,高浓度对急性子SOD活性有升高作用。
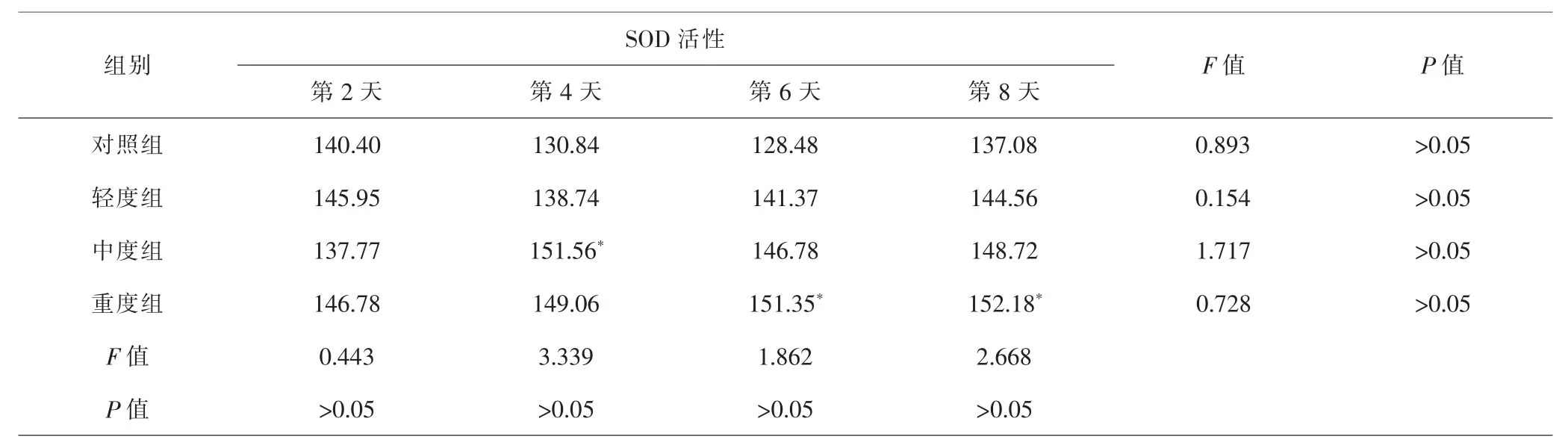
表5 各组急性子SOD活性比较(U·g-1)Tab.5 Comparison of Impatientis balsamina L.SOD activity in each group(U·g-1)
2.6 各组急性子MDA含量比较 混合盐处理对急性子MDA含量的影响不显著(P>0.05)。相同处理时间内,与对照组比较,各处理组急性子MDA含量升高不显著(P>0.05)。随着时间的延长,各组急性子MDA含量呈现连续下降趋势,但差异均无统计学意义(P>0.05)。 见表6。

表6 各组急性子MDA含量比较(nmol·g-1)Tab.6 Comparison of Impatientis balsamina L.MDA activity in each group(nmol·g-1)
2.7 各组急性子超氧阴离子产生速率比较 不同浓度混合盐胁迫下,只有第8天时多组间总体比较急性子超氧阴离子产生速率变化差异极显著(P<0.01)。第8天时,与对照组比较,中、重度组超氧阴离子产生速率显著升高(P<0.01),但轻度组变化不显著(P>0.05)。而随着时间的延长,对照组和轻度组急性子超氧阴离子产生速率大体呈下降的趋势。随着时间的延长,对照组急性子超氧阴离子产生速率总体呈现下降趋势,差异有统计学意义(P<0.05);其他各处理组急性子超氧阴离子产生速率差异无统计学意义(P>0.05)。见表7。随着混合盐浓度增加,萌发过程中平均超氧阴离子产生速率增加。对照组平均超氧阴离子产生速率处于较低水平,为137.05μmol/(g·h);而重度组平均超氧阴离子产生速率值可达219.13μmol/(g·h),由此可见高浓盐胁迫会促进超氧阴离子产生。

表7 各组急性子超氧阴离子产生速率比较[μmol/(g·h)]Tab.7 Comparison of the rate of O2-production in each group[μmol/(g·h)]
2.8 各组急性子可溶性蛋白含量比较 混合盐处理对急性子可溶性蛋白含量影响显著。相同处理时点,中度组、重度组与对照组比较,急性子可溶性蛋白含量变化显著,其中第2天时,变化差异极显著(P<0.01),第4天时,变化差异分别为显著(P<0.05)和极显著(P<0.01);轻度组与对照组比较,只有第8天显著降低(P<0.05),其他时间点变化均不显著(P>0.05)。而不同盐分处理之间,中、重度组与轻度组相比,变化程度大多达到极显著水平(P<0.01)和显著水平(P<0.05)。各组急性子可溶性蛋白的含量随着时间延长显著下降(P<0.01)。见表8。由此可见,低浓度混合盐处理对急性子可溶性蛋白含量无明显影响,但高浓度组对其有一定胁迫作用。
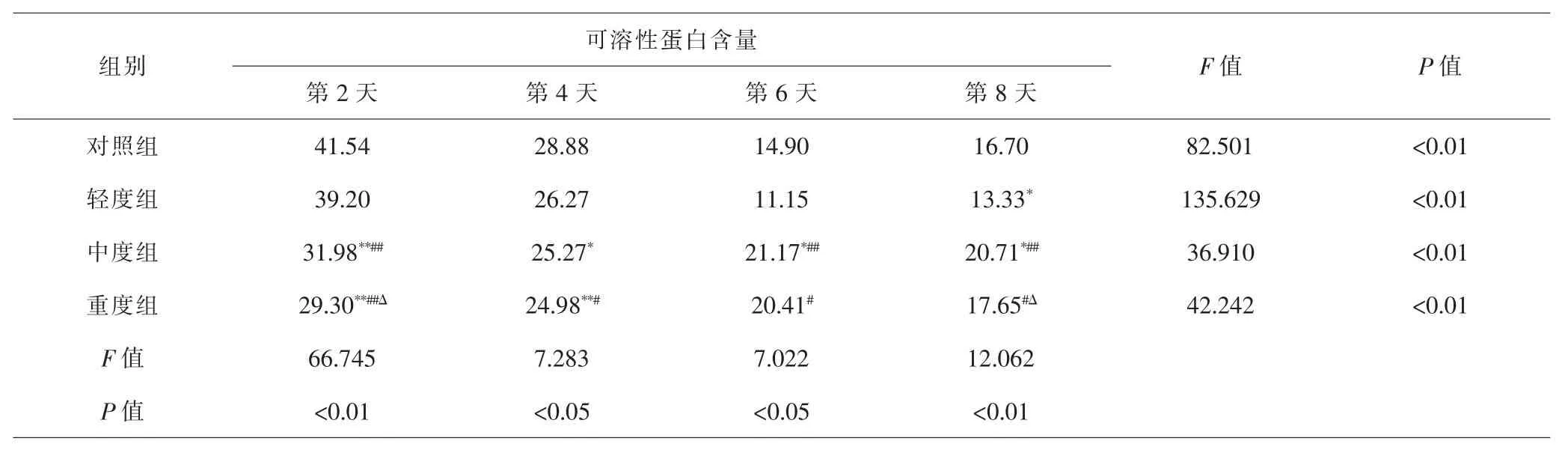
表8 各组急性子可溶性蛋白含量比较(μg·g-1)Tab.8 Comparison of soluble protein content in each group(μg·g-1)
2.9 各组急性子可溶性糖含量比较 混合盐处理对急性子可溶性糖含量的无显著影响。随着混合盐浓度升高,萌发过程中可溶性糖含量呈降低趋势,但组间差异无统计学意义(P>0.05)。但第4天时,重度组急性子可溶性糖含量与对照组、轻度组、中度组比较显著降低(P<0.05)。随着时间的延长,急性子可溶性糖含量大致呈上升趋势,其中对照组随不同时间变化差异显著(P<0.05),重度组随不同时间变化差异极显著(P<0.01)。见表9。对照组萌发过程中平均可溶性糖含量最高,达0.047μg·g-1;重度组平均可溶性糖含量最低,为0.041μg·g-1,由此可见,混合盐对急性子可溶性糖含量有一定抑制作用。

表9 各组急性子可溶性糖含量比较(μg·g-1)Tab.9 Comparison of soluble sugar content in each group(μg·g-1)
2.10 各组急性子指标相关性分析 对各组指标的平均值进行变量间简单相关分析。盐浓度与含水量(r=-0.9660)呈负相关(P<0.05);与SOD活性(r=0.9735)、超氧阴离子产生速率(r=0.9806)呈正相关(P<0.05)。盐浓度与发芽率(r=-0.9466)、总芽长(r=-0.8722)、可溶性蛋白(r=-0.4531)、可溶性糖(r=-0.9322)呈负相关,但相关性不显著(P>0.05);与POD活性(r=0.9026)、MDA含量(r=0.8776)呈正相关,但相关性不显著(P>0.05)。
3 讨论
3.1 不同浓度混合盐胁迫对种子萌发的影响 种子萌发阶段的耐盐状况在一定程度上反映了植物的耐盐程度,可以作为耐盐植物早期选择与评价的指标[11]。种子萌发期是其耐盐能力相对较弱的时期,盐胁迫可减少种子水分吸收,从而降低细胞渗透性,改变种子新陈代谢能力[12]。综合不同混合盐胁迫下急性子的发芽率、发芽势、发芽指数、相对盐害率,结果表明混合盐浓度对急性子正常萌发有显著影响,随着盐浓度升高,急性子发芽活性受到抑制,含水量持续降低。在高盐浓度(0.9%)条件下,种子的发芽速率明显减慢,含水量下降,由此可知盐浓度可以影响植物细胞渗透调节,混合盐浓度较高会阻碍细胞吸水,破坏细胞膜的结构,使细胞无法进行渗透调节,从而导致细胞正常生命活动受到阻碍,吸水能力下降,种子难以发芽[13]。
高浓度混合盐抑制急性子的萌发,降低其发芽率;轻度盐胁迫下的急性子发芽率与对照组比较差异无统计学意义,但是发芽指数却显著低于对照组,同时其总芽长也显著降低,可能因为轻度混合盐溶液有杀菌消毒作用,有利于急性子萌发,但对种子活性没有促进作用。随着混合盐浓度增加,对种子萌发的抑制作用逐渐加强,浓度越高,萌发时间越久,生长速度越缓慢,相对盐害率越大;当盐浓度达0.9%时,盐害率高达97.30%。由此可见,急性子具有一定耐盐性,混合盐浓度在一定范围内(<0.3%),急性子可以正常发芽。
3.2 不同浓度混合盐胁迫对种子生理生化指标的影响 植物体内抗氧化酶系统包括POD、SOD、过氧化氢酶(catalase,CAT),可以保护细胞膜,使其免受活性氧(reactive oxygen species,ROS)或其他过氧化物自由基的伤害。POD具有很强的活性,可以有效清除细胞内的过氧化氢,起到保护植物细胞的作用[14]。SOD与质膜损伤造成的种子劣变及种子耐贮性下降有密切关系,能够防止种子劣变,提高种子抗性[15]。MDA是种子氧化应激反应过程中的产物,影响着种子的质量[16],能够间接反映细胞损伤程度。可溶性蛋白为种子的发育及生长提供养料和能量,调控着种子的代谢及生理生化过程,在种子萌发、发育,直到幼苗形成的过程中起到极为重要的作用[17]。可溶性糖既是合成其他有机溶质的碳架来源,又是渗透调节剂,还可在细胞内无机离子浓度高时起到保护酶类的作用[15]。
POD和SOD活性测定结果提示,短时间高浓度混合盐胁迫致使POD活性增加,重度组POD活性高于对照组及轻度组。POD活性增高能够保护植物细胞,混合盐浓度越高,POD活性越高;但时间一长,保护系统受到破坏,则会抑制酶活性。本研究还发现,种子发芽后,POD活性呈现降低趋势。SOD是需氧生物中普遍存在的一种酶,能够清除超氧阴离子自由基。高浓度盐胁迫能够诱导SOD活性增强,有效清除植株体内的ROS,减少氧化伤害,从而维持种子的萌发[13]。本研究证实轻、中、重度混合盐处理组SOD活性高于对照组,说明在盐胁迫下,SOD活性增高有利于消除种子内的ROS自由基和过氧化物。
在衰老或逆境条件下,植物体内产生超氧阴离子并大量堆积,对植物造成较大的伤害[9]。本研究结果提示,高浓度盐胁迫下,种子产生超氧阴离子速率大于对照组,证实细胞膜系统受到破坏。
MDA是细胞膜脂过氧化产物,植物在盐胁迫下产生的大量ROS自由基会引起植物的膜脂过氧化,造成MDA的积累,MDA含量可以直接反映种子受伤害的程度[18]。本研究发现,随着时间的延长,对照组急性子MDA含量呈现连续下降趋势;重度组MDA含量则基本平稳,可能是盐胁迫下细胞膜破坏导致MDA积累所致。组间比较,轻度组MDA含量与对照组差异无统计学意义,重度组MDA含量高于轻度组,但差异也无统计学意义,表明本研究中不同浓度的盐胁迫对急性子细胞影响较小。分析原因,笔者认为一方面可能由于本研究中所选混合盐浓度本身对MDA含量影响就比较小,另一方面本研究中盐胁迫程度可能还处于急性子自身代偿范围内。
种子发育过程中积累的贮藏物质(如可溶性糖、可溶性蛋白)是种子萌发、幼苗生长早期所需的物质,反映了种子内可利用态物质和能量的供应基础[11]。可溶性蛋白、可溶性糖测定结果发现,萌发过程中可溶性糖含量升高,对盐胁迫下的急性子有一定的保护作用,其中轻度混合盐胁迫对可溶性糖含量影响不显著,而高浓度混合盐胁迫破环了急性子的细胞结构,使可溶性糖含量增加的趋势受到抑制,且抑制效果显著。种子萌发过程中盐胁迫破坏了种子蛋白质的结构,混合盐浓度越高,可溶性蛋白含量越低。
综上所述,本研究提示混合盐胁迫对急性子萌发过程和生理特性有显著的影响,且浓度越高影响越明显;同时证实急性子对轻度混合盐胁迫具有一定耐受性,但对高浓度混合盐胁迫较为敏感。

