SIRT1/SIRT3轴在糖尿病肾病肾小管-间质损伤中的作用研究
印媛君 郭燚 唐比强 毛稳 赵娜 杜月光
浙江中医药大学 杭州 310053
糖尿病肾脏疾病(diabetic kidney disease,DKD)是糖尿病最主要的进行性微血管并发症,是导致终末期肾病的原因之一,其病理特点包括肾小球硬化、肾小管萎缩、肾小管间质纤维化等。研究发现,DKD的早期即出现肾小管损伤,并引起肾小球的病变,而肾小管-间质病变与肾脏损伤的关系更加紧密[1]。
肾小管是葡萄糖重吸收的主要场所。血糖升高时,肾小管线粒体内的氧化磷酸化反应明显增强,活性氧(reactive oxygen species,ROS)的大量产生可引起肾小管上皮细胞损伤和间质纤维化[2]。线粒体自噬(mitophagy)是一种选择性自噬,可以特异性选择并清除受损或老化的线粒体,减少细胞内的ROS,从而维持机体自身稳态[3]。研究发现,线粒体自噬的缺陷与肾脏疾病的发生发展密切相关[4]。
沉默信息调节因子1(silent information regulator 1,SIRT1)和SIRT3为Sirtuins家族成员,具有烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)依赖的组蛋白去乙酰化酶活性,参与细胞衰老、抗氧化应激和能量代谢等多种细胞功能活动的调节,与衰老相关性疾病、代谢性疾病等密切相关[5]。研究表明,SIRT1可调节多种与线粒体增殖和自噬相关的转录因子表达及活性,对线粒体质量和数量的调节起着重要的作用[6]。SIRT3主要定位于线粒体,是主要的蛋白去乙酰化酶,通过调节线粒体内关键蛋白的乙酰化状态与活性来维持线粒体的正常生理功能[5]。基于SIRT1和SIRT3在线粒体结构和功能调节中的作用,笔者推测两者有一定的联系。因此,本研究通过腺病毒转染使Zucker糖尿病肥胖(Zucker diabetic fatty,ZDF)大鼠发生SIRT1过表达,观察其对线粒体自噬的影响以及SIRT3表达的影响,以进一步阐明SIRT1、SIRT3在DKD中的作用以及SIRT1与SIRT3的关系。
1 材料和方法
1.1 材料
1.1.1 实验动物 清洁级雄性ZDF大鼠16只,8周龄,体质量(265±10)g;清洁级雄性ZL大鼠8只,8周龄,体质量(180±10)g,均购于北京维通利华实验动物技术有限公司[实验动物生产许可证号码:SCXK(京)2016-0006],饲养于浙江中医药大学动物实验研究中心,[实验动物使用许可证号码:SYXK (浙)2018-0012]。大鼠自由饮水和进食,12h交替照明。
1.1.2 试剂与仪器 高脂高糖饲料(配方:50%基础饲料、15%蔗糖、15%蛋黄粉、10%全脂奶粉、10%猪油)购自南通特洛菲饲料科技有限公司(批号:pumina#5008);α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体、p62抗体、SIRT3抗体和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3 phosphate dehydrogenase,GAPDH)抗体均购于英国Abcam公司(批号:ab21027、ab56416、ab118334、ab181602);SIRT1抗体购于 英国Biorbyt公司(批号:orb19330);微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)抗体购于美国CST公司(批号:CST4108);山羊抗小鼠免疫球蛋白G(immunoglobulin G,IgG)二抗和山羊抗兔IgG二抗均购于美国Thermo Pierce公司(批号:31160、31210); 实时定量聚合酶链式反应 (Real-time polymerase chain reaction,Real-time PCR) 试剂盒购于北京康为世纪生物科技有限公司 (批号:CW0957M);逆转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser购于宝日医生物技术(北京)有限公司(批号:RR047A)。7020型全自动生化分析仪为日本日立公司产品;Thermo多功能酶标仪购于美国Varioskan Flash Thermo公司;LightCycler480型PCR仪购于瑞士罗氏公司;S1000 Thermal Cycler、Mini-Protein电泳系统及Mini Trans-Blot转印系统均购于美国Bio-Rad公司;紫外分光光度计为美国Beckman公司产品;低温高速离心机购于德国Eppendorf公司。
1.2 方法
1.2.1 分组与给药 ZDF大鼠适应性喂养1周后改为高脂高糖饲料喂养,4周后尾部取血检测空腹血糖(fasting blood glucose,FBG),以FBG≥7.8mmol·L-1为建模成功。根据血糖值将大鼠随机分为模型组、SIRT1过表达组,继续高脂高糖饲料喂养10周;将8只ZL大鼠设为正常组,以普通饲料喂养10周。SIRT1过表达组大鼠于实验第1天尾静脉注射重组腺病毒-SIRT1(adenovirussirt1,Ad-SIRT1),1周后再次注射重组Ad-SIRT1。
1.2.2 标本收集 实验结束前1d收集大鼠24h尿液,用于测定尿蛋白(urinary protein,UP)和尿微量蛋白(urinary albumin,U-ALB)水平。 各组大鼠禁食8h后,以10%水合氯醛按照3.5mg·kg-1的剂量进行腹腔注射麻醉,心脏采血,4℃下4 000r/min离心10min,收集血清,用于检测生化指标。分离大鼠肾脏,去包膜,对切,部分肾组织以10%中性甲醛溶液固定,用于病理检测;其余部分行快速液氮冷冻,-80℃保存,用于蛋白及mRNA表达检测。
1.2.3 生化指标检测 采用全自动生化分析仪检测FBG、UP、U-ALB和血肌酐(serum creatinine,Scr)水平。
1.2.4 肾组织病理观察与分析 取一侧肾脏,去除包膜,10%中性甲醛溶液固定,常规脱水、透明、包埋、切片,行苏木素-伊红(hematoxylin-eosin,HE)染色和Masson染色,光镜下观察肾脏病变和纤维化程度,每张切片观察20个视野。肾小管-间质损伤(tubuloint-erstitial injury,TI)程度评分参考文献[7]:TI0:正常肾小管与肾间质;TI1:动脉周围纤维化;TI2:肾小管周围纤维化;TI3:透明管型伴局灶纤维化;TI4:局灶纤维化伴大范围成纤维细胞浸润。损伤程度分数根据以下公式计算:损伤分数(分)=(0×TI0数量+1×TI1数量+2×TI2数量+3×TI3数量+4×TI4数量)/(TI0+TI1+TI2+TI3+TI4)总数。
1.2.5 Real-time PCR检测肾组织SIRT1和SIRT3 mRNA表达 采用Trizol提取肾组织总RNA,测定并计算RNA的纯度和浓度,再将RNA逆转录合成cDNA;用SYBR Green嵌合荧光法进行RT-PCR扩增。PCR引物由上海生工生物工程公司合成。见表1。反应条件:95℃预变性10min,95℃变性15s,60℃退火延伸1min,共40个循环。每个样本设置3个复孔,取其循环阈值(cycle threshold,Ct)均值,计算各组的△Ct(△Ct=Ct目的基因-Ct内参基因),以2-△△Ct表示基因的相对表达量(△△Ct=各实验组△Ct值-正常组△Ct值)。

表1 引物序列Tab.1 Primer sequences
1.2.6 Western blot检测肾组织蛋白表达 取大鼠肾脏标本剪碎,加入适量裂解液,提取总蛋白,二喹啉甲酸(bicinchnininc acid,BCA)法测定蛋白浓度。十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE) 电泳后,转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,以含5%脱脂奶粉的Tris-盐酸缓冲液(hydrochloric acid buffer solution,T-TBS) 室温封闭1h,分别加入一抗(SIRT1稀释比例为1∶200、SIRT3为1∶500、p62为1∶200、LC3为1∶1 000、Parkin为1∶1 000、GAPDH为1∶10 000),4℃孵育过夜,洗膜后加入二抗(稀释比例为1∶5 000) 室温孵育2h,T-TBS洗膜后发光显影,以Image J软件分析条带的光密度值。目的蛋白相对表达量=目的蛋白光密度值/内参蛋白光密度值×10。
1.2.7 免疫组化检测肾组织内α-SMA表达 使用免疫组织化学Envision二步法。肾组织经10%甲醛溶液固定,常规脱水、透明、石蜡包埋、切片,切片常规脱蜡、水化、煮沸修复抗原,以3% H2O2封闭内源性过氧化酶,滴加一抗(工作浓度为1:100),湿盒中4℃孵育过夜,磷酸缓冲液(phosphate buffer solution,PBS)冲洗后滴加Envision工作液,室温孵育30min,PBS冲洗,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素复染,水洗后树胶封片,光镜下观察。
1.3 统计学分析 采用SPSS 19.0统计软件进行统计学分析。计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况比较 正常组大鼠实验期间一般情况无异常。与正常组比较,实验后期模型组大鼠体型明显肥胖,被毛干枯无光泽,脱毛严重,活动量明显减少,伴多尿;SIRT1过表达组一般情况较模型组有所改善。
2.2 各组大鼠生化指标比较 与正常组比较,模型组大鼠FBG、UP、U-ALB和Scr水平均明显升高,差异有统计学意义(P<0.01)。与模型组比较,SIRT1过表达组FBG水平明显降低 (P<0.01),Scr和U-ALB水平降低,差异都有统计学意义(P<0.05);UP水平有所下降,但差异无统计学意义(P>0.05)。 见表2。

表2 各组大鼠生化指标比较Tab.2 Comparison of biochemical indexes in each group
2.3 各组大鼠肾组织病理形态改变 HE染色和Masson染色结果显示正常组肾小球和肾小管结构正常。模型组肾小球基底膜和系膜区局灶性基质增生;肾小管-间质呈局灶性病变:肾小管萎缩,出现管型,部分肾小管扩张,间质炎细胞浸润、纤维增生。SIRT1过表达组肾小球、肾小管-间质病变程度明显减轻。见图1、2。

图1 各组大鼠肾组织病理形态改变(HE染色,400×)Fig.1 Morphological changes of renal tissues in each group(HE staining,400×)
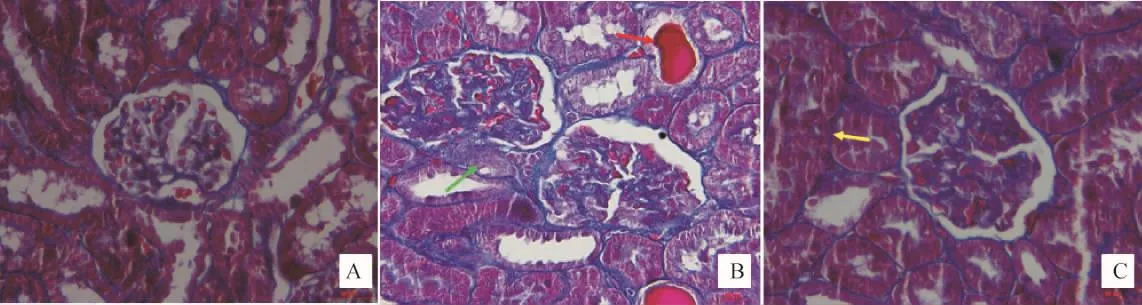
图2 各组大鼠肾组织病理形态改变(Masson染色,400×)Fig.2 Morphological changes of renal tissues in each group(Masson staining,400×)
TI评分提示,与正常组比较,模型组肾小管及间质损伤程度明显加重,差异有统计学意义(P<0.01);与模型组比较,SIRT1过表达组肾小管及间质损伤程度明显降低,差异有统计学意义(P<0.01)。见图3。

图3 各组大鼠TI评分比较Fig.3 Comparison of the TI scores in each group
2.4 各组大鼠肾组织α-SMA的表达 正常组肾组织血管平滑肌可见有α-SMA表达;模型组肾组织除了血管平滑肌有α-SMA的表达外,间质内可见较多的α-SMA表达阳性的细胞;SIRT1过表达组肾组织间质内α-SMA表达阳性细胞较少。见图4。与正常组比较,模型组肾间质α-SMA阳性细胞数增加,差异有统计学意义(P<0.01);与模型组比较,SIRT1过表达组肾间质α-SMA阳性细胞数减少,差异有统计学意义(P<0.01)。 见图5。

图4 各组大鼠肾组织α-SMA蛋白表达(400×)Fig.4 Expression of α-SMA in renal tissues in each group(400×)
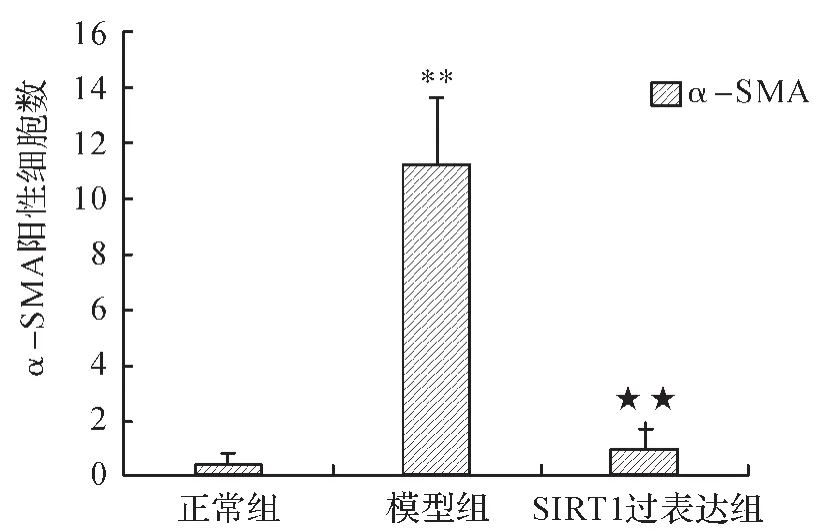
图5 各组大鼠肾组织中α-SMA阳性细胞数比较Fig.5 Comparison of the number of α-SMA positive cells in renal tissues in each group
2.5 各组大鼠肾组织中SIRT1和SIRT3 mRNA表达比较与正常组比较,模型组SIRT1和SIRT3mRNA表达降低,差异有统计学意义 (P<0.05);与模型组比较,SIRT1过表达组SIRT1和SIRT3 mRNA表达增高,差异有统计学意义(P<0.05,P<0.01)。 见图6。

图6 各组大鼠肾组织中SIRT1和SIRT3 mRNA表达比较Fig.6 Comparison of SIRT1 and SIRT3 mRNA expression in renal tissues in each group
2.6 各组大鼠肾组织SIRT1、SIRT3、LC3、p62和Parkin蛋白表达比较 与正常组比较,模型组SIRT1、LC3 Ⅱ/Ⅰ、Parkin蛋白表达明显降低(P<0.01),p62表达升高(P<0.05);SIRT3有一定程度降低,但差异无统计学意义(P>0.05)。 与模型组比较,SIRT1过表达组SIRT1、LC3 Ⅱ/Ⅰ和Parkin表达明显升高(P<0.01),SIRT3表达升高(P<0.05),p62表达明显降低(P<0.01)。见图7、8。

图7 各组大鼠肾组织中SIRT1、SIRT3蛋白表达比较Fig.7 Comparison of SIRT1,SIRT3 protein expression in renal tissues in each group

图8 各组大鼠肾组织中p62、LC3和Parkin蛋白表达比较Fig.8 Comparison of p62,LC3 and Parkin protein expression in renal tissues in each group
3 讨论
DKD是糖尿病最常见的微血管并发症,而且是引起终末期肾疾病的原因之一。肾小球结构和功能的改变一直被认为是DKD发生及发展的关键,但近几年的研究提示,肾小管病变是DKD早期和原始的病理改变;相当部分糖尿病患者存在肾小管和间质细胞的萎缩,而肾小球正常[1]。本研究选用ZDF大鼠建立2型糖尿病模型,它是一种具有自发糖尿病倾向的大鼠品系,研究发现高脂高糖饲料喂养10周后,ZDF大鼠除出现肥胖、胰岛素抵抗、高血糖等符合2型糖尿病的症状外,还出现了U-ALB和Scr明显升高等肾功能障碍的表现,病理学观察显示局部肾小管萎缩,出现管型,部分肾小管扩张,间质炎性细胞浸润、纤维增生,而肾小球病变较轻,提示DKD早期即存在TI。
肾固有细胞尤其是肾小管上皮细胞富含线粒体,线粒体功能正常与否直接影响肾小管上皮细胞的功能。糖尿病导致的肾损伤中,肾小管上皮细胞存在以下病理表现:凋亡、萎缩、上皮间质转化等。研究证实,糖尿病状态下血糖升高,肾小管上皮细胞线粒体内的氧化磷酸化反应明显增强,产生大量ROS,损伤细胞核DNA以及线粒体DNA;同时激活诸多与氧化应激、凋亡、纤维化以及炎症等相关的信号通路,导致肾小管上皮细胞损伤和间质纤维化[2]。
线粒体自噬是细胞维持线粒体稳态和功能的关键调控机制。PTEN诱导的激酶1(PTEN induced kinase 1,PINK1)/Parkin途径是调控线粒体自噬的经典模式,PINK1是一种丝氨酸/苏氨酸激酶,Parkin为一种E3泛素连接酶。当线粒体损伤时,PINK1聚集于线粒体外膜并激活,进而促使Parkin发生磷酸化,并由细胞质转位到线粒体,在线粒体外膜聚集并促进泛素链生成,导致线粒体电压依赖性阴离子通道发生泛素化。发生泛素化的线粒体被自噬调节蛋白p62识别,随之p62与LC-3Ⅱ结合,使损伤的线粒体被自噬体吞噬,并被溶酶体降解[3]。
研究发现,线粒体自噬异常与糖尿病肾损伤的发生发展密切相关。糖尿病早期,机体可以通过增强线粒体自噬,清除受损线粒体以维持肾功能稳定[8-9]。但持续高糖状态下,线粒体自噬能力下降,细胞中ROS大量产生,加快线粒体片段化以及细胞凋亡进程[10-11]。本研究结果显示,Parkin蛋白以及LC3-Ⅱ/Ⅰ在模型组大鼠肾组织内表达显著降低,p62蛋白上调;免疫组化结果显示间质内α-SMA阳性细胞明显增加,进一步证实了DKD肾组织中存在线粒体自噬的下降,并出现肾小管上皮向间质的转化。
SIRT1和SIRT3均为sirtuin家族成员,在调控细胞代谢、凋亡及细胞寿命方面起着重要的作用。研究证实,SIRT1激活可通过抑制炎症、氧化应激、肾纤维化、细胞凋亡等途径激活自噬,从而起到改善DKD的作用[12]。前期研究也表明,SIRT1能够通过抑制炎症及氧化应激,对糖尿病大鼠肾脏以及高糖诱导的肾固有细胞具有保护作用[13-14]。本研究通过转染使ZDF大鼠SIRT1过表达,结果显示肾损伤程度明显减轻;Parkin蛋白以及LC3-Ⅱ/Ⅰ表达明显升高,p62蛋白下调,更直接地证实了SIRT1对糖尿病肾损伤的保护作用。
SIRT3存在于线粒体中,其主要功能是对线粒体的结构和功能进行调节[5]。研究证实,SIRT3在肾脏疾病中发挥保护作用。Huang等[15]研究发现,在顺铂诱导的急性肾损伤动物模型中,重组肾素酶通过上调SIRT3的表达,减少线粒体分裂和ROS生成,抑制氧化应激,从而能够减轻顺铂诱导的急性肾损伤。Wang等[16]通过体内外研究发现,激活SIRT3可诱导线粒体生物合成,并防止肾氧化应激和脂质蓄积。但是关于SIRT1的变化对SIRT3表达的影响却鲜有报导。本研究结果提示,在ZDF大鼠模型中,肾组织SIRT1和SIRT3表达均降低,而SIRT1过表达组SIRT3表达明显升高,提示SIRT1可促进SIRT3的表达,进而改善线粒体自噬功能。Kwon等[17]研究发现,SIRT1可调节SIRT3的乙酰化水平,SIRT1活性的降低可使SIRT3乙酰化水平升高,从而使其活性和稳定性降低,导致线粒体抗氧化功能降低。由此,笔者推测SIRT1表达的增加,除了可使其他底物蛋白去乙酰化外,还可使SIRT3表达增加,并抑制其乙酰化水平,从而改善线粒体功能。
综上所述,SIRT1表达增加对ZDF大鼠肾脏有保护作用,其部分机制可能与促进SIRT3的表达及活性增加,进而改善线粒体的功能,减轻TI有关。不过本研究只是较粗浅地探讨了SIRT1与SIRT3的相互关系,要进一步明确其相互作用,还有待进一步深入研究。

